Радіус атома. Визначення радіуса за ПСХЕ
Про матеріал
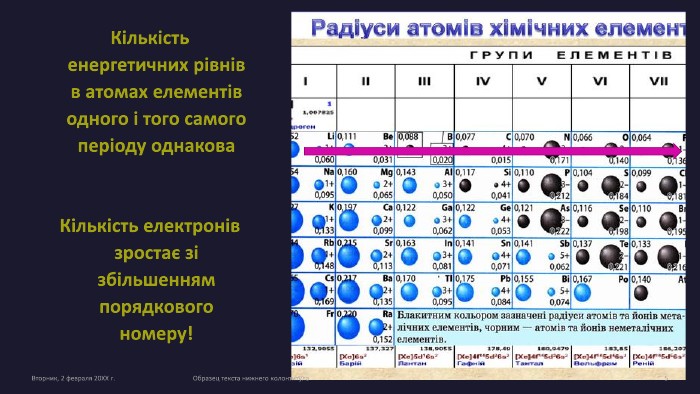
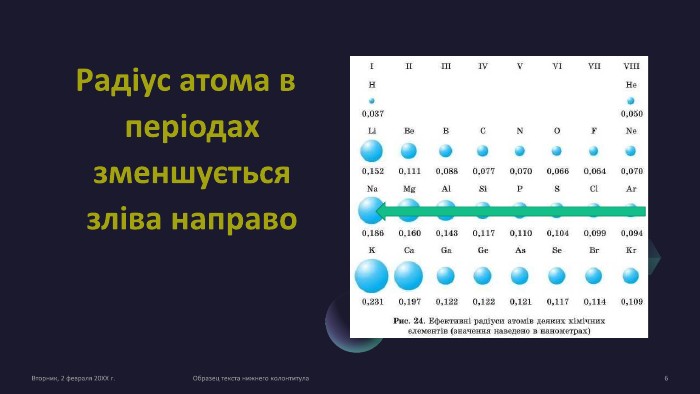
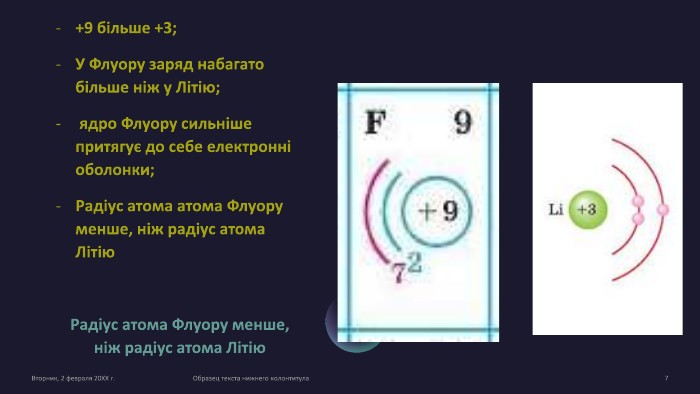
Радіус атома. Поняття радіуса атома. Його визначення за Періодичною системою хімічних елементів. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку