Робочий зошит з хімії для учнів 7 класу (урок 22)
КовальчукГ.І. Робочий зошит з хімії для 7 класу на І семестр
Урок № 22
![]() (число, місяць)
(число, місяць)
Закон збереження маси речовин під час хімічних реакцій.
Схема хімічної реакції. Хімічні рівняння.
Під час хімічних реакцій одні речовини перетворюються в інші. А чи відбуваються якісь зміни з масою речовин в результаті реакції? З цього приводу вчені висловлювали різні думки. Видатний англійський хімік Р. Бойль, прожарюючи у відкритій реторті різні метали і зважуючи їх до і після нагрівання, виявив, що маса металів збільшується. Ґрунтуючись на цих дослідах, він дійшов неправильного висновку, що маса речовини в результаті хімічних реакцій змінюється.
М. В. Ломоносов, на відміну від Р. Бойля, прожарював метали в запаяних ретортах і зважував їх до і після прожарювання. Він довів, що маса речовин до і після реакції залишається без змін. У 1748 році М. В. Ломоносов сформулював найважливіший закон хімії – закон збереження маси.
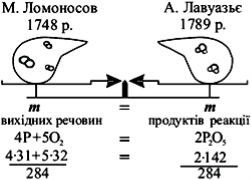 Такий же результат значно пізніше, не знаючи про дослідження Ломоносова, одержав французький учений А. Л. Лавуазьє, який сформулював закон збереження маси у 1789 р.
Такий же результат значно пізніше, не знаючи про дослідження Ломоносова, одержав французький учений А. Л. Лавуазьє, який сформулював закон збереження маси у 1789 р.
Сучасне формулювання закону збереження маси (інколи його ще називають законом Ломоносова-Лавуазьє) має вигляд:
Загальна маса речовин, які вступили в хімічну реакцію, дорівнює загальній масі речовин, які утворилися внаслідок реакції.
Отже, маса вихідних речовин (реагентів) дорівнює масі продуктів реакції. Якщо хімічну реакцію у загальному вигляді виразити схемою А + В = АВ, то закон збереження маси можна записати у такій формі:
m(А + В) = m(АВ).
Закон збереження маси речовин можна пояснити так:
Під час хімічних реакцій атоми не виникають з нічого і не зникають, а лише перегруповуються. Суть хімічної реакції полягає у перегрупуванні атомів.
Загальна кількість атомів не змінюється.
Загальна маса атомів залишається сталою до і після реакції.
Рівняння хімічної реакції є відображенням закону збереження маси
речовин у хімічних реакціях. Маса речовин, що вступили в хімічну реакцію, дорівнює масі речовин, що утворилися в результаті реакції.
Розставляючи коефіцієнти, слід пам'ятати такі правила:
1. Коефіцієнт велика цифра, яка ставиться перед формулою речовини.
2. Коефіцієнт належить всім хімічним елементам, які утворюють речовину.
3. Не можна ставити коефіцієнт всередину формули відповідної речовини.
4. Під час підбору коефіцієнтів перевіряють кількість атомів кожного елемента.
5. Коефіцієнт 1, як і індекс 1, не записується.
6. Оксиген завжди зрівнюють останнім.
7. Якщо кількість атомів елементів у лівій частині відповідає кількості атомів елементів у правій частині заміни знак → у схемі рівняння на знак =.
Розставте коефіцієнти в схемах хімічних рівнянь
1) Fe + Cl2 → FеСІ2
2) Na + С12 → NaС1
3) Аg + S → Аg2S
4) А1 + О2→ А12О3
5) НgО → Нg + О2
6) Na + О2→Nа2О
Запишіть рівняння взаємодії таких простих речовин і доберіть коефіцієнти:
а) водень та азот: ___________________________________________________
б) кальцій і кисень: _________________________________________________
в) магній і бром: ____________________________________________________
г) калій і хлор: _____________________________________________________
д) алюміній і йод: __________________________________________________
Домашнє завдання Вивчити § 16 ст.115-120, впр. 3 а,б ст..121
Розставте коефіцієнти в схемах хімічних рівнянь
|
Cu + O2 → CuO |
|
H2 + F2 → HF |
|
K + Cl2 → KCl |
|
Fe + Br2 → FeBr3 |
|
Na + H2 → NaH |
|
P + O2 → P2O5 |
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
Використана література:
- Хімія: підруч. для 7 класу загальноосвіт. навч. закл./О.В.Григович. – Х.: Вид-во «Ранок», 2015. – 192 сл.: іл..
- Хімія: Робочий зошит: 7 кл./Л.С.Дячук.-Тернопіль: Навчальна книга – Богдан, 2015. – 136 сл.
- Інтернет-ресурси:.
http://osvita.ua/school/lessons_summary/chemistry/34602/
https://www.schoollife.org.ua/testy-himiya-7-9-klasy-zavdannya-vidpovidi/
Для нотаток
__________________________________________________________________________
__________________________________________________________________
__________________________________________________________________________
__________________________________________________________________________
__________________________________________________________________
__________________________________________________________________________
__________________________________________________________________________
__________________________________________________________________
__________________________________________________________________________
__________________________________________________________________________
__________________________________________________________________
__________________________________________________________________________
__________________________________________________________________________
__________________________________________________________________
__________________________________________________________________________
__________________________________________________________________________
__________________________________________________________________
__________________________________________________________________________
1


про публікацію авторської розробки
Додати розробку
