Розробка системи уроків з теми.
Урок №1
Тема: Класифікація хімічних реакцій за різними ознаками.
Мета: узагальнити й систематизувати знання учнів про хімічні реакції, ознайомити із ознаками класифікації хімічних реакцій; розвивати навички і вміння визначати тип хімічних реакцій за рівнянням; навчити розрізняти реакції сполучення, розкладу, заміщення та обміну. Розвивати навички складати рівняння хімічних реакцій, вміння наводити приклади вивчених типів хімічних реакцій.
Обладнання: періодична система хімічних елементів, таблиця розчинності, ряд активності металів, мультимедійна презентація до уроку.
Тип уроку: комбінований
Хід уроку
І. Мотивація навчальної діяльності учнів.
Метод: бесіда
За два роки знайомства з хімією ми вивчили величезну кількість речовин, познайомилися з їх фізичними і хімічними властивостями, навчилися писати рівняння хімічних реакцій. Пригадайте, що таке хімічна реакція та хімічне рівняння.
Хімічна реакція (хімічне явище) – процес, під час якого одна речовина перетворюється на інші відмінні за складом.
Хімічне рівняння – це зображення хімічної реакції за допомогою хімічних формул та коефіцієнтів.
![]()
![]() Наприклад: H2SO4 + 2NaOH → Na2SO4 + 2H2O
Наприклад: H2SO4 + 2NaOH → Na2SO4 + 2H2O
Вихідні речовини, продукти
реагенти реакції
Що показує хімічне рівняння? (речовини, які вступають в хімічну реакцію і речовин, що утворюються внаслідок реакції)
Відомо дуже багато хімічних реакцій. Всі вони індивідуальні. Але хімічні реакції мають ряд спільних ознак, що дає змогу об’єднати їх у кілька типів. Які типи реакцій ви знаєте з курсу хімії 8 класу?
Мета уроку: поглибити, доповнити та розширити знання про типи класифікацій хімічних реакцій. Пригадати класифікацію хімічних реакцій за кількістю і складом реагентів і продуктів реакції. Навчитись розрізняти реакції сполучення, розкладу, заміщення, обміну. Вміти наводити приклади вивчених типів хімічних реакцій.
План:
1. Типи класифікацій хімічних реакцій.
2. Класифікація хімічних реакцій за кількістю і складом реагентів і продуктів реакції:
а) реакції сполучення;
б) реакції розкладу;
в) реакції заміщення;
г) реакції обміну.
ІІ. Вивчення нового матеріалу.
Типи класифікацій хімічних реакцій.
Учні за допомогою підручника і під керівництвом учителя заповнюють таблицю
- Розгляньте таблицю 5 ст. 81 (Хімія 9 кл Н.М. Буринська)
- Складемо схему класифікації хімічних реакцій
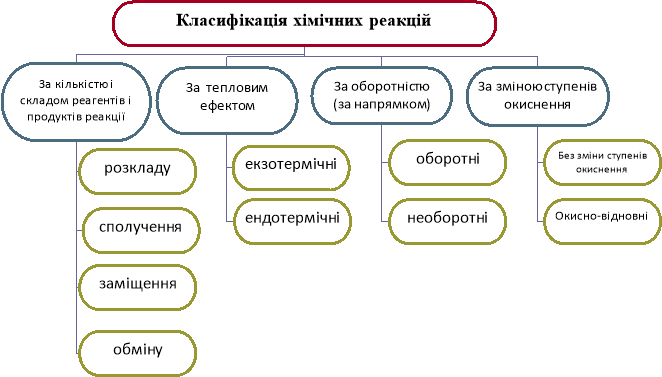
- Розглянемо на сьогоднішньому уроці першу класифікацію: за кількістю і складом реагентів і продуктів реакції
Класифікація хімічних реакцій за кількістю і складом реагентів і продуктів реакції
Учні складають конспект опираючись на власні знання з курсу хімії за 7-8 класи, підручник с.82 -84 (Хімія 9 кл Н.М. Буринська) під керівництвом учителя.
- Реакції сполучення - хімічні реакції, в результаті яких із двох або кількох речовин утворюється одна нова складна речовина.
А +В = АВ
Запропонуйте і запишіть реакції сполучення.
Наприклад:
Zn + S → ZnS
CaO +H2O → Ca(OH)2
- Реакції розкладу - хімічні реакції, в результаті яких із однієї складної речовини утворюється дві чи більше нових речовин.
АВ → А +В
Запропонуйте і запишіть реакції розкладу.
Наприклад:
(NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O
Cu(OH)2 → CuO + H2O
- Реакції заміщення – хімічні реакції між простою і складною речовинами, під час яких атоми простої речовини заміщують атоми одного з елементів у складній речовині, утворюючи нову просту і нову складну речовини.
А +ВС = АС + В
Запропонуйте і запишіть реакції заміщення.
Наприклад:
Zn + 2HCl → ZnCl2 + H2
Fe + CuSO4 → FeSO4 + Cu
- Реакції обміну - хімічні реакції, під час яких дві речовини обмінюються своїми складовими частинками, утворюючи дві нові речовини.
АВ +СD = АD + CВ
Запропонуйте і запишіть реакції обміну.
Наприклад:
NaOH + HCl → NaCl + H2O
CaCl2 + Na2CO3 → CaCO3 + 2NaCl
ІІІ. Узагальнення й систематизація знань.
Бесіда
- Як називається реакція, в результаті якої з однієї складної речовини утворюється декілька простіших?
- Як називається реакція, в результаті якої з декількох речовин утворюється одна зі складнішим складом?
- Як називається реакція, під час якої дві складні речовини обмінюються своїми складовими частинами?
- Як називається реакція, у якій атоми простої речовини заміщують атоми одного з елементів у складній?
Вправи на мультимедійній дошці
- Установіть відповідність між рівняннями хімічних реакцій та їх типами.
1 K2O + H2O = 2KOH; А обміну;
2 3NaOH + H3PO4 = Na3PO4 + 3H2O; Б заміщення;
3 Fe(OH)2 = FeO + H2O; В сполучення;
4 2Na + 2H2O = 2NaOH + H2. Г розкладу;
Д полімеризації.
- Укажіть суму коефіцієнтів у схемі реакції обміну.
Mg + H2O → MgO + H2
FeCl3 + H2SO4 → Fe2(SO4)3 + HCl
- Здійснити перетворення. Вказати тип реакції.
Zn → ZnO → ZnCl2→Zn(OH)2 → ZnO
ІV. Підсумки уроку.
V. Домашнє завдання:
§13 Хімія 9 кл Н.М. Буринська
Впр. 2 с. 84 (всім обов’язково)
Впр. 8с. 85 (для учнів ІІІ і ІV рівня)
Урок №2
Тема: Реакції сполучення, розкладу, обміну, заміщення.
Мета: узагальнити й систематизувати знання учнів про хімічні реакції, формувати навички розпізнавання типів хімічних реакцій, розвивати навички і вміння складати рівняння хімічних реакцій.
Обладнання: періодична система хімічних елементів, таблиця розчинності, ряд активності металів, мультимедійна презентація до уроку, картки із завданнями для самостійної роботи.
Для демонстрації дослідів: паперова стрічка з наклеєним магнієм, залізний цвях, купрум (ІІ) сульфат натрій гідроксид, хлорид на кислота, фенолфталеїн, свіже осаджений купрум (ІІ) гідроксид, сірники, пробірки, тримач.
Тип уроку: формування вмінь і навичок.
Хід уроку
І. Актуалізація опорних знань
Бесіда
- Які класифікації хімічних реакцій ви знаєте? Заповніть пусті місця у схемі (схема на мультимедійній дошці)
Класифікації хімічних реакцій
![]()
![]()
![]()
![]()




![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
- На минулому уроці ми розглянули першу класифікацію хімічних реакцій за кількістю і складом вихідних речовин і продуктів реакції. З’ясували, що бувають реакції сполучення, розкладу, заміщення та обміну. Пригадайте:
- які реакції називаються реакціями сполучення?
- які реакції називаються реакціями розкладу?
- які реакції називаються реакціями заміщення?
- які реакції називаються реакціями обміну?
ІІ. Творче застосування знань, умінь, навичок
- Прийом «Так чи ні»
Встановити, яке твердження вірне, а яке ні:
- Схема А + В = АВ відповідає реакції сполучення.
- Схема АВ = А + В відповідає реакції розкладу.
- Схема А + ВС = АС + В відповідає реакції обміну.
- Схема А В + СД = АД + СВ відповідає реакції заміщення.
- У реакції розкладу бере участь одна складна речовина.
- У реакції сполучення можуть брати участь тільки прості речовини.
- У реакції обміну беруть участь дві речовини, з яких одна проста, а інша -_складна.
- Реакція взаємодії металу з неметалом є реакцією сполучення.
- Реакція взаємодії металу з кислотою є реакцією заміщення.
- Взаємодія кислот з основами є реакцією сполучення.
- Вправа на інтерактивній дошці
Установіть відповідність між рівнянням реакції та типом хімічної реакції:
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
|
5 |
|
|
6 |
|
Рівняння реакцій : Тип реакцій: :
1. 2НCl + Ca = CaCl2 + H2 ; А.Сполучення.
2. 2Fe + 3Cl2 = 2FeCl3 ; Б. Розкладу.
3. CuSO4 + 2NaOH = Cu(OH)2+ Na2SO4; В. Заміщення.
4. Zn + H2SO4 = ZnSO4 + H2; Г. Обміну.
5. 4Al + 3O2 = 2Al2O3
6. CaCO3 = CaO + CO2.
- Демонстрація хімічних реакцій
Перед учнями на демонстраційному столі стоять реактиви: паперова стрічка з наклеєним магнієм, залізний цвях, купрум (ІІ) сульфат натрій гідроксид, хлорид на кислота, фенолфталеїн, свіжеосаджений купрум (ІІ) гідроксид, сірники, пробірки.
Запропонуйте реакції сполучення, розкладу, заміщення і обміну, які можливі між даними речовинами. Проведіть експеримент. Запишіть відповідні рівняння реакцій.
Можливий варіант відповіді учнів:
- 2Mg + O2 → 2MgO – реакція сполучення
- Cu(OH)2 → CuO + H2O – реакція розкладу
- Fe + CuSO4 → Cu + FeSO4 – реакція заміщення
- NaOH + HCl → NaCl + H2O – реакція обміну
ІІІ. Самостійна робота учнів з перфокартами.
Кожен учень отримає перфокарту і завдання. В перфокарту вкладається чистий аркуш паперу. Учні читають завдання. Відповідь позначають у вигляді хрестика у відповідній комірці.
|
|
А |
Б |
В |
Г |
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
|
|
|
|
|
6 |
|
|
|
|
|
7 |
|
|
|
|
|
8 |
|
|
|
|
|
9 |
|
|
|
|
|
10 |
|
|
|
|
І варіант
Позначте в графі
А – реакції сполучення.
Б - реакції розкладу.
В - реакції заміщення.
Г - реакції обміну
- С + O2→CO2
- 2Na+2H2O → 2NaOH + H2
- 2 KMnO4 → K2MnO4+ MnO2 +O2
- SO3+H2O → H2SO4
- 2KOH + H2SO4 → K2SO4 + 2H2O
- BaCl2 + H2SO4 → BaSO4 + 2HCl
- Fe2O3 + 3H2 → 2Fe + 3H2O
- 2NaNO3 → 2NaNO2 + O2
- CuCl2 + Zn → ZnCl2 + Cu
- 2H2O → 2H2+O2
Здійснити перетворення, вказати тип кожної реакції:
Cu → CuO → CuCl2 →Cu(OH)2 → CuO → Cu.
ІI варіант
Позначте в графі
А – реакції сполучення.
Б - реакції розкладу.
В - реакції заміщення.
Г - реакції обміну
- 3Fe+ 2O2→Fe3O4
- Ca+2H2O → Ca(OH)2 + H2
- 2KClO3 →2 KCl + 3O2
- 2H2+O2 →2H2O
- HCl + AgNO3 → HNO3 + AgCl
- 2Fe2O3 +3Si→ 4Fe + 3SiO2
- K2O + H2SO4 → K2SO4 + H2O
- 2Cu(NO3)2 →2CuO + 4NO2 + O2
- FeCl2 + Mg → MgCl2 + Fe
- 4NO2 + 2H2O + O2→ 4HNO3
Здійснити перетворення, вказати тип кожної реакції:
Р → Р2О5 → Н3РО4 → Na3PO4 → Ca3(PO4)2
ІV. Підсумки уроку
V. Домашнє завдання
Повторити §13 Хімія 9 кл Н.М. Буринська
Впр. 3 с. 84, Впр. 4, 5 с. 85 (всім обов’язково)
Творче завдання: скласти кросворд із словами, що зустрічаються в темі «Типи хімічних реакцій»
Урок № 3
Тема: Окисно-відновні реакції, процеси окиснення і відновлення, окисники і відновники.
Мета: познайомити учнів з окисно-відновними реакціями. Сформувати знання про процеси окиснення і відновлення. Навчити прогнозувати окисно-відновні властивості сполук. Розвивати вміння визначати ступені окиснення елементів в речовині, розпізнавати процеси окиснення і відновлення.
Обладнання: періодична система хімічних елементів, мультимедійна презентація до уроку, картки з прикладами завдань.
Тип уроку: комбінований.
Хід уроку
І. Актуалізація опорних знань.
1. Перевірка Д/з
Впр. 3 с. 84, впр. 4, 5 с. 85 (всім обов’язково)
Творче завдання: скласти кросворд із словами, що зустрічаються в темі «Типи хімічних реакцій»
- Кросворд на тему «Типи хімічних реакцій»
|
|
|
|
|
|
|
|
|
6 |
|
7 |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
8 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
9 |
|
4 |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
По горизонталі
- Речовини, що вступають в реакцію.
- Речовина, що утворюється в результаті реакції сполучення.
- Одна із умов протікання реакції обміну.
- Тип реакції, що відбувається між металом і кислотою.
- Хімічні реакції, під час яких дві складні речовини обмінюються своїми складовими частинами, утворюючи дві нові речовини.
По вертикалі
- Реакції, за яких з однієї складної речовини утворюється кілька більш простих.
- Речовина, утворення якої є однією з умов протікання реакції обміну до кінця.
- Реакція між основою і кислотою.
- Хімічні реакції, за яких з двох або кількох речовин утворюється одна складна.
- Речовина, що складається з атомів одного хімічного елемента.
ІІ. Мотивація навчальної діяльності
Ми розглянули один тип класифікації хімічної реакції за кількістю і складом реагентів і продуктів реакції. А які ще є типи? Сьогодні ми почнемо знайомство із з класифікацією реакцій за зміною ступенів окиснення.
Мета: розглянути класифікацію реакцій за зміною ступенів окиснення. Познайомитися з окисно-відновними реакціями, процесами окиснення і відновлення. Навчитися прогнозувати окисно-відновні властивості речовин.
У 8 класі ми вивчали поняття «ступінь окиснення».
- Пригадайте, що називається ступенем окиснення? ( с. 86 Н.М. Буринська. Хімія 9 кл).
- Які значення має ступінь окиснення? (0, +, -)
- Як визначається ступінь окиснення? Визначте ступінь окиснення елементів у речовинах: N2, NaCl, H2SO4.
ІІІ. Вивчення нового матеріалу
Усі хімічні реакції за зміною ступенів окиснення поділяються на 2 групи:

Розглянемо більш детально окисно-відновні реакції.
- Які реакції називаються окисно-відновними? (с. 86 Н.М. Буринська. Хімія 9 кл).
Окисно-відновні реакції - реакції, що відбуваються із зміною ступенів окиснення елементів, які входять до складу реагуючих речовин.
- Приклад запису окисно-відновної реакції
Учні читають алгоритм і під керівництвом учителя складають схему окисно-відновної реакції.
Алгоритм складання окисно – відновних реакцій
- Розставляємо ступені окиснення елементів.
- Визначаємо елементи, що змінили ступені окиснення.
- Виписуємо ці елементи.
- Визначаємо зміну кількості електронів за ступенем окиснення елементів.
- Складаємо електронний баланс.
- Проставляємо коефіцієнти в рівнянні реакції.
- Визначаємо окисник і відновник, процеси окиснення та відновлення.
0 0 +2 -2
2Mg + O2 → 2MgO
![]()
![]()
![]() Mg0 -2℮ → Mg+2 2 2 відновник, процес окиснення
Mg0 -2℮ → Mg+2 2 2 відновник, процес окиснення
4
O20 +4℮ → 2O-2 4 1 окисник, процес відновлення
Знайдіть в підручнику с. 87 - 88 Н.М. Буринська. Хімія 9 кл визначення:
Відновники – атоми, молекули або йони, що віддають електрони.
Окисники - атоми, молекули або йони, що приєднують електрони.
Відновлення – процес приєднання електронів.
Окиснення - процес віддавання електронів.
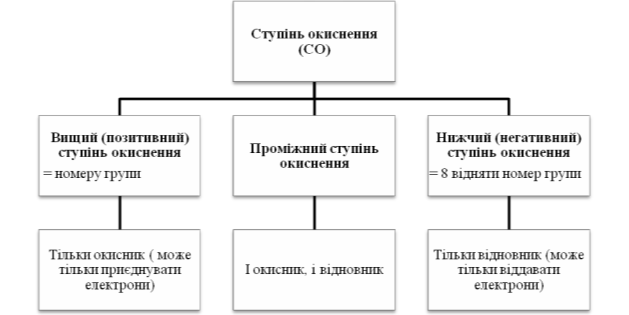
- Речовини залежно від ступеня окиснення можуть бути:
або лише відновниками (лише віддають е)
або лише окисниками (лише приймають е)
або і окисниками і відновниками.
Схема 1.
Схема взаємозв’язку змін ступенів окиснення з процесами окиснення і відновлення
![]() Відновлення – ступінь окиснення зменшується (+℮)
Відновлення – ступінь окиснення зменшується (+℮)
![]() -4, -3, -2, -1, 0, +1, +2, +3, +4, +5, +6, +7, +8
-4, -3, -2, -1, 0, +1, +2, +3, +4, +5, +6, +7, +8
Окиснення – ступінь окиснення збільшується (-℮)
Схема 2
Прогнозування окисно-відновних властивостей сполук.
Приклад 1 до схеми 2
Ступені окисненя Cl -1, 0, +1, +3, +5, +7
![]()
![]()
![]()
лише і окисник, і лише окисник
відновник відновник (найвищий СО)
(найнижчий СО)
Приклад 2 до схеми 2
Ступені окиснення S -2, 0, +2, +4, +6
![]()
![]()
![]()
лише і окисник, і лише окисник
відновник відновник (найвищий СО)
(найнижчий СО)
- Процес окиснення завжди супроводжується процесом відновлення (якщо елемент віддає електрон, то хтось має їх приєднувати)
ІV. Узагальнення і систематизація знань
Робота по картках або на мультимедійній дошці
1.Спрогнозуйте окисно-відновні властивості нижче наведених сполук і розподіліть їх у таблиці
|
Тільки окисник |
Тільки відновник |
І окисник і відновник |
|
|
|
|
N2, CO2, O2, N2O5, NH3, H2SO4конц., SO2, H2S, H2SO3, Zn.
2.Установіть відповідність між схемою перетворення та кількістю електронів, відданих або приєднаних атомами, вкажіть окисник і відновник, процеси окиснення та відновлення.
|
А |
|
|
Б |
|
|
В |
|
|
Г |
|
|
Д |
|
А) Р0 → Р─3 ; 1.+ 4е─
Б) S┼6 → S─2 ; 2. ─4е─
В) Fe┼2 → Fe┼ 3; 3.+ 8е─
Г) Cl20 → 2Cl─; 4. + 3е─
Д) N2 → 2N┼2 5. + 2е─
6. ─1е─
Творче завдання
Вкажіть, як називається вказаний процес і скільки електронів бере в ньому участь
2О─2 → О2,
Напишіть кілька рівнянь реакцій, в яких може відбуватися даний процес.
V. Підсумки уроку.
Домашнє завдання:
§ 14 (с. 86-88) Хімія 9 кл Н.М. Буринська
Впр. 6 с. 91
Підготувати презентацію «Значення окисно-відновних реакцій». (для бажаючих)
Урок №4.
Тема: Окисно-відновні реакції. Їх значення.
Мета: розширити знання учнів про окисно-відновні реакції, показати значення окисно-відновних реакцій в житті людини і в природі; сформувати навички складання найпростіших окисно-відновних рівнянь реакцій; навчити урівнювати окисно-відновні реакції методом електронного балансу.
Обладнання: періодична система хімічних лементів, таблиця розчинності, мультимедійна презентація до уроку, картки із завданнями.
Тип уроку: формування вмінь і навичок
Хід уроку
І. Актуалізація опорних знань
1. Перевірка Д/з Впр. 6 с. 91 Хімія 9 кл Н.М. Буринська
2. Гра з кубиком
Вчитель задає питання і кидає кубик. Відповідає той учень, який спіймав кубик.
- Скільки типів хімічних реакцій виділяють за зміною ступенів окиснення? (2)
- Як називаються реакції, в яких ступінь окиснення атомів не змінюється? (реакції без зміни ступенів окиснення)
- Як називаються реакції, в яких ступінь окиснення атомів змінюється? (окисно-відновні)
- Атом, молекула або йон, які приєднують електрон? (окисник)
- Атом, молекула або йон, які віддають електрон? (відновник)
- Процес приєднання електронів називається… (відновлення)
- Процес віддавання електронів називається… (окиснення)
- Чи може в реакції бути лише процес окиснення? (ні)
- Чи може в реакції бути лише процес відновлення? (ні)
- Елемент з найнижчим ступенем окиснення може бути лише … (відновником)
- Елемент з найвищим ступенем окиснення може бути лише … (окисником)
- Елемент з проміжним ступенем окиснення може бути лише …(і окисником, і відновником)
ІІ. Мотивація навчальної діяльності
Навколо нас в природі відбувається велика кількість хімічних реакції: виверження вулкану, фотосинтез, дихання, травлення… Ми, люди, також широко використовуємо хімічні процеси. Наприклад, горіння сірника, добування металів із руд, приготування їжі та інше. Серед цих хімічних процесів велика кількість належить до окисно-відновних реакцій.
Окисно-відновні реакції надзвичайно поширені і важливі. Де саме вони зустрічаються, яка їх роль в природі і житті людини ми з’ясуємо на сьогоднішньому уроці. Навчимося писати окисно-відновні рівняння, урівнювати рівняння методом електронного балансу.
ІІІ. Вивчення нового матеріалу.
Значення окисно-відновних реакцій
І. Значення окисно-відновних реакцій в біосистемах:
- дихання;
- фотосинтез;
- травлення;
- обмін речовин і енергії.
ІІ. Значення окисно-відновних реакцій в природі:
- грозові розряди;
- виверження вулканів;
- процеси гниття та інші.
ІІІ. Значення окисно-відновних реакцій в хімічному виробництві:
- одержання металів, галогенів, лугів тощо.
- одержання органічних речовин.
- очищення стічних вод, газових викидів підприємств.
- виробництво лікарських препаратів;
- виробництво предметів побуту та інше.
ІV. Значення окисно-відновних реакцій в побуті :
- Корозія металів;
- Потемніння срібних виробів;
- Хімічна завивка волосся;
- Вироблення кисломолочних продуктів;
- Горіння бенгальського вогню;
- Горіння сірників;
- Горіння пропану, бутану в газовій плиті;
- Відбілювання і дезінфекція.
- Горіння палива в двигунах внутрішнього згорання.
ІV. Складання рівнянь окисно-відновних реакцій. Складання електронного балансу.
Учні по-черзі під керівництвом вчителя працюють біля дошки (учні високого рівня за бажанням можуть працювати самостійно, а потім дати зошит на перевірку вчителю)
Доберіть коефіцієнти у схемах окисно – відновних реакцій методом електронного балансу, вкажіть окисник і відновник, процеси окиснення та відновлення.
1. Na + H2O → NaOH + H2 ;
2. Fe2O3 + H2 → Fe + + H2O;
3. KClO3 → KCl + O2 ;
4. Ag + HNO3 → AgNO3 + NO2 +H2O;
5.* PH3 + O2 → P2O5 + H2O;
6. H2S + HNO3 → H2SO4 + NO2 + H2O
V. Домашнє завдання
§ 14 Хімія 9 кл Н.М. Буринська
Впр. 3,4 с. 91 (всім обов’язково)
Впр. 9 с. 92 (за бажанням)
Урок № 5
Тема: Складання найпростіших окисно-відновних реакцій. Підбір коефіцієнтів методом електронного балансу.
Мета: розвивати навички і вміння складати окисно-відновні реакції; розставляти коефіцієнти в окисно-відновних реакціях, застосовуючи метод електронного балансу.
Тип уроку: узагальнення й систематизація знань, умінь і навичок.
Обладнання: періодична система хімічних лементів, таблиця розчинності, картки із завданнями.
Хід уроку
І. Мотивація навчальної діяльності.
Перевірка домашнього завдання Впр.3,4 с. 91 (всім обов’язково) Впр 9 с. 92 (за бажанням)
На сьогоднішньому уроці ви (учні) будете працювати самостійно. Ми повинні закріпити знання про окисно-відновні реакції, процеси окиснення і відновлення, вдосконалити вміння писати окисно-відновні реакції, складати електронний баланс.
ІІ. Самостійне виконання вправ.
Експрес – контроль
Учні отримують картки із тестами. Тести учні виконують самостійно, а потім взаємоперевірка виконаної роботи.
- Метали мають такі ступені окиснення:
А. нульовий; Б. позитивний; В. негативний.
2. Окисно – відновні реакції, це реакції, в яких:
А. не змінюється ступінь окиснення елементів;
Б. змінюється ступінь окиснення елементів;
В. визначення належності до окисно - відновних реакцій не пов’язано із ступенем окиснення елементів.
3. Відновники – це атоми, молекули або йони, що:
А. приєднують електрони;
Б. віддають електрони;
В. здатні і віддавати і приєднувати електрони.
4. Окисники - це атоми, молекули або йони, що:
А. приєднують електрони;
Б. віддають електрони;
В. здатні і віддавати і приєднувати електрони.
5. Відновлення – це процес :
А. приєднання електронів ;
Б. віддавання електронів;
В. не пов’язаний із переходом електронів.
6. Який процес відбувається в зазначеній схемі
2Н┼1 + 2е ¯→ Н˚2
А. відновлення;
Б. окиснення.
7. При відновленні ступінь окиснення елемента:
А. зменшується;
Б. збільшується ;
В. не змінюється.
8. Елемент з найнижчим ступенем окиснення може бути:
А. тільки відновником;
Б тільки окисником;
В. і відновником і окисником;
9. Елемент з найвищим ступенем окиснення може бути:
А. тільки відновником;
Б тільки окисником;
В. і відновником і окисником;
10. Елемент проміжним ступенем окиснення може бути:
А. тільки відновником;
Б тільки окисником;
В. і відновником і окисником;
11.Укажіть схему, що відповідає перетворенню N0 →N─3:
А.1S22S22P3 ─3e─ →1S22S2;
Б. 1S22S22P3 +3e─ →1S22S22Р6;
В.1S22S22P5 +1e─ →1S22S22Р6;
Г. 1S22S22P3 _3e─ →1S22S22Р6.
12. Вкажіть кількість електронів,відданих або приєднаних атомом в схемі S─2 → S┼6 :
А. 2е─;
Б. 6е─;
В. 8е─ .
Відповіді: 1. А, Б
- Б
- Б
- А
- А
- А
- А
- А
- Б
- В
- Б
- В
Самостійна робота над рівняннями.
Підберіть коефіцієнти в рівняннях реакцій, використовуючи електронний баланс.
Вкажіть окисник і відновник.
- Al + HCl → AlCl3 + H2 ;
- Ca + O2 → CaO;
- N2 + O2 → NO;
- Na + H2SO4 →Na2SO4 + H2;
- P + HNO3 → HPO3 + NO2 +H2O
- Fe + Cl 2 → FeCl3;
- KMnO4 + SO2 + H2O → H2SO4 + MnO2 + KOH;
- H2S + HNO3 → S + NO + H2O;
- KI + FeCl3 → I2 + FeCl2 + KCl;
- CuCl2 + Al → AlCl3 + Cu.
ІІІ. Підведення підсумків уроку.
Домашнє завдання:
§ 14 Хімія 9 кл Н.М. Буринська
Впр. 7 с. 92 (всім обов’язково)
Впр 8 с. 92 (за бажанням)
Урок № 6
Тема: Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння.
Мета: познайомити учнів з поняттям «тепловий ефект хімічної реакції», термохімічні рівняння»; розширити уявлення про хімічні реакції на прикладі ендотермічних і екзотермічних реакцій; формувати навички і вміння складати термохімічні рівняння реакцій, розв’язувати задачі з їх використанням.
Обладнання: періодична система хімічних елементів, таблиця розчинності, ряд активності металів, мультимедійна презентація до уроку. Для демонстрації: папірець з наклеєним магнієм, сірники, свіже осаджений купрум(ІІ)гідроксид, тримач, пробірка.
Тип уроку: комбінований
Хід уроку
І. Актуалізація опорних знань.
Бесіда
- За якими ознаками класифікують хімічні реакції?
- Які типи реакцій за кожною з цих ознак ви знаєте?
- Які типи реакцій ми вже вивчили?
- Пригадайте ознаки хімічних реакцій. (Виділення газу, осаду, поява запаху, зміна забарвлення, виділення або поглинання енергії)
ІІ. Мотивація навчальної діяльності.
Під час хімічних реакцій зберігається число атомів, їхня маса, але змінюються хімічні зв’язки між атомами: одні руйнуються (при цьому енергія витрачається), інші виникають (при цьому енергія вивільняється). В результаті реакції тепло виділяється або поглинається. Саме за цією ознакою реакції поділяються на екзотермічні і ендотермічні. Познайомимося докладніше з цією класифікацією.
Мета уроку:
- познайомитися з класифікацією реакцій за тепловим ефектом: з екзотермічними і ендотермічними реакціями;
- навчитися писати термохімічні рівняння реакцій;
- навчитися розв’язувати задачі з використанням термохімічних рівнянь реакцій.
ІІІ. Вивчення нового матеріалу.
Розповідь вчителя з елементами бесіди.
- Знайдіть в підручнику (с. 95 Хімія 9 кл Н.М. Буринська) що називається тепловим ефектом реакції?
Тепловий ефект реакції – кількість теплоти, що виділяється чи поглинається під час хімічних реакції.
2. Тепловий ефект позначається:
а) Q – показує скільки теплоти (в кДж) виділилося або поглинулося під час реакції;
б) ∆ Н – показує різницю між вмістом енергії у вихідних речовинах і кінцевих продуктах
(ентальпія)
∆ Н = - Q
3. Тепловий ефект вимірюється в Дж або в кДж
4. Знайдіть в підручнику(с. 96. Хімія 9 кл Н.М. Буринська) як називаються хімічні реакції, в яких зазначається тепловий ефект реакції?
Хімічні рівняння, в яких зазначено кількість теплоти, що виділяється або поглинається, називаються термохімічними рівняннями.
- Пояснення схеми з демонстраціями дослідів:
а) горіння магнію – екзотермічна реакція
б) розклад купрум (ІІ) гідроксиду – ендотермічна реакція
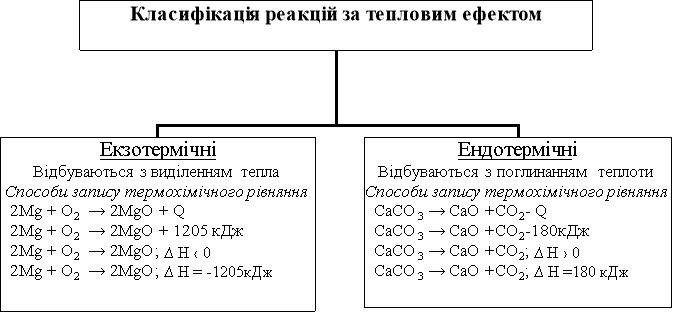
- Розглянемо малюнки 53, 54, 55 на с. 95-96 Хімія. 9 кл Буринська Н.М.
Мал. 53 с. 95 Хімія. 9 кл Буринська Н.М.
![]()
![]()
1
![]()
![]()

-∆Н
2
![]()
![]()
![]()
Мал. 54 с. 95 Хімія. 9 кл Буринська Н.М.
![]()
![]()
2
![]()
![]()

+∆Н
1
![]()
![]()
![]()
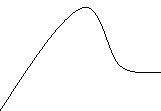
Мал. 55 с. 96 Хімія. 9 кл Буринська Н.М.

![]()
![]()
Енергія поглинається системою із зовнішнього середовища, Q ‹0. Отже, реакція ендотермічна

![]()
Енергія виділяється у зовнішнє середовище. Q ›0. Реакція екзотермічна
Закріплення набутих знань
(Колективна робота над виконанням тренувальних вправ)
- Які з наведених реакцій є екзотермічними, а які ендотермічними:
А. FeO + CO → Fe + CO2 + Q;
Б. СО + Н2О →СО2 + Н2 ; ∆Н ‹ О;
В. СаО + Н2О → Са(ОН)2 + Q;
Г. СН4 + Н2О → СО2 + 3Н2 ─Q;
Д. N2 + O2 →2NO; ∆Н›О.
- Записати рівняння горіння водню. Тепловий ефект реакції дорівнює 572кДж.
2Н2 + О2 → 2Н2О + 572кДж
2Н2 + О2 → 2Н2О; ∆Н= -572 кДж
- Що можна сказати про тип реакції перетворення речовини на іншу згідно зі схемою:
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
∆Н ∆Н
![]()
![]()
Перебіг реакції
- До якого типу належать реакції,що відбуваються в пробірках:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
теплота теплота теплота теплота
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
теплота теплота
Обчислення за термохімічними рівняннями
№1. Скільки тепла виділиться в результаті спалювання 18г вугілля?
С + О2 → СО2 +410 кДж
Розв’язок:
Дано: 18 г Х кДж
![]()
![]() m(С) = 18 г С + О2 → СО2 + 410 кДж
m(С) = 18 г С + О2 → СО2 + 410 кДж
12 г
Q - ?
18 Х 18∙ 410
![]()
![]()
![]() = ; Х = = 615 кДж
= ; Х = = 615 кДж
12 410 12
Відповідь: Q = 615 кДж
№2. У результаті взаємодії алюмінію масою 9 г з киснем виділилося 274,44 кДж теплоти. Скласти термохімічне рівняння.
Розв’язок:
![]() Дано: 9 г 274,44 кДж
Дано: 9 г 274,44 кДж
m(Аl) = 9 г 4Аl + 3О2 → 2Al2О3 +Х кДж
Q = 274,44 кДж 4∙27 г
![]()
∆Н - ?
9 274,44 4∙27 ∙ 274,44
![]()
![]()
![]() = ; Х = = 3293,28 кДж
= ; Х = = 3293,28 кДж
4∙27 Х 9
Відповідь: 4Аl + 3О2 → 2Al2О3 +3293,28 кДж
№3. Яка маса металу утвориться, якщо для розкладу меркурій оксиду витратилося 33,4 кДж теплоти? 2HgO →2Hg + O2 ─ 167кДж.
Розв’язок:
![]() Дано: Х г 33,4 кДж
Дано: Х г 33,4 кДж
Q = -33,4 кДж 2HgO →2Hg + O2 ─ 167кДж.
![]() 2∙ 201 г
2∙ 201 г
m(Hg) -? Х 33,4 2∙201 ∙ 33,4
![]()
![]()
![]() = ; Х = = 80,4г
= ; Х = = 80,4г
2∙201 167 167
Відповідь: m(Hg) = 80,4г
Домашнє завдання:
§ 15 Хімія 9 кл Н.М. Буринська
Впр. 3,4 с. 98
Урок №7
Тема: Швидкість хімічної реакції. Залежність чинників від різних факторів.
Мета: формувати уявлення учнів про швидкість хімічних реакцій, вплив на неї різних факторів; показати залежність швидкості від природи речовини, температури, концентрації. Ступеня подрібнення речовини, наявності каталізатора чи інгібітору; формувати навички розв’язання задач із використанням понять «швидкість реакції».
Обладнання: мультимедійна презентація уроку, відео досліди, роздаткові картки для лабораторного досліду.
Для лабораторного досліду: 1) гранули Mg, Zn, Cu однакового розміру, розведений розчин хлоридної кислоти (HCl), концентрований розчин хлоридної кислоти, шматок крейди, порошок крейди, відеодослід «Вплив каталізатора на швидкість реакції»
Тип уроку: урок вивчення нового матеріалу
Хід роботи
І. Актуалізація опорних знань.
1. Перевірка Д/з Впр. 3,4 с. 98
2. Гра «Вірю – не вірю»
Учні зачитують твердження і дають відповідь - вірне воно чи хибне.
- Екзотермічні реакції відбуваються із виділенням теплоти. (Так)
- Ендотермічні реакції відбуваються із поглинанням теплоти. (Так)
- Реакція горіння вугілля – це ендотермічна реакція. (Ні)
- Тепловий ефект реакції – це маса продукту реакції, що утворилася під час горіння речовини. (Ні
- Тепловий ефект реакції вимірюється в паскалях (Па), або кілопаскалях(кПа). (Ні)
- Тепловий ефект реакції позначається буквою Q або ∆Н. (Так)
- В ендотермічних реакціях внутрішня енергія речовин зростає. (Так)
- Тепловий ефект реакції – це кількість теплоти, що виділяється, або поглинається під час реакції.
- Тепловий ефект реакції вимірюється в Дж або кДж. (Так)
- Хімічні рівняння, в яких зазначаються ступені окиснення елементів, називаються термохімічними. (Ні)
- При екзотермічних реакціях температура реакційної системи підвищується. (Так)
12.Під час протікання ендотермічної реакції температура реакційної суміші підвищується. (Ні)
ІІ. Мотивація навчальної діяльності.
А зараз переходимо до вивчення нової теми. Почнемо з питання: чим відрізняється черепаха від гепарда? (швидкість руху).
Чим відрізняється повільне окиснення від вибуху? (швидкість реакції). Саме про швидкість хімічної реакції буде йти мова на сьогоднішньому уроці.
Мета уроку:
- з’ясуємо, що називається швидкістю реакції, як вона позначається і в яких одиницях вимірюється;
- розглянемо чинники, які впливають на швидкість хімічної реакції.
ІІІ. Вивчення нового матеріалу.
- Вивчаючи хімічні властивості різних сполук, ви напевне звернули увагу на те, що для перебігу різних реакцій потрібний різний час:
- Іржа на залізних виробах утворюється за кілька місяців;
- Горіння свічки триває кілька годин;
- Реакція між содою і оцтом відбувається в одну мить.
- Отже, реакції перебігають з різною швидкістю. Пригадайте, як на уроках фізики і математики, ви позначали швидкість руху? (U)
- Швидкість хімічних реакцій вивчає розділ хімії, що називається хімічною кінетикою.
- За якими критеріями можна судити про швидкість протікання хімічної реакції? За зміною кількості вихідних речовин і продуктів реакції.
Швидкість реакції – зміна концентрації речовини за одиницю часу.
С2 – С1 ∆C ∆υ
![]()
![]()
![]()
![]()
![]() U = + = + або U =
U = + = + або U =
τ 2 – τ 1 ∆ τ V ∆ τ
C - молярна концентрація, [моль/л]
τ1 і τ 2 - початковий і кінцевий час хімічної реакції, [c]
U – швидкість хімічної реакції, [моль/л∙с]
V - об’єм, [л]
υ – кількість речовини, [моль]
![]() Чому перед формулою ставлять +? Якщо швидкість обраховують за зміною концентрації вихідних речовин, то ставиться «-», бо ∆C набуває від’ємного значення, а якщо за зміною концентрації продуктів реакції, то ставиться +.
Чому перед формулою ставлять +? Якщо швидкість обраховують за зміною концентрації вихідних речовин, то ставиться «-», бо ∆C набуває від’ємного значення, а якщо за зміною концентрації продуктів реакції, то ставиться +.
![]() Задача с. 101 – 102 Хімія 9 кл Н.М. Буринська
Задача с. 101 – 102 Хімія 9 кл Н.М. Буринська
С1 = 0,04моль/л ∆C 0,01 – 0,04 0,03
![]()
![]()
![]() С2 = 0,01 моль/л U = - = - = = 0,0006 моль/ л·с
С2 = 0,01 моль/л U = - = - = = 0,0006 моль/ л·с
∆ τ = 50 с ∆ τ 50 50
![]()
U - ?
- В житті часто виникає потреба керувати швидкістю реакції . Наприклад,
- горіння палива прискорювати;
- пожежу – сповільнювати;
- іржавіння заліза сповільнювати.
Для цього потрібно знати від чого залежить швидкість реакції.
Лабораторний дослід №5
Залежність швидкості реакції від різних чинників.
Мета: дослідити вплив різних чинників на швидкість хімічної реакції.
Обладнання: гранули Mg, Zn, Cu , розведений розчин хлоридної кислоти (HCl), концентрований розчин хлоридної кислоти, шматок крейди, порошок крейди, спиртівка, сірники, тримач.
Можливі такі варіанти проведення лабораторного досліду:
- Практичне виконання (при наявності реактивів)
- Віртуальне виконання (перегляд відео дослідів)
А.Лавузьє –чудовий експериментатор і тонкий спостерігач,
заповів майбутнім експериментаторам :
- Намагайся робити добре, а не робити багато.
- Спрощуй досліди, наскільки це можливо.
- Ніколи не заповнюйте поспішними висновками мовчання фактів.
Хід роботи
Дослід 1. Вплив природи реагуючих речовин на швидкість хімічної реакції.
В три пробірки киньте гранулу міді, цинку, магнію. В кожну пробірку долийте розчин хлоридної кислоти. Зробіть висновок, як впливає природа реагуючих речовин на швидкість реакції. Результати спостереження запишіть в таблиці.
Дослід 2. Вплив площі поверхні стикання речовин на швидкість хімічної реакції.В одну пробірку киньте шматочок крейди, а в іншу пробірку насипте стільки ж порошку крейди. В кожну пробірку долийте розчин хлоридної кислоти. Зробіть висновок, як ступінь подрібнення речовин впливає на швидкість реакції. Результати спостереження запишіть в таблиці.
Дослід 3.Вплив концентрації речовин на швидкість хімічної реакції
В дві пробірки киньте однакові гранули цинку. В першу пробірку налийте розведений розчин хлоридної кислоти, а в другу – концентрований розчин хлоридної кислоти. Зробіть висновки, як концентрація речовин впливає на швидкість реакції. Результати спостереження запишіть в таблиці.
Дослід 4. Вплив температури на швидкість реакції
В дві пробірки киньте однакові гранули цинку. В кожну пробірку долийте розчин хлоридної кислоти. Одну з пробірок підігрійте в полум’ї спиртівки. Зробіть висновок, як температура впливає на швидкість реакції. Результати спостереження запишіть в таблиці.
|
Фактори, які впливають на швидкість реакції |
Хімічний експеримент, спостереження |
Висновок |
|
Природа реагуючих речовин |
Zn + 2HCl → ZnCl2 + H2 – відбувається повільно Mg + 2HCl → MgCl2 + H2 – відбувається швидко
|
Чим активніша речовина, яка вступає в реакцію, тим швидше відбувається реакція |
|
Ступінь подрібнення речовини |
СаСО3 шматок + 2HСl → CaCl2 + CO2 + H2O реакція відбувається повільно
СаСО3 порошок + 2HСl → CaCl2 + CO2 + H2O реакція відбувається швидко |
Чим більша поверхня стикання реагентів, тим більша швидкість реакції |
|
Концентрація реагуючих речовин. |
Zn + 2HClрозвед. → ZnCl2 + H2 – відбувається повільно
Zn + 2HCl концентр. → ZnCl2 + H2 – відбувається швидко
|
Чим більша концентрація реагуючих речовин, тим швидше відбувається реакція. |
|
Температура |
Zn + 2HCl . → ZnCl2 + H2 – відбувається повільно t Zn + 2HCl. → ZnCl2 + H2 – відбувається швидко
|
При нагріванні швидкість реакції зростає. |
|
Наявність каталізатора або інгібітора |
Відео досліди: MnO2 2Н2О2 → 2Н2О + О2
H2O 2Al + 3I2 → 2AlI3 |
Каталізатори – прискорюють швидкість реакції Інгібітори - сповільнюють швидкість реакції
|
ІV. Узагальнення і систематизація знань.
Використай свої знання про швидкість реакції в побуті:
- Чому продукти харчування зберігають в холодильнику?
- Під час консервації продуктів використовують речовини – консерванти. Яку іншу назву можна дати цим речовинам?
- Встановіть відповідність:
|
А.Зі зростанням температури швидкість реакції збільшується. |
|
2.Аби пришвидшити випалювання залізної руди, її подрібнюють і розпорошують. |
Б.Зі зменшенням концентрації реагентів швидкість реакції зменшується. |
|
3.Улітку зростає небезпека харчових отруєнь. |
В.Зі зростанням площі поверхні контакту реагентів швидкість реакції зростає. |
|
4.Термін служби мідних водопровідних труб значно більший порівняно зі сталевими. |
Г.Каталізатори пришвидшують хімічні реакції. |
|
|
Д.Швидкість реакції залежить від природи реагентів. |
Домашнє завдання:
§ 16, 17 Хімія 9 кл Н.М. Буринська
Впр. 1- 4 с. 106 (усно)
Впр. 2,4 с. 111 (усно)
Творче завдання:
Підготувати повідомлення за темами:
- Значення каталізаторів у техніці.
- Ферменти.
- Інгібітори.
Урок №8
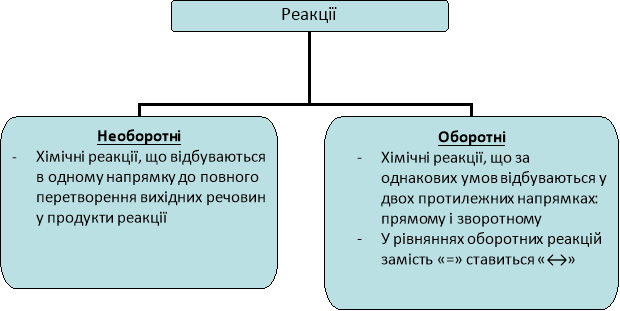
Тема: Оборотні і необоротні реакції. Хімічна рівновага.
Мета: познайомити учнів з класифікацією хімічних реакцій на оборотні та необоротні; з’ясувати при яких умовах реакції є необоротними; розглянути поняття «хімічна рівновага», показати необхідність зсуву хімічної рівноваги, визначити фактори, які впливають на зміщення хімічної рівноваги; розвивати вміння записувати рівняння реакцій, розв’язувати тестові завдання.
Обладнання: мультимедійна презентація уроку, відео досліди, періодична система хімічних елементів, таблиця розчинності, ряд активності металів, картки із тестовими завданнями.
Хід уроку
І. Актуалізація опорних знань.
1. Перевірка домашнього завдання:
- Впр. 1- 4 с. 106 (усно),
- Впр. 2,4 с. 111 (усно)
2. Експрес-контроль.
Самостійна робота на картках.
- Швидкість хімічної реакції позначається:
А.W ; Б.V; В.m; Г.t.
2.Швидкість хімічної реакції вимірюється в таких одиницях:
А. моль/л ; Б. г/моль; В. моль/л·с; Г. л/моль.
3. За якою формулою обчислюється швидкість хімічної реакції:
∆С m V n
-



 V = ± ; Б. M = ; B. Vm = ; Г. α= .
V = ± ; Б. M = ; B. Vm = ; Г. α= .
∆t υ υ N
4.Швидкість хімічної реакції при підвищенні концентрації вихідних речовин:
А. збільшується; Б. зменшується;
В. не змінюється; Г. змінюється періодично.
5. Швидкість хімічної реакції при підвищенні температури:
А. збільшується; Б. зменшується;
В. не змінюється; Г. змінюється періодично.
6. Із збільшенням поверхні стикання реагуючих речовин швидкість реакції:
А. збільшується; Б. зменшується;
В. не змінюється; Г. змінюється періодично
7. Каталізатори, це речовини, що:
А. сповільнюють хімічну реакцію; Б. прискорюють хімічну реакцію;
В. не впливають на швидкість хімічної реакції.
8.Інгібітори, це речовини, що:
А. сповільнюють хімічну реакцію; Б. прискорюють хімічну реакцію;
В. не впливають на швидкість хімічної реакції.
9. Зазвичай каталізатори указують:
А. у реагентах; Б.у продуктах реакції; В. над знаком рівності.
10.Чому продукти харчування зберігають у холодильниках:
А. Зі зменшенням концентрації реагентів швидкість реакції спадає;
Б .Інгібітори сповільнюють хімічні реакції;
В. Зі спаданням температури швидкість реакції спадає.
ІІ. Мотивація навчальної діяльності.
За яким ознаками класифікують хімічні реакції?
Які з класифікацій ми вивчили?
Мета уроку:
познайомимося з класифікацією хімічних реакцій за ознакою оборотності, або напрямком протікання реакції;
з’ясувати, при яких умовах реакції є необоротними;
познайомитись з поняттям «хімічна рівновага»;
розглянути принцип Ле Шательє та фактори, які впливають на зміщення хімічної рівноваги.
ІІІ. Вивчення нового матеріалу.
Проблемне питання:
Чи завжди хімічні реакції відбуваються в одному напрямку: реагенти → продукти реакції?
Самостійна робота з підручником.
Прочитайте с. 116 Хімія 9 кл Н.М. Буринська. З’ясуйте при яких випадках хімічні реакції є необоротними. Наведіть приклади таких реакцій.
Хімічні реакції є необоротними в наступних випадках:
- Один із продуктів, що утворюється, виходить зі сфери реакції – випадає у осад або виділяється у вигляді газу.
ВаСl2 + H2SO4 → BaSO4↓ + 2HCl
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
- Утворюється малодисоційована сполука.
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- Реакція супроводжується виділенням великої кількості енергії.
С + О2 → СО2 + Q
Хімічна рівновага
Розповідь учителя з елементами бесіди.
- Розглянемо швидкість протікання прямої та зворотної реакції.
- Спочатку швидкість прямої реакції максимальна. Чому? (бо на початку реакції концентрація вихідних речовин найбільша)
- З часом швидкість прямої реакції сповільнюється. Чому? (зменшується концентрація вихідних речовин)
- Швидкість зворотної реакції спочатку мінімальна. Чому? (концентрація продуктів реакції мала)
- З часом швидкість зворотної реакції зростає. Чому? (збільшується концентрація продуктів реакції)
- Настає такий час, коли швидкість прямої реакції дорівнює швидкості зворотної реакції. Говорять: настає хімічна рівновага. С. 113 Хімія 9 кл Н.М. Буринська
Стан хімічної рівноваги: скільки частинок вихідних речовин вступає в пряму реакцію, стільки саме їх утворюється в результаті зворотної реакції, тобто концентрації речовин залишаються незмінними.
- Після досягнення стану хімічної рівноваги реакції не припиняються, вони продовжуються, але ніяких змін у реакційній системі непомітно. Тому рівновагу називають динамічною.
Зміщення хімічної рівноваги.
Багато реакцій, що застосовуються в промисловості є оборотними. Тому виникає потреба керувати оборотними реакціями. Як змусити реакцію відбуватися в тому напрямку, щоб утворювалися в максимальній кількості ті речовини, які необхідні виробництву?
Стан хімічної рівноваги може зберігатися за незмінних умов як завгодно довго, але при зміні умов рівновага зміщується.
У 1884 р. француз Ле Шательє виявив закономірності впливу зовнішніх умов на рівновагу оборотних реакцій. Він сформулював загальний принцип зміщення хімічної рівноваги, який названий на його честь принципом Ле Шательє. С. 113 Хімія 9 кл Н.М. Буринська
Принцип Ле Шательє:
Якщо на систему в стані хімічної рівноваги чинити якусь дію (змінити тиск, температуру, концентрацію речовин), то рівновага зміщується в бік той реакції, яка послаблює цю дію.
Чинники, які впливають на стан хімічної рівноваги.
- Вплив зміни концентрації
При підвищенні концентрації вихідних речовин рівновага зміщується в бік продуктів реакції, а при зниженні концентрації вихідних речовин – у бік вихідних речовин.
N2 + 3H2 ↔ 2NH3
С(N2) ↑→ (при підвищенні концентрації азоту рівновага зміщується впрово)
С(Н2) ↑→
С (NH3) ↑←
С(N2) ↓← (при знижені концентрації азоту рівновага зміщується вліво)
С(Н2) ↓←
С (NH3) ↓→
- Вплив зміни температури
При підвищенні температури рівновага зміщується в бік ендотермічної реакції, а при зниженні температури – в бік екзотермічної реакції.
N2 + 3H2 ↔ 2NH3+Q
t ↑←
t ↓→
У реакціях, які протікають без теплового ефекту, зміна температури не призводить до зміщення рівноваги.
- Вплив зміни тиску
При підвищенні тиску рівновага зміщується в бік тих речовин, що займають менший об’єм (враховується об’єм лише газів). При зниженні тиску рівновага зміщується в бік речовин, що займають більший об’єм.
N2(г) + 3H2(г) ↔ 2NH3(г)
![]()
![]()
4 2
Р ↑→
Р ↓←
Якщо об’єми газоподібних речовин в оборотній реакції не змінюються, то зміна тиску не впливає на стан хімічної рівноваги.
- Каталізатор не зміщує хімічну рівновагу, тому що однаково прискорює і пряму, і зворотну реакцію. За наявності каталізатора швидше встановлюється стан хімічної рівноваги.
ІV. Узагальнення й систематизація знань.
- «Загадковий дует»
(Один учень виходить до дошки, Йому на спину прикріплюють листок паперу із записаним на ньому терміном. Інший учень пояснює те, що написано, не називаючи сам термін. Якщо перший учень відгадав, про що йшла мова, він сідає за парту, на його місце виходить інший учень, якому прикріплюють інший термін. )
Терміни: 1) Оборотна реакція.
2) Необоротна реакція.
3) Хімічна рівновага.
4) Каталізатор
2. Тестові завдання
- У системі А + В ↔ С; ∆Н < 0, де А, В, С – гази, встановилася рівновага. Як зміниться стан хімічної рівноваги, якщо:
а) підвищити тиск?
б) збільшити кількість речовини А в системі?
в) підвищити температуру?
2) Збільшення тиску в системі спричинить підвищення виходу продукту в реакції:
а) 2Н2О(г) ↔ 2Н2(г) + О2(г)
б) N2 (г)+ 3Н2(г) ↔ 2NН3(г)
в) СаСО3 (тв) ↔ СО2 (г) + СаО(тв)
г) СО(г)+ H2О(г) ↔ СО2(г) + H2(г)
3. «Мозковий штурм»
Реакція відбувається за рівнянням:
2SO2(г) + О2 (г) ↔ 2SO3 (г) + 284,2 кДж
Запропонуйте, зміною яких параметрів можна досягнути зміщення рівноваги в бік утворення сульфур (VІ) оксиду.
Відповідь:
- Збільшити концентрацію SO2, О2.
- Зменшити концентрацію SO3
- Підвищити тиск.
- Знизити температуру.
4. Розв’язок проблемного питання.
Художник зобразив модель динамічної рівноваги малюнком. Поясніть, якою має бути швидкість руху риби (1) порівняно із швидкістю течії (2), щоб модель правильно відбивала зміст поняття.
![]()
![]()
![]()
![]()
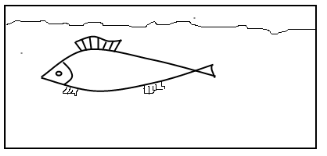
Відповідь: швидкість руху риби повинна дорівнювати швидкості руху течії.
Домашнє завдання:
§ 13 - 18 Хімія 9 кл Н.М. Буринська
Впр. 3 - 5 с.117
Урок № 9
Тема: Узагальнення й систематизація знань з теми «Хімічні реакції»
Мета: узагальнити і систематизувати знання учнів про класифікації хімічних реакцій, кінетику і термодинаміку хімічних реакцій; вдосконалювати вміння писати рівняння хімічних реакцій, вказувати тип реакції за різними ознаками; вдосконалювати вміння розв’язувати тестові завдання, задачі.
Обладнання: мультимедійна презентація уроку, періодична система хімічних елементів, таблиця розчинності, ряд активності металів, картки із завданнями.
Тип уроку: урок узагальнення й систематизації знань.
Хід уроку
І. Мотивацій навчальної діяльності.
А.Ф. Лосєв якось сказав: «Будь-який труд є осмисленим, результативним та вільним тільки тоді, коли він усвідомлюється як моя особиста … необхідність». Як ви розумієте ці слова? Як ви думаєте, яка мета нашого уроку?
Мета уроку: повторити і узагальнити матеріал з теми «Хімічні реакції», підготуватися до контрольної роботи.
ІІ. Узагальнення й систематизація знань.
Фронтальна бесіда, робота учнів на мультимедійній дошці, самостійна робота в зошиті.
- За якими ознаками класифікуються хімічні реакції? Заповніть схему на мультимедійній дошці.
- Які типи реакцій існують за зміною числа реагентів і продуктів реакції, та їх складом? Дайте визначення кожному типу реакцій.
- Установіть відповідність між рівнянням реакції та ії типом:
А. 2Са + О2 = 2СаО ; 1. обміну;
Б. Fe + 2HСl = FeCl2 + H2; 2. сполучення;
В. HNO3 + NaOH = NaNO3 + H2O; 3. розкладу;
Г. 2HgO = 2Hg + O2; 4. заміщення.
4. Як поділяються реакції за зміною ступеня окиснення?
5.Дано схеми двох рівнянь, допишіть рівняння реакцій, вкажіть, яка з них є окисно – відновною, урівняйте рівняння за допомогою електронного балансу, вкажіть окисник і відновник, процеси окиснення та відновлення:
( самостійна робота з наступним обговоренням)
1) КОН + HNO3 → ; 2) HCl + Al → .
6. Як класифікуються реакції за тепловим ефектом?
7. В яких одиницях вимірюється тепловий ефект?
8. Вкажіть, які реакції із даних є екзотермічними:
1) S + O2 =SO2 +293 кДж;
2) Fe2O3 + 3H2 = 2Fe + 3H2O ─ 89,6 кДж;
3) 2Н2 + О2 = 2Н2О; ∆Н = ─ 286 кДж;
4) С + Н2О = СО + Н2; ; ∆Н = +131,4 кДж.
9. Як поділяються реакції за напрямком протікання (оборотністю) ?
10. Які з даних реакцій є оборотними:
![]()
![]() 1) N2 + 3H2 2NH3 ;
1) N2 + 3H2 2NH3 ;
2) CaCl2 + Na2CO3 = CaCO3 ↓+ 2NaCl;
3) С + О2 = СО2 + Q;
![]()
![]() 4)N2 + O2 2NO.
4)N2 + O2 2NO.
11. Чи з однаковою швидкістю відбуваються хімічні реакції?
12.Від яких чинників залежить швидкість хімічних реакцій?
13. Аналізуючи причини різної швидкості хімічних реакцій, учень дійшов таких висновків:
а) швидкість хімічної реакції зростає з підвищенням температури;
б) швидкість хімічних реакцій прямо пропорційна концентрації реагуючих речовин;
в) з часом швидкість реакції зростає;
г) швидкість реакції можна змінити застосовуючи каталізатор.
В якому пункті учень помилився?
14. Якщо сірку, яка горить в повітрі, внести в посудину з киснем, то швидкість реакції горіння збільшиться внаслідок:
а) збільшення концентрації реагенту;
б) підвищення температури в реакційній суміші;
в) каталітичної дії кисню.
15. « Мозковий штурм» На шматок заліза діємо розчином хлоридної кислоти. Запропонуйте заходи, якими можна прискорити протікання реакції.
![]()

![]()
![]()
16. Порівняйте дію каталізатора і інгібітора на швидкість реакції.
17. Наведені хімічні реакції класифікуйте за всіма вам відомими класифікаційними ознаками:
1) 4NO2 + O2 + 2H2O = 4HNO3 + Q;
![]() 2) С2Н4 + Н2 Nі С2Н6 +Q;
2) С2Н4 + Н2 Nі С2Н6 +Q;
![]() 3) 2Al + Fe2O3 = Al2O3 + 2Fe + Q;
3) 2Al + Fe2O3 = Al2O3 + 2Fe + Q;
![]()
![]() 4) СаСО3 СаО + СО2 ─ Q.
4) СаСО3 СаО + СО2 ─ Q.
18. Напишіть рівняння і назвіть тип реакцій, за допомогою яких можна здійснити перетворення:
Al → Al2O3 → AlCl3 → Al(OH)3 → Al2(SO4)3
Для окисно - відновних реакцій складіть електронний баланс,а для реакцій йонного обміну запишіть рівняння в йонному вигляді.
19. При взаємодії 9, 18 л (н.у.) хлору з надлишком водню виділилось 75 кДж теплоти. Напишіть термохімічне рівняння реакції.
ІІІ. Підсумки уроку.
ІV. Домашнє завдання
§ 13-18
Підготуватися до контрольної роботи
Урок № 10
Тема: Контрольна робота з теми «Хімічні реакції»
Мета: перевірити рівень навчальних досягнень учнів з теми, розуміння основних понять, уміння використовувати їх на практиці.
Обладнання: картки із завданнями.
Хід уроку
Варіант 1
Завдання 1 – 8 мають по чотири варіанти відповідей. У кожному завданні лише одна відповідь правильна. Оберіть правильну, на вашу думку, відповідь та позначте її у бланку відповідей.
- Схема А + В = АВ виражає сутність реакції: А. сполучення; Б. розкладу; В. заміщення; Г. обміну. (0,5 бал.)
- Речовини, які під час реакції віддають електрони, називаються :
А. окисниками; Б. відновниками; В. каталізаторами; Г. інгібіторами.
(0,5 бал.)
3. Запис А + В = АВ; ∆Н‹0 означає, що реакція :
А. каталітична; Б. окисно – відновна; В. ендотермічна; Г. екзотермічна. (0,5 бал.)
4. Каталізатор впливає на:
А. зміщення рівноваги; Б. швидкість реакції;
В. підвищення тиску; Г. зниження температури.(0,5 бал.)
5. Зі зростанням концентрації реагентів швидкість хімічних реакцій:
А. збільшується; Б. зменшується;
В. не змінюється; Г. змінюється періодично.(0,5 бал.)
6. Одиниця вимірювання теплового ефекту реакції є:
А. кПа; Б. кДж; В. моль; Г. моль/л. (0,5 бал.)
7.Як називається наступний процес і скільки електронів в ньому беруть участь:
S+6→ S─2
А. окиснення, 4 е─; Б. відновлення,8 е─;
В. окиснення,8 е─; Г. відновлення,4 е─ .( 1 бал.)
8. Реакція сполучення :
А. завжди є окисно –відновним процесом;
Б. ніколи не супроводжуються зміною ступенів окиснення;
В. може бути окисно –відновним процесом, а може не супроводжуватися зміною ступенів окиснення;
Г. практично ніколи не супроводжується зміною ступенів окиснення.(1 бал.)
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
А |
|
|
|
|
|
|
|
|
|
Б |
|
|
|
|
|
|
|
|
|
В |
|
|
|
|
|
|
|
|
|
Г |
|
|
|
|
|
|
|
|
Завдання 9-10 мають на меті встановлення відповідностей. До кожного рядка, позначеного буквою, доберіть відповідник. позначений цифрою, впишіть її в таблицю.
|
А |
|
|
Б |
|
|
В |
|
|
Г |
|
9.Установіть відповідність між рівнянням реакції і її типом:
А. Fe2O3 + 3H2 =2Fe + 3 H2O ; 1.розкладу;
Б. FeSO4 + 2KOH = K2SO4 + Fe(OH)2 ; 2.сполучення;
В. 2Fe(OH)3 = Fe2O3 + 3H2O ; 3.заміщення;
Г. 2Mg + O2 = 2MgO; 4.обміну.
(1бал.)
10. .Установіть відповідність між рівнянням реакції і її типом:
|
А |
|
|
Б |
|
|
В |
|
|
Г |
|
А.2КNO3 = 2KNO2 +3O2; ∆Н = +255кДж. 1.екзотермічна;
Б. 2Mg + CO2 = 2MgO +C; ∆Н= ─829 кДж. 2.ендотермічна;
![]()
![]() В. N2 +O 2 2NO; 3.каталітична;
В. N2 +O 2 2NO; 3.каталітична;
![]() Г. 2KClO3 MnO2 2 KCl + 3O2; 4.оборотна.
Г. 2KClO3 MnO2 2 KCl + 3O2; 4.оборотна.
(1бал.)
11. Методом електронного балансу розставте коефіцієнти в рівнянні окисно- відновної реакції. Вкажіть окисник і відновник, процеси окиснення та відновлення. Вкажіть загальну суму коефіцієнтів у рівнянні реакції :
NH3 +O2 → N2 + H2O.
(3бал.)
12.Обчисліть. яка кількість тепла виділиться внаслідок спалювання 100 літрів метану,, якщо термохімічне рівняння горіння метану:
СН4 +2О2 → СО2 + 2Н2О +891 кДж
(2 бал.)
Варіант 2
Завдання 1 – 8 мають по чотири варіанти відповідей. У кожному завданні лише одна відповідь правильна. Оберіть правильну, на вашу думку, відповідь та позначте її у бланку відповідей.
- Схема А + В С = АС + В виражає сутність реакції: А. сполучення; Б. розкладу;
В. заміщення; Г. обміну. (0,5 бал.)
- Речовини, які під час реакції приєднують електрони, називаються :
А. окисниками; Б. відновниками;
В. каталізаторами; Г. інгібіторами. (0,5 бал.)
3. Запис А + В = АВ; ∆Н›0 означає, що реакція :
А. каталітична; Б. окисно – відновна;
В. ендотермічна; Г. екзотермічна. (0,5 бал.)
4. Інгібітор впливає на:
А. зміщення рівноваги; Б. швидкість реакції;
В. підвищення тиску; Г. зниження температури.(0,5 бал.)
5. Зі зростанням температури швидкість хімічних реакцій:
А. збільшується; Б. зменшується;
В. не змінюється; Г. змінюється періодично.(0,5 бал.)
6. Одиниця вимірювання теплового ефекту реакції є:
А. кг ; Б. кДж; В. г/моль; Г. моль/л. (0,5 бал.)
7.Як називається наступний процес і скільки електронів в ньому беруть участь: Cl2→ 2Cl─1
А. окиснення, 1 е─; Б. відновлення,1 е─;
В. окиснення,2 е─; Г. відновлення,2 е─ .( 1 бал.)
8. Реакція розкладу:
А. завжди є окисно –відновним процесом;
Б. ніколи не супроводжуються зміною ступенів окиснення;
В. може бути окисно –відновним процесом, а може не супроводжуватися зміною ступенів окиснення;
Г. практично ніколи не супроводжується зміною ступенів окиснення.
(1 бал.)
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
А |
|
|
|
|
|
|
|
|
|
Б |
|
|
|
|
|
|
|
|
|
В |
|
|
|
|
|
|
|
|
|
Г |
|
|
|
|
|
|
|
|
Завдання 9-10 мають на меті встановлення відповідностей. До кожного рядка, позначеного буквою, доберіть відповідник. позначений цифрою, впишіть її в таблицю.
|
А |
|
|
Б |
|
|
В |
|
|
Г |
|
9.Установіть відповідність між рівнянням реакції і її типом:
А. CuSO4+ 2NaOH =Na2SO4 + Cu(OH)2 ; 1.розкладу;
Б. Fe + CuCl2 = Cu + FeCl2 ; 2.сполучення;
В. ВaCO 3 =ВaO + CO2; 3.заміщення;
Г . Fe + S = FeS . 4.обміну.
(1бал.)
10. .Установіть відповідність між рівнянням реакції і її типом:
А. MnO2 +2C =Mn + 2CO2 ; ∆Н = +293 кДж. 1.екзотермічна;
|
А |
|
|
Б |
|
|
В |
|
|
Г |
|
Б. 2NaOH + H2SO4 = Na2SO4 + 2H2O; ∆Н= ─290 кДж. 2.ендотермічна;
![]()
![]() В. H2 + І2 2НІ 3.каталітична;
В. H2 + І2 2НІ 3.каталітична;
![]() Г. 2Н2О2 MnO2 2H2O + O2; 4.оборотна.
Г. 2Н2О2 MnO2 2H2O + O2; 4.оборотна.
(1бал.)
11.Методом електронного балансу розставте коефіцієнти в рівнянні окисно – відновної реакції. Вкажіть окисник і відновник, процеси окиснення та відновлення. Вкажіть загальну суму коефіцієнтів у рівнянні реакції
Fe2O3 + C → CO2 + Fe
(3бал.)
12.Обчисліть. яку кількість тепла потрібно витратити на розклад вапняку, щоб одержати 2800 г
кальцій оксиду,термохімічне рівняння реакції розкладу:
СаСО3 = СаО + СО2 ─176 кДж
(2 бал.)


про публікацію авторської розробки
Додати розробку
