Розробки уроків, тема"Кисень"
Деленко Олег Леонович, вчитель хімії вищої категорії, вчитель-методист
Сокальської санаторної школи-інтернату І-ІІІ ступенів
ім. Т.Г. Шевченка
вчитель вищої категорії, вчитель-методист Савчинської ЗШ
І-ІІІ ступенів С.П. Деленко, Львівська обл.
Урок 1.
Тема: Оксиген. Кисень, склад його молекули, фізичні властивості.
Мета уроку: навчити розпізнавати Оксиген як хімічний елемент та кисень як просту речовину, звернути увагу на склад молекули кисню, проаналізувати його фізичні властивості, сприяти зацікавленості учнів навчанням; розвивати соціальну та комунікативну компетентності учнів.
Очікуваний результат:
Учень:
- знає основні поняття теми;
- розпізнає Оксиген як хімічний елемент та кисень як просту речовину;
- пояснює склад молекули кисню;
- аналізує фізичні властивості кисню.
Обладнання і реактиви: підручник, кулестержневі моделі кисню, озону, таблиці та схеми.
Форма проведення: урок з використанням методів критичного мислення: робота з опорними схемами, підручником, кола Вена, методичні вправи «Розірвана шпаргалка» та «Коректор».
І. Організаційний момент.
ІІ. Фаза структурованого огляду.
- Фронтальна бесіда:
- Чим ми дихаємо?
- Звідки береться кисень у повітрі?
- Якщо всі живі організми ним дихають, то чому він не витрачається?
- Що ви знаєте про кисень з власного досвіду?
ІІІ. Мотивація навчальної діяльності.
Вчитель. Надзвичайно важливий газ в атмосфері – кисень, який бере участь у процесах дихання, горіння, гниття. Зменшення його вмісту у повітрі до 14% є критичним, а до 8% - не сумісне з життям. Зменшення вмісту кисню в атмосфері внаслідок дихання компенсоване надходженням завдяки фотосинтезу. Фотосинтез і дихання – головні процеси, які забезпечують кругообіг кисню у природі, і разом з інтенсивним перемішуванням повітряних мас біля поверхні землі забезпечують його практично сталий вміст незалежно від району Землі. Значне збільшення вмісту кисню у повітрі – понад 28% призводить до розвитку патологічних процесів в організмі, зокрема до зменшення ємності легенів і пневмонії. І сьогодні Оксиген та кисень будуть темою нашого уроку.
ІV. Фаза побудови знань.
Вчитель. Почнемо вивчення відомостей про Оксиген та Кисень із складання загальної характеристики Оксигену. Отже, працюємо з підручником. За параграфом складаємо загальну характеристику Оксигену у зошиті.
 Характеристика Оксигену згідно положення у періодичній системі
Характеристика Оксигену згідно положення у періодичній системі
1. Порядковий номер?
2. Група, головна чи побічна?
3. Період, малий чи великий?
4. Ряд, парний чи не парний?
5. Відносні атомна та молекулярна маси?
6. Валентність Оксигену?
7. Хімічний символ та хімічна формула?
Вчитель. Оксиген утворює кілька простих речовин: найпоширенішою та найвідомішою речовиною є кисень. До складу однієї молекули кисню входять 2 атоми Оксигену. Ще Оксиген утворює одну речовину, про яку ми також чули, це – озон. До складу однієї молекули озону входять 3 атоми Оксигену. Де ці сполуки знаходяться у природі? Чи є вони у вільному стані? Розглянемо схему.
Знаходження в природі кисню





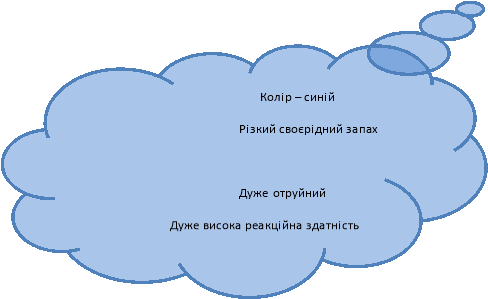
Вчитель. Озон в природі також є у вільному стані, він розташований у верхніх шарах атмосфери і захищає все живе на нашій планеті від шкідливого впливу ультрафіолетових променів сонця.
Бесіда:
- Як ви думаєте, чи мають прості речовини кисень та озон спільні ознаки?
- Чим вони відрізняються? Для того, щоб побачити спільні та відмінні ознаки кисню та озону ми зараз складемо кола Вена за матеріалом підручника.
Алотропні видозміни Оксигену. (Кола Вена)
 О2 – кисень О3 – озон
О2 – кисень О3 – озон
Вчитель. Колись кисень називали «горючим повітрям» через те, що він підтримує горіння. У 1771 році кисень відкрив шведський учений К.В.Шеєле, який на той час був учнем аптекаря і дуже полюбляв у вільний час проводити різні хімічні досліди. У 1774 році Дж. Прістлі також добув кисень розкладом меркурій(ІІ) оксиду. Пізніше у 1775 році французький вчений А.Лавуазьє довів, що кисень є складовою частиною повітря, а Оксиген входить до складу багатьох речовин. (Роки або прізвища вчених учні можуть вставляти у текст самі, опрацювавши текст підручника).
Фізичні властивості кисню
![]() Безбарвний газ
Безбарвний газ
![]()
![]() Не має запаху без смаку
Не має запаху без смаку

![]()
![]() малорозчинний у воді важчий за повітря
малорозчинний у воді важчий за повітря
![]()
 2
2
![]() Стає рідкий при – 183 0С
Стає рідкий при – 183 0С
при -218,8 0С – твердий стан
Світло – голубий
Вчитель. При сильному охолодженні конденсується у світло – голубу рідину. Поява забарвлення обумовлена кооперативним ефектом парів молекул при поглинанні світла (такий ефект можливий тільки в рідкому стані, коли молекули знаходяться достатньо близько одна від одної). Кисень має також магнітні властивості, найбільш наочно це можна продемонструвати, притягнувши магнітом рідкий кисень.
V. Фаза консолідації.
1. Гра «Коректор». Знайдіть і виправте помилки у реченнях:
1. Кисень знаходиться у природі в рідкому стані. 2. Має голубий відтінок. Не має запаху і смаку. 3. Добре розчиняється у воді. 4. Трохи легший за повітря. Молекулярна маса кисню рівна 16.
(Помилки написані курсивом).
2. Вправа «Розірвана шпаргалка». Знайдіть частини шпаргалки.
1. Хімічний символ Оксигену. а) О2
2. Порядковий номер Оксигену. б) ІІ
3. Відносна атомна маса Оксигену. в) 32
4. Відносна молекулярна маса кисню. г) О
5. Валентність Оксигену у сполуках. д) 8
6. Хімічна формула кисню. е) 16
Відповіді: 1 – г, 2 – д, 3 – е, 4 – в, 5 – б, 6 – а.
VІ. Домашнє завдання. § 12 (Підручник Н.М.Буринська, Л.П.Величко), робочий зошит (М.М.Савчин) ст. 72 – 74.
Урок 2.
Тема. Добування кисню в лабораторії. Реакція розкладу. Поняття про каталізатор.
Мета: вивчити та вміти практично використовувати лабораторні способи добування та збирання кисню, виконати та сформулювати визначення реакції розкладу, дати поняття про каталізатори та їхній вплив на перебіг реакцій.
Очікуваний результат:
Учень:
- називає речовини, з яких добувають кисень,
- дає визначення реакції розкладу і поняття каталізатора,
- пояснює суть реакції розкладу,
- спостерігає реакції розкладу калій перманганату і гідроген пероксиду,
- аналізує умови проходження реакцій розкладу,
- обґрунтовує використання каталізатора,
- робить висновки про властивості кисню та роль каталізатора.
Тип уроку: засвоєння нових вмінь, знань та навичок.
Форми роботи: демонстрації, робота з М-схемою, та опорним конспектом, методична вправа «Мікрофон», методична гра «Впізнай мене», самостійна робота в групах.
Обладнання і реактиви: спиртівка, штатив з пробірками, газовідвідна трубка, дерев’яна скіпка, калій перманганат, гідроген пероксид, манган (ІV) оксид або кусочок сирої картоплі, посуд для збирання кисню, сірники, таблиці «Добування кисню в лабораторії», «Реакція розкладу».
І. Організаційний момент.
ІІ. Фаза структурованого огляду.
А) робота з М-схемою «Загальна характеристика і фізичні властивості Оксигену»: з’єднайте пари.

Порядковий номер О2 при -1830С
ІІ Відносна атомна маса 8
Твердне 16 Хімічна формула 32
Валентність Оксигену Зріджується
При -218,80С Відносна молекулярна маса
Б) вправа «Мікрофон»: Назвіть по черзі фізичні властивості кисню, які ми не використали в М-схемі.
Очікувані відповіді учнів:
- безбарвний газ,
- не має запаху та смаку,
- малорозчинний у воді,
- важчий за повітря,
- найпоширеніший у природі,
- підтримує горіння,
- необхідний для дихання.
(запитання можна ставити різні, залежно від рівня підготовки учнів)
ІІІ. Мотивація навчальної діяльності. В атмосфері молодої Землі кисню не було. В невеликих кількостях він утворювався тоді, коли молекули води, що виділялися з гірських порід, розпадалися під впливом сонячної радіації, а утворені при цьому атоми Оксигену сполучалися в молекули кисню. Основна ж маса кисню нашої атмосфери виникла тільки після появи перших фотосинтезуючих клітин, відомих під назвою «синьо-зелені водорості або ціанобактерії». Це природні способи добування кисню. Кисень широко застосовується в техніці. Процеси окиснення інтенсивніше протікають в кисні, ніж на повітрі. Кисень використовується для окиснювальних процесів у металургійній та хімічній промисловостях (виплавка чавуну та сталі, різання і зварювання металів тощо). Суміші рідкого кисню з горючими домішками (вуглець, сірка, дерев’яні ошурки) використовуються як вибухівка. Чистий кисень використовується у медицині, при роботі під водою та великих висотах. Ось ще одна причина, чому ми повинні вивчати лабораторні способи добування цього важливого газу.
Метою сьогоднішнього уроку є навчитися добувати та збирати кисень, перевіряти його наявність, а також звернути увагу на тип цих реакцій.
ІV. Фаза побудови знань.
- Знайомство з приладами для добування кисню та огляд речовин, з яких його можна добути.
Кисень добувають з оксигеновмісних речовин за нагрівання або пропускання постійного електричного струму реакцією розкладу.
- Практична частина нового матеріалу.
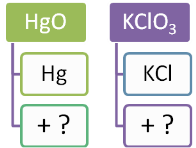
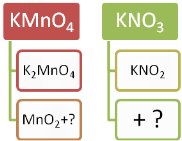
Дослід №1. Добування кисню з калій перманганату. Насипаємо у пробірку калій перманганату, закриваємо пробірку корком з газовідвідною трубкою. Біля отвору ставимо пухкий жмутик вати, щоб запобігти викиданню кристалів перманганату у газовідвідну трубку. Цю трубку опускаємо в чисту пробірку. Прогріваємо пробірку з калій перманганатом спочатку всю, а потім у тому місці, де є речовина. Відбувається реакція:
2KMnO4 = K2MnO4 + MnO2 + O2↑
Для перевірки утворення кисню запалюємо дерев’яну скіпку, гасимо її, щоб тліла і опускаємо у посудину з киснем. Скіпка спалахує, бо кисень підтримує горіння.
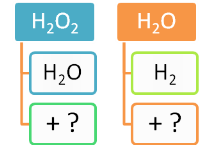
Дослід №2. Добування кисню з гідроген пероксиду.
У колбу наливаємо 20 мл розчину гідроген пероксиду. Нагріваємо пробірку як у попередньому експерименті. Перевіряємо, чи виділяється кисень як у попередньому досліді за допомогою тліючої скіпки. Скіпка не горить. Це означає, що кисень не виділяється. Додаємо трохи (на кінчику шпателя) манган (ІV) оксиду. (Якщо цього оксиду немає, то каталізатором може бути кусочок сирої картоплі, у ній є каталаза, яка також прискорює цю реакцію). Спостерігаємо бурхливе виділення газу.
Згадуємо, як довести, що цей газ – кисень.
Записуємо рівняння реакції:
t, MnO2
2H2O2 = 2H2O + O2↑
- Визначення: Каталізатори – це речовини, які пришвидшують хімічні реакції, але самі при цьому не витрачаються.
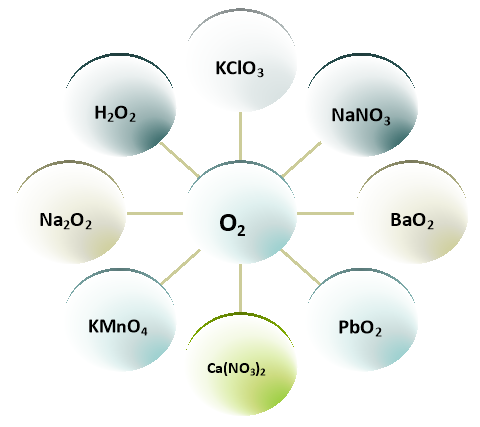
- Це ми ознайомилися лише з двома способами лабораторного добування кисню, а їх є багато. У хімії відомо багато речовин, які містять у своєму складі кисень, можуть розкладатися при нагріванні і утворювати цей відомий нам газ.
Тому зараз ми розглянемо схему «Лабораторні способи добування кисню», дізнаємося ще про нові речовини, які при розкладанні дають кисень.
СХЕМА №1

V. Фаза консолідації.
Для повторення та закріплення того, що ми вивчили сьогодні, попрацюємо в групах.
Завдання для групової роботи із схемою №1:
Група №1
- Допишіть рівняння реакцій запропоновані схемою, урівняйте рівняння.
- Який газ утворюється у результаті цих реакцій?
- Вкажіть умови, за якими відбувається кожна з запропонованих реакцій.
- Вкажіть тип реакцій та сформулюйте визначення.
- За яких умов відбувається реакція розкладу?
- В якій з реакцій необхідно використати каталізатор?
Група №2
Вправа «Допишіть речення, вставте пропущені слова»:
Кисень у лабораторії добувають за допомогою реакцій … . Реакції розкладу – це реакції, під час яких з однієї … речовини утворюється кілька … . Деякі реакції відбуваються тільки за присутності … . Каталізатори – це … , які … хімічні реакції, але самі при цьому … . Кисень, це … , який … горіння. Тліюча скіпка у ньому … .
Група №3
Виконайте перетворення, подані у схемі №2:
СХЕМА №2
Гра «Впізнай мене»
У хмаринках записані неправильно терміни, назви речовин та процесів, які ми згадували у продовж уроку. Впізнайте слова, які ми згадували на уроці у таких конфігураціях та напишіть їх вірно:


![]()
![]()


VІ. Рефлексія
- Чи сподобався вам сьогодні урок?
- Що саме найбільше запам’яталося?
- Що нового ви сьогодні дізналися?
- Що б ви змінили чи запропонували, щоб урок виглядав краще?
VІІ. Домашнє завдання: § 12 (Підручник Н.М.Буринська, Л.П.Величко), сторінка у друкованому зошиті 75 - 77 (автор М.М.Савчин).
Урок 3.
Тема: Хімічні властивості кисню: взаємодія з вугіллям, сіркою, фосфором. Реакція сполучення. Оксиди.
Мета уроку: вивчити хімічні властивості кисню, ознайомити учнів із поняттями «сполучення», «оксиди», «окиснення», «горіння», удосконалити вміння складати хімічні реакції, розвивати соціальну та комунікативну компетентності учнів, працювати над розвитком логічного мислення.
Очікуваний результат:
Учень:
- знає основні поняття теми;
- пише відповідні рівняння реакції;
- розпізнає реакції сполучення;
- аналізує реакції «окиснення» та «горіння».
Обладнання і реактиви: підручник, кулестержневі моделі кисню, таблиці та схеми, червоний фосфор, деревне вугілля, сірка, ложечка, сірники, баночки з киснем з попереднього уроку, вапняна вода.
Форма проведення: урок з використанням методів критичного мислення: робота з опорними схемами, підручником, складання сенкану, методичні вправи «З'єднайте пари» та «Перетвори схему у рівняння реакції», а також демонстрація дослідів.
І. Організаційний момент.
ІІ. Фаза структурованого огляду.
- Вправа «Мікрофон»:
- Як розпізнати кисень та озон за фізичними властивостями?
- Напишіть рівняння реакції розкладу марганцівки.
- Напишіть рівняння реакції розкладу пероксиду водню.
- Які реакції ми називаємо реакціями розкладу?
- Що таке каталізатор?
- Чи можна було б як каталізатор використати будь-яку хімічну речовину?
- Для чого ми використовуємо каталізатор?
- Складіть сенкан (французький п’ятистрофний білий вірш) про кисень, озон, каталізатор, розклад.
Наприклад,
Кисень.
Безбарвний, невидимий.
Окиснює, руйнує, реагує.
З неметалами утворює оксиди.
Газ.
- Повторимо способи добування кисню у лабораторії.
- Допишіть рівняння реакцій.
- Назвіть речовину, що утворюється у результаті таких реакцій.
- Поясніть відомі вам способи добування кисню.
- Поясніть, до якого типу відносяться ці реакції?
- Напишіть відповідні рівняння та поставте коефіцієнти.
- Назвіть способи збирання кисню. (а) витісненням повітря, б) витісненням води). Порівняйте ці способи.
- Поясніть, як перевірити наявність кисню у посудині.
ІІІ. Мотивація навчальної діяльності. Кисень дуже реакційно здатна речовина. Через те в атмосфері кисень існує у вигляді двохатомних молекул – О2, що складається з двох зв’язаних один з одним атомів. А в земній корі знаходиться тільки у вигляді сполук. Без нього неможливі процеси горіння: у кисні можуть горіти навіть такі речовини, що зазвичай вважаються негорючими, наприклад, залізо. Сьогодні ми розглянемо власне процеси взаємодії речовин з киснем.
ІV. Фаза побудови знань.
Вчитель. Отже, переходимо до вивчення хімічних властивостей кисню. Розглянемо схему.
Хімічні властивості кисню.



4P + 5O2 = 2P2O5 2C2H6 + 7O2 = 4CO2 + 6H2O 2Mg + O2 = 2MgO
![]()
![]() C + O2 = CO2 2ZnS + 3O2 = 2ZnO + 2SO2 3Fe + 2O2 = Fe3O4
C + O2 = CO2 2ZnS + 3O2 = 2ZnO + 2SO2 3Fe + 2O2 = Fe3O4
![]()

![]()
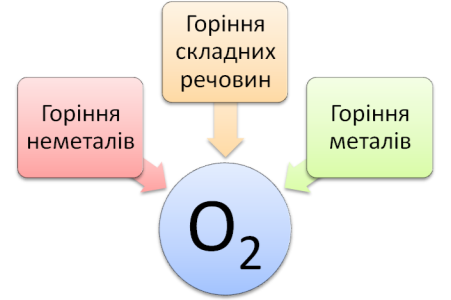
Вчитель. Як бачимо із попередньої схеми, в результаті взаємодії кисню з іншими речовинами (металами, неметалами чи складними речовинами) утворюються бінарні сполуки – оксиди. Оксиди – це складні сполуки, які складаються з двох елементів, один з яких Оксиген. Подивимося, як це відбувається практично. Для дослідів можна використати кисень, який ми збирали на попередньому уроці.
Дослід 1.
Внесемо на залізній ложечці в полум’я вуглинку і, коли вона розжариться, виймемо її з полум’я. Вуглинка деякий час тліє, а потім гасне. В повітрі вугілля горить погано. Розжаримо її ще раз і внесемо у баночку з чистим киснем. Вуглинка розжарюється до білого і горить без полум’я і диму, поступово зменшуючись. Записуємо рівняння реакції:
С + О2 = СО2
Карбон(ІV) оксид
Щоб з’ясувати, що тут утворюється, наллємо в банку вапняної води. Вона стає каламутною. Каламуть з’являється від наявності вуглекислого газу (Карбон(ІV) оксиду) – СО2.
Дослід 2.
Запалимо в ложечці сірку. На повітрі вона горить невеликим синім полум’ям. Опустимо ложечку з сіркою в кисень. Сірка починає горіти енергійніше гарним синім полум’ям. В результаті горіння сірки виділяється сірчистий газ (Сульфур(ІV) оксид) з різким запахом. Він отруйний, тому реакцію проводимо під витяжкою. Записуємо хімічне рівняння:
S + O2 = SO2
Сульфур(ІV) оксид
Дослід 3.
Аналогічно проводимо під витяжкою реакцію з червоним фосфором. Запалимо на ложечці порошок червоного фосфору та опустимо у посудину з киснем. У кисні фосфор горить яскравим сліпучим полум’ям, при цьому посудина наповнюється густим білим димом. Через деякий час частинки диму осідають на стінках посудини у вигляді білого порошку – фосфор(V) оксиду – Р2О5. Запишіть рівняння реакції:
4Р + 5О2 = 2Р2О5
фосфор(V) оксид
Вчитель. Зверніть увагу на склад речовин, що утворилися в результаті цих реакцій. Це – оксиди, бо складаються з двох елементів, один з яких Оксиген. Зверніть увагу на назви оксидів: називається елемент, додається його валентність у тому випадку, коли вона змінна, додається слово «оксид». Також ми бачимо, що тип реакцій зовсім інший, ніж ми зустрічали у попередньому уроці. Такі реакції називаються реакціями сполучення. Реакції сполучення – це реакції між двома простими чи складними речовинами, в результаті яких утворюється одна складна речовина.
V. Фаза консолідації.
1. Вправа «З’єднайте пари»:
- СиО а) магній оксид
- Fe2O3 б) арґентум оксид
- Ag2O в) сульфур(VІ) оксид
- MgO г) купрум(ІІ) оксид
- SO3 д) хлор(VІІ) оксид
- Cl2O7 е) ферум(ІІІ) оксид
2. Перетвори схеми у рівняння реакцій:
? + О2 = MgO Fe + ? = Fe2O3
S + O2 = ? Si + О2 = ?
VІ. Домашнє завдання. § 13 (Підручник Н.М.Буринська, Л.П.Величко), робочий зошит (М.М.Савчин) ст. 77 – 80.
Урок 4.
Тема: Окиснення. Горіння. Умови виникнення та припинення горіння. Колообіг кисню в природі.
Гостьовий урок. Хімія, 4-й та 7-й класи.
УЧАСНИКИ УРОКУ: учні 7 – го та 4 – го класів нашої школи.
Мета уроку: закріпити та поглибити знання про хімічні властивості кисню, розглянути умови виникнення та припинення горіння, колообіг кисню в природі, навчитися відрізняти поняття «окиснення» і «горіння», сприяти зацікавленості учнів навчанням; розвивати соціальну та комунікативну компетентності учнів.
Очікуваний результат:
Учень:
- Знає основні поняття теми;
- Розрізняє фізичні властивості кисню та вуглекислого газу;
- Називає оксиди та вміє записувати їхні формули;
- Пояснює колообіг кисню в природі;
- Формулює визначення понять «окиснення» та «горіння»;
- Пояснює та обґрунтовує умови виникнення та припинення горіння;
- Спостерігає за процесами та лабораторними дослідами;
- Робить висновки зі спостережень;
- Формує здатність використовувати хімічну термінологію.
Обладнання і реактиви: підручник, спиртівка, штатив з пробірками, спирт, калій перманганат, біхромат амонію, магній, гліцерин, крейда, хлоридна кислота, порошок заліза, деревне вугілля, сірники, вогнегасник, свічка, мідна дротина.
Форма проведення: урок з використанням методів критичного мислення та елементами тренінгу, методична вправа кола Вена, методична гра «Кольорове сонечко» та «Впізнай мене».
Епіграф уроку:
« Погані ми філософи, якщо не можемо пояснити навіть такий,
здавалося б, нескладний процес як горіння.»
(Джозеф Прістлі)
І. Організаційний момент.
Учні 7-го і 4-го класів роблять привітання один одному, вітання учнів від вчителя. Учні 4-го класу формують невеликі групи по 3 – 4 учні. На грудях у дітей 4-го класу бейджики з їхніми іменами. Учням 4- класу пропонується намалював на папері чи в альбомі те, що їм найбільше сподобається в процесі уроку, та показати і пояснити в кінці уроку.
Привітання:
Учнів 7 – го класу: 1. Юних хіміків вітаєм, 2. Тож уважно слухайте,
Вчити хімію бажаєм. Та на вус намотуйте.
В ній, звичайно, аси – ми, Що сподобалось, кажіть,
І покажем вам ази! На уроці не тужіть.
Учнів 4 – го класу: 1. Ми прийшли вас привітати, 2. З’явилась хімія давненько –
І про себе розказати. За декілька тисячоліть
Ви із нами познайомтесь, Та рухалась помаленьку
Зрозуміть нас не відмовтесь. Тепер ракетою летить.
Наші думки поважайте, Важко навіть уявити,
Що не так, то вибачайте! Як без хімії прожити?!
Чистить, миє і годує,
Живить, травить і лікує,
* * * *
3. Щоб родили помідори, 4. Посуд, меблі і тканини –
ми під них підсиплем добрив. Це хімічні речовини.
Як природа збій дала, І повітря, і вода, -
Скоригується краса. Взагалі природа вся!
Там підмажем, підфарбуєм, Ледацюг карає строго
Що не треба – затушуєм. Хімія за незнання …
Є косметика у нас – Тож рушай не навмання
Станеш ти красуня враз! В цю країну пречудову,
* * * *
5. І в халепу ти не вскочиш. Там дива на кожнім кроці,
Знатимеш про неї все, І на кожному уроці.
Вона користь принесе. Хімія – країну звуть,
В добрий час! В щасливу путь!
ІІ. Фаза структурованого огляду.
А) учням 4-го класу вчитель пропонує відповісти на такі запитання:
1. Що ви знаєте про кисень, де він знаходиться?
2. Чи може жива природа обходитися без кисню?
3. Як утворюється вуглекислий газ, чи він отруйний, на вашу думку?
4. В якому агрегатному стані (рідкому, твердому чи газоподібному знаходяться) речовини? Запитання можна формулювати в залежності від того, як активно діти відповідають на них.
Б) учні 7-го класу записують на дошці формули кисню, та вуглекислого газів і заповнюють схему. Вправа кола Вена. Учні записують спільні та відмінні фізичні властивості О2 та СО2.
О2 СО2


Мr(О2) = 32 газ Мr(СО2) = 44
Дихання без смаку не придатний для дихання
Підтримує горіння безбарвний не підтримує горіння
Утворюється фотосинтез поглинається в процесі
під час фотосинтезу фотосинтезу
без запаху
ІІІ. Мотивація навчальної діяльності.
Під час вивчення взаємодії кисню з простими речовинами утворюються оксиди. Такі процеси називають окисненням. Проте кисень, ми знаємо, підтримує горіння. Звернемо увагу на епіграф нашого уроку і спробуємо довести Д. Прістлі, що ми вміємо не тільки здійснити реакцію горіння, а можемо пояснити її. Тим паче, що людина використовує дуже часто реакцію горіння у своїй практичній діяльності. Метою сьогоднішнього уроку є вивчити та пояснити процес горіння, вказати на умови виникнення та припинення горіння.
IV. Фаза побудови знань.
Дослід 1: Горіння маґнію в кисні. Записуємо рівняння реакції 2Mg + O2 → 2MgO, в результаті реакції утворюється маґній оксид, бо відбувається окиснення маґнію. Маґній входить до складу бенгальських вогників (учень запалює бенгальський вогник). Робимо висновок: окиснення – реакції взаємодії речовин з киснем. На дошці завдання
№ 1: напишіть рівняння взаємодії кисню з простими речовинами, вкажіть тип реакцій. Як називаються речовини, що утворюються в результаті реакцій?
Дослід 2:
Запалюємо свічку та пропонуємо учням довести, що виділяється тепло. Запалюємо і спостерігаємо реакцію горіння складних речовин сухого та етилового спиртів. Чи виділяється теплота під час горіння цих речовин? Чи бачимо ми світло? В яких випадках у побуті ми використовуємо свічки.
Робимо висновок, що горіння в повітрі відбувається повільніше, ніж у кисні, при чому за реакції горіння відбувається окиснення речовин, бо утворюються оксиди.
Формулюємо визначення реакції горіння: горіння – реакції окиснення речовин з виділенням тепла і світла.
Дослід 3:
Для досліду візьмемо іржавий цвях. Чому він заіржавів? Бо відбулося окиснення заліза. Попробуємо підпалити цвях, чи буде він горіти? Отже, цвях не горить, але він т.люють. Робимо висновок:
- Ті речовини, що горять, окиснюються, але не всі речовини, що окиснюються, горять!
- Цвях (залізо) може витримати вогонь, при цьому не руйнується, але не може витримати окиснення (корозію). З часом вона повністю знищує метал!!!
Звернемо увагу на механізм реакцій сполучення та горіння.(механізм реакцій схематично показано на магнітній дошці).
Бачимо, що одні речовини горять, а інші ні. Чому так відбувається? Розглянемо умови виникнення горіння. Для цього звернемося до опорного конспекту. Знайдіть та прочитайте дві умови, що є необхідними для виникнення горіння. (Учні працюють та оголошують результати, записують у зошит умови виникнення горіння, наводять відповідні приклади).
Горіння починається тоді, коли температура речовини досягає певної межі, яку називають температурою займання. Сформулюйте, що таке температура займання?
Дослід 4:
для досліду беремо калій перманганат, деревне вугілля, та порошок заліза. Нагріваємо суміш у полум’ї спиртівки, спостерігаємо бурхливу реакцію – сніп іскр.
Дослід 5:
калій перманганат розтираємо у ступці для збільшення поверхні стикання. Висипаємо на фарфорову підставку і додаємо кілька капель гліцерину. Реакція починається з диму, а потім з бурхливого і різкого запалювання.
Відбувається самозаймання. Самозаймання – це перетворення процесу повільного окиснення у процес горіння. Причиною самозаймання є зростання температури речовини внаслідок дуже повільного розсіювання теплоти від об’єкту, що окислюється у навколишнє середовище.
Дослід 6: Забарвлення полум’я.
Чи може полум’я бути кольоровим? Беремо мідну дротину, закручену у спіраль. Сильно розігріваємо її у полум’ї спиртівки, занурюємо у розчин хлоридної кислоти і знову вносимо в полум’я спиртівки. Спостерігаємо зелене забарвлення полум’я.
А яких же умов необхідно дотримуватися, щоб припинити горіння? (учні самі роблять висновок, який оголошується, а потім записується до зошитів).
- Пригадайте, які ви знаєте засоби пожежогасіння. Поясніть умови їх роботи.(учні 7-го класу, які на уроках «Основи здоров’я» ознайомилися з правилами роботи з вогнегасником, демонструють свої знання молодшим. Учитель пропонує учням зробити висновок).
В природі теж відбуваються реакції горіння та самозаймання. Наведіть приклади(під час грози від блискавки, горіння природного газу, торфу, виверження вулкану).
Ми в умовах нашого кабінету теж можемо зробити «Вулкан».
Дослід 7:
беремо біхромат амонію, насипаємо на фарфорову підставку і запалюємо. Спостерігаємо реакцію подібну на виверження вулкану.
В результаті горіння складних речовин дуже часто утворюється вуглекислий газ. Він може утворюватися і в результаті інших реакцій.
Дослід 8:
беремо шматочок крейди кладемо її у пробірку і доливаємо до неї розчину хлоридної кислоти. Спостерігаємо бурхливе виділення вуглекислого газу.
V. Фаза консолідації.
1. Для учнів 7-го класу методична гра «Впізнай мене»: над хмаринками записані терміни, що ми згадували на уроці у таких конфігураціях, запишіть їх правильно.






2. Для учнів 4-го класу методична гра «Кольорове сонечко»:
Запам’ятайте терміни, записані на аркуші. (На аркуші намальоване сонечко з промінчиками – словами, які вивчали на уроці). Запишіть терміни, що запам’ятали?
- На заздалегідь розданим учням 4-го класу малюнках зображено колообіг кисню в природі та його застосування. Учні 4-го класу показують малюнки учням 7-го класу. Учні 7-го класу пояснюють побачене на малюнках, та роблять висновки.
Застосування кисню
![]()


![]()
![]()


![]()
![]()


- Льотчики і пожежники використовують спеціальні кисневі маски.
- Окисник у ракетних двигунах.
- На підприємствах металургійної та хімічної промисловості, військова
промисловість – виготовлення вибухівки.
- У медицині.
- Для зварювання і різання металів.
- Необхідний для дихання.
- Діти 4-го класу показують свої власні малюнки присутнім про те, що їм найбільше сподобалося на уроці. Учні роблять висновки на базі вивченого матеріалу. На етапі підведення підсумків можна застосувати методичні вправи «Мікрофон», «Незакінчене речення», «Час похвали» (В залежності від часу, який залишається до закінчення уроку).
VІ. Рефлексія.
- Чи сподобалося вам сьогоднішнє заняття?
- Що вам найбільше запам’яталося?
- Що ще ви хотіли би побачити?
- Чи хочете ви вивчати хімію? (запитання учням 4-го класу).
- Чи хочете ще побачити такий формат уроку?
VІІ. Домашнє завдання: § 13, 14 (автор Н.М. Буринська, Л.П.Величко), робочий зошит
т..82 – 83 різнорівневі завдання (автор М.М.Савчин), підготуватися до практичної роботи (стор. 100 у підручнику).
Урок 5.
Тема. Практична робота №3 «Добування кисню в лабораторії та вивчення його властивостей».
Мета: перевірити якість засвоєння практичного матеріалу з підтеми «Прості речовини. Оксиген. Кисень», закріпити навички роботи з речовинами, повторити правила техніки безпеки, удосконалювати вміння писати рівняння реакції та описувати спостереження, формулювати висновки на основі своїх спостережень.
Очікуваний результат:
Учень:
- знає правила техніки безпеки,
- вміє писати реакції добування кисню в лабораторії,
- дотримується інструкції при проведенні роботи,
- описує спостереження,
- аналізує побачене,
- формулює висновок при закінченні роботи.
Обладнання і реактиви: підручник, спиртівка, штатив з пробірками, сухий спирт, калій перманганат, деревне вугілля, сірники.
Форма проведення: урок – практикум з використанням фронтальної бесіди, практичного експерименту, обробка та оформлення результатів роботи.
І. Організаційний момент.
ІІ. Повторення правил техніки безпеки при роботі у хімічному кабінеті.
Фронтальна бесіда:
- Яких правил ми повинні дотримуватися при роботі з хімічними речовинами?
- Яку інформацію маємо знати при виконанні даної практичної роботи?
- Чи можна без дозволу вчителя змішувати невідомі вам речовини?
- Чи можна залишки непрореагованих речовин зливати до виданих реактивів?
- Що треба знати при роботі із спиртівкою?
- Чому важливо прибрати після роботи своє робоче місце?
ІІІ. Ознайомлення з інструкцією до практичної роботи та обладнанням і реактивами.
ІV. Підбір та підготовка засобів та обладнання.
Вчитель. Уважно читаємо інструкцію перед проведенням роботи та з виданих реактивів підбираємо потрібні речовини та обладнання.
V. Виконання практичної роботи.
Дослід 1. Добування кисню.
1. Складіть прилад для добування газів, як показано на рисунку у підручнику. Насипте шпателем у суху пробірку кристалічного калій перманганату масою 0,5 г. Покладіть біля отвору пробірки пухкий жмуток вати так, щоб вона не торкалася калій перманганату. Закрийте пробірку корком із газовідвідною трубкою, дотримуючись правил техніки безпеки. Закріпіть прилад в лапці штатива так, щоб дно пробірки було трохи вище отвору, а кінець газовідвідної трубки майже торкався дна посудини для збирання кисню. Починайте нагрівання після перевірки зібраного приладу вчителем! Прогрійте спочатку всю пробірку з калій перманганатом, а потім ту частину, де міститься речовина. Починайте нагрівати з дна пробірки, а потім в міру розкладання калій перманганату потрохи пересувайте полум’я.
2. Опишіть спостереження.
3. Вкажіть умови та ознаки проробленої реакції.
4. Напишіть рівняння реакцій.
Дослід 2. Збирання та виявлення кисню.
1. Зберіть кисень витісненням повітря. Поясніть, на якій властивості кисню ґрунтується спосіб його збирання. Перевірте приблизно через півхвилини повноту заповнення хімічної склянки киснем, піднісши кінець тліючої дерев’яної скіпки до отвору посудини для збирання кисню.
2. Опишіть спостереження.
3. Напишіть рівняння реакції взаємодії тліючого вугілля з киснем. Назвіть речовину, що утворилася.
4. Переконавшись, що кисень добуто, загасіть полум’я.
5. Зробіть висновок про проведену роботу.
VІ. Оформлення звіту. Звіт про проведену роботу можна описати словами, а можна занести у табличку:
|
Що робили? |
Що спостерігали? |
Рівняння реакцій |
|
|
|
|
|
|
|
|
VІІ. Прибирання робочого місця.
VІІІ. Домашнє завдання. Повторити тему «Прості речовини. Оксиген. Кисень», підготуватися до залікової роботи.
Урок 6.
Тема. Залікова робота з підтеми «Прості речовини. Оксиген. Кисень».
Мета: перевірити якість засвоєння матеріалу з підтеми «Прості речовини. Оксиген. Кисень».
Очікуваний результат:
Учень:
- розпізнає Оксиген як хімічний елемент та кисень як просту речовину,
- пише рівняння хімічних реакцій, які вказують на хімічні властивості кисню,
- називає речовини, які утворюються в результаті окиснення простих речовин,
- розв’язує задачі з використанням закону збереження мас,
- аналізує хімічні властивості кисню,
Тип уроку: контроль знань, умінь та навичок.
Форми проведення: залікова робота.
Обладнання та реактиви: завдання залікової роботи по варіантах №1 – 6.
І. Організаційний момент.
ІІ. Залікова робота по варіантах.
Варіант №1.
І рівень
1. Хімічний знак Оксигену: а) О, б) О2, в) Н.
2. Де трапляється кисень у вільному стані:
а) в гірських породах; б) в мінералах; в) в атмосфері.
3. З даного переліку формул випишіть оксиди: CaCl2, BaCl2, CaO, Cr2O3, H2S.
( Кожне завдання – 1 бал)
ІІ рівень
1. Вставте пропущені слова: Валентність Оксигену …… дорівнює ….
2. Дайте визначення поняття «каталізатор». Наведіть приклади.
3. Що таке горіння?
( Кожне завдання – 1 бал)
ІІІ рівень
1. Обчисліть масу кисню, що виділився при розкладанні 3,4 г пероксиду водню (H2O2), якщо разом з киснем ще виділилася вода масою 1,8 г. (Завдання – 1 бал)
2. Допишіть рівняння реакцій та підпишіть назви продуктів реакції.
А) H2S + O2 = ; Б) H2O = ; В) Cu + O2 = .
( Завдання – 2 бали)
ІV рівень
1. Напишіть рівняння реакцій:
а) розкладу калій перманганату;
б) горіння вуглецю;
в) горіння метану (CH4). ( Завдання – 3 бали)
Варіант №2.
І рівень
1. Хімічна формула кисню: а) О, б) Н2, в) О2 .
2. Яка з цих речовин використовується як каталізатор:
а) KClO3, б)H2O2, в)KNO3, г) MnO2.
3. З даного переліку формул виписати оксиди: AgNO3, HCl, CuO, CaCl2, SiO2. ( Кожне завдання – 1 бал)
ІІ рівень
1. Вставте пропущені слова: Відносна атомна …… Оксигену дорівнює ….
2. Дайте визначення поняття «реакція розкладу». Наведіть приклади.
3. Назвіть фізичні властивості кисню.
( Кожне завдання – 1 бал)
ІІІ рівень
1. Обчисліть масу кальцій оксиду, що утворився при згорянні кальцію масою 4 г в кисні масою 1,6 г. (Завдання – 1 бал)
2. Допишіть рівняння реакцій та підпишіть назви продуктів реакції:
А) CH4 + O2 = ; Б) H2O2 = ; В) Mg + O2 = .
( Завдання – 2 бали)
ІV рівень
1. Напишіть рівняння реакцій:
а) взаємодія цинку з киснем;
б) добування кисню та марганцівки;
в) взаємодія кисню та етану (С2Н6).
( Завдання – 3 бали)
Варіант №3.
І рівень
1. Склад молекули кисню такий: а) О, б) О2, в) Н.
2. В якому з оксидів валентність елемента найвища:
а) K2O, б) Cl2O7, в) Al2O3, г) MnO2.
3. З даного переліку формул випишіть оксиди: SiH4, AgNO3, BaCl2, K2O, Al2O3.
( Кожне завдання – 1 бал)
ІІ рівень
1. Вставте пропущені слова: Відносна молекулярна … кисню дорівнює ….
2. Дайте визначення поняття «реакція сполучення». Наведіть приклади.
3. Що таке повільне окиснення?
( Кожне завдання – 1 бал)
ІІІ рівень
1. Обчисліть масу пероксиду водню (H2O2), що розклався, якщо виділилася вода масою 3,6 г та кисень масою 6,4 г. (Завдання – 1 бал)
2. Допишіть рівняння реакцій та підпишіть назви продуктів реакції:
А) Zn + O2 = ; Б) KMnO4 = ; В) ZnS + O2 = .
( Завдання – 2 бали)
ІV рівень
1. Напишіть рівняння реакцій:
а) горіння магнію;
б) розклад меркурій(ІІ) оксиду;
в)взаємодія кисню з етиленом (С2Н4).
( Завдання – 3 бали)
Варіант №4.
І рівень
1. Найпоширеніший елемент Землі:
а) Нітроген, б) Оксиген, в) Гідроген.
2. В якому з оксидів валентність елемента найнижча:
а) K2O, б) Cl2O7, в) Al2O3, г) MnO2.
3. З даного переліку формул випишіть оксиди: H2S, NH3, NO, CH4, MnO2.
( Кожне завдання – 1 бал)
ІІ рівень
1. Вставте пропущені слова: Каталізатор – це речовина, яка …… хімічної реакції, але участі ……не ….
2. Дайте визначення поняття «оксиди». Наведіть приклади.
3. Назвіть умови виникнення та припинення горіння.
( Кожне завдання – 1 бал)
ІІІ рівень
1. Обчисліть масу цинку, що згорів у кисні масою 64 г, якщо виділився цинк оксид масою 324 г. (Завдання – 1 бал)
2. Допишіть рівняння реакцій та підпишіть назви продуктів реакції
А) Ca + O2 = ; Б) Al2S3 + O2 = ; В) KMnO4 = .
( Завдання – 2 бали)
ІV рівень
1. Напишіть рівняння реакцій:
а) горіння кальцію;
б) горіння пропану (С3Н8);
в) добування кисню з калій перманганату.
( Завдання – 3 бали)
Варіант №5
І рівень
1. Хімічна формула кисню _______ .
2. Виберіть фізичну властивість серед даного переліку властивостей:
а) кисень взаємодіє з фосфором; б) кисень не має запаху; в) горіння магнію в кисні.
3. Назвіть оксиди подані формулами: K2O, SO2.
( Кожне завдання – 1 бал )
ІІ рівень
1. Сформулюйте визначення оксидів.
2. Визначте валентність елементів, зв’язаних з киснем: WO3, Rb2O.
3. Складіть формули оксидів за їх назвами: барій оксид, ферум(ІІІ) оксид.
( Кожне завдання – 1 бал)
ІІІ рівень
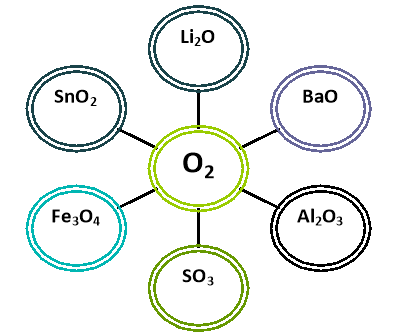
- Визначте формулу оксиду, в якому елемент проявляє найвищу валентність:
Li2O, NiO, SnO2, Cr2O3.
2. Складіть формули та назвіть оксиди, що утворюються в результаті горіння:
а) сірки, б) фосфору, в) вугілля.
3. Перетворіть схеми реакцій на хімічні рівняння:
А) Zn + HCl → ZnCl2 + H2; Б) Al + O2 → Al2O3 ; В) KNO3 →KNO2 + O2.
Серед поданих реакцій вкажіть реакцію сполучення
( Кожне завдання - 1 бал)
IV рівень
1. Напишіть рівняння реакції взаємодії:
а) міді з киснем; б) алюмінію з хлором. До якого типу вони належать.
( Завдання оцінюється - 2 бал )
- Обчисліть, у скільки разів кисень важчий за гелій.
( Завдання оцінюється – 1 бал)
Варіант№ 6
І рівень
1. Вкажіть неправильну відповідь:
а) кисень горить, б) кисень входить до складу повітря, в) кисень є газом.
2. Випишіть формули оксидів серед даного переліку формул речовин:
HCl, MgO, NaBr, KNO3, CO2.
3. Вкажіть валентність Оксигену у сполуках.
( Кожне завдання – 1 бал)
ІІ рівень
1.Сформулюйте визначення оксидів.
2. Визначте валентність елементів у сполуках з киснем: Cr2O3, NO2.
3. Складіть формули оксидів за їх назвами: натрій оксид, нітроген (ІІІ) оксид.
( Кожне завдання – 1 бал)
ІІІ рівень
- Визначте формулу оксиду, в якому елемент проявляє найнижчу валентність:
Fe2O3, OsO4, BeO, SeO3.
2. Складіть формули та назвіть оксиди, що утворюються від взаємодії з киснем:
а) бору, б) силіцію, в) йоду.
3. Перетворіть схеми реакцій на хімічні рівняння:
А) SO2 + O2 → SO3; Б) KClO3→ KCl + O2; В) H2O→ H2 + O2,
вкажіть реакцію сполучення.
( Кожне завдання – 1 бал)
IV рівень
1. Напишіть рівняння реакції взаємодії:
а) алюмінію з хлором; б) калію з киснем. До якого типу вони належать.
(Завдання оцінюється - 2 бали).
2. Обчисліть у скільки разів кисень легший за хлор.
(Завдання оцінюється – 1 бал)
Література для уроків:
1. Букатенко А., Допрофільна підготовка з хімії, гостьовий урок, 3-й, 7-й класи. К.: Хімія. Шкільний світ, 2010. №1 (613), січень
- Еткінс П. Молекули. // Пер. з англійської – М.: Мир, 1991 р. – 215 с.
- Жак О.В., Каличак Я.М. Загальна хімія – Л.: Видавничий центр ЛНУ ім. І.Франка, 2010. – 368 с.
- Савчин М.М. Хімія, робочий зошит, 7 клас. – Л.: ВНТЛ – Класика, 2016 р. – 160 с.


про публікацію авторської розробки
Додати розробку
