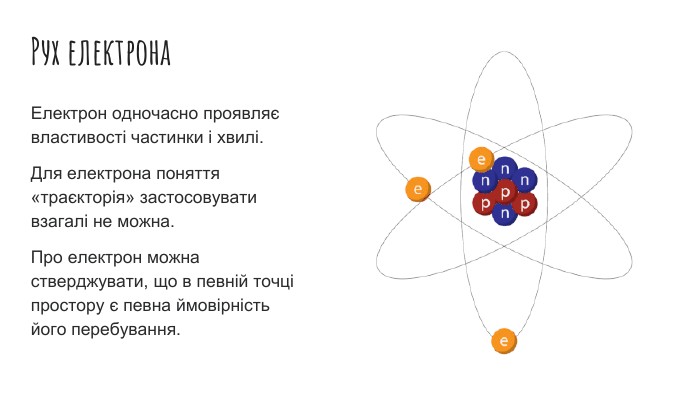
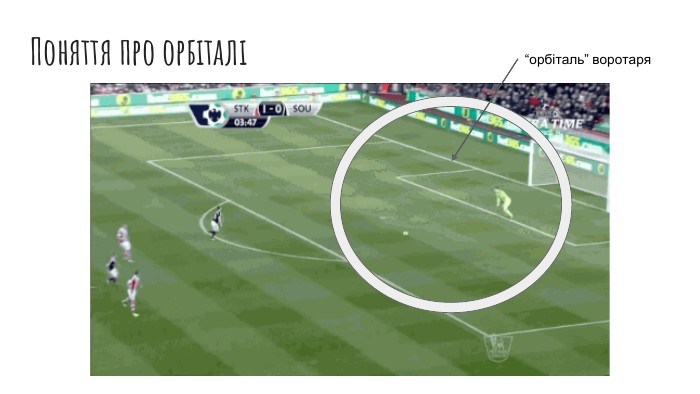
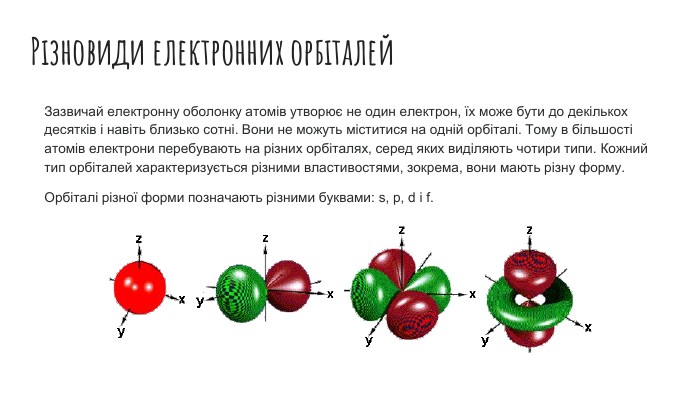
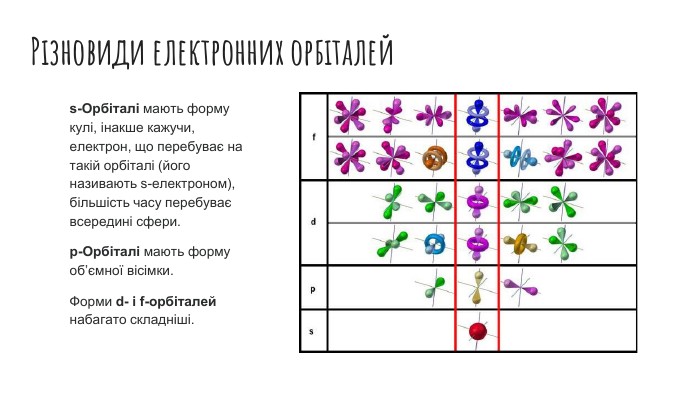
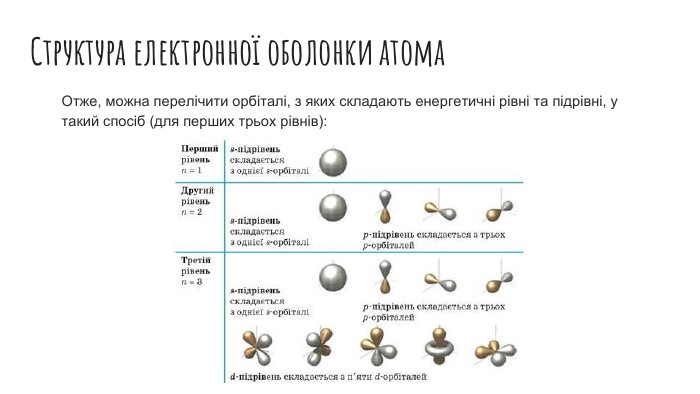
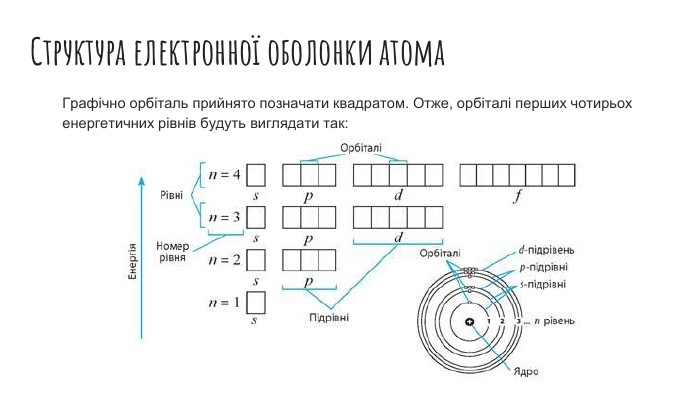
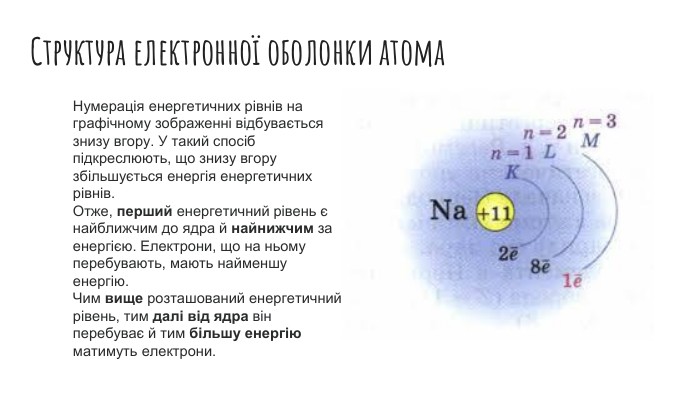
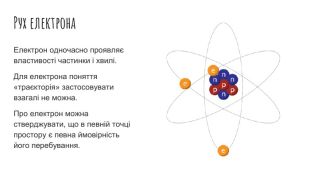
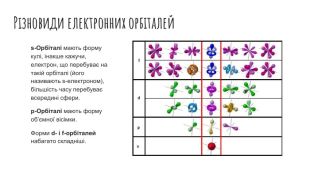
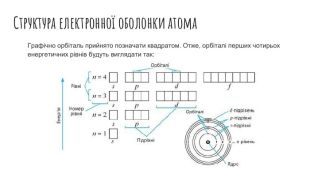
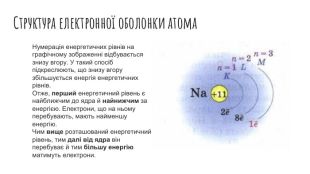
Рух електронів в атомі. Електронні орбіталі. Структура електронної оболонки атома
Про матеріал
Презентація складена на основі підручника "Хімія. Повторне видання. Григорович" Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку