Семінарське заняття«Властивості розчинів»
Міністерство освіти і науки України
Маріупольський коледж Донецького національного університету
економіки і торгівлі імені Михайла Туган - Барановського
МЕТОДИЧНА РОЗРОБКА
семінарського заняття
з теми «Властивості розчинів»
з дисципліни «Фізична та колоїдна хімія»
Маріуполь, 2021
Методична розробка семінарського заняття з теми «Властивості розчинів» з дисципліни «Фізична та колоїдна хімія» при підготовці молодших спеціалістів зі спеціальності 181 «Харчові технології», спеціалізації «Технологія харчування».
Підготувала: Черноус В. В. – викладач хімії, викладач-методист кваліфікаційної категорії «спеціаліст вищої категорії» Маріупольського коледжу Донецького національного університету економіки і торгівлі імені Михайла Туган-Барановського.
|
ЗМІСТ |
||
|
1. |
Вступ …………………………………………………………….. |
4 |
|
2. |
Навчальна методична картка …………………………………... |
7 |
|
3. |
Методика проведення семінарського заняття ………………… |
10 |
|
4. |
Висновки та рекомендації ……………………………………… |
28 |
|
5. |
Література ………………………………………………….. |
29 |
|
|
Додатки ……………………………………………………… |
30 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ВСТУП
Для сучасної освіти України є важливим запровадження системних змін, оновлень у змісті, формах, методах освіти. Інноваційна діяльність набирає значної сили і значення, про що йдеться у відповідних нормативно-правових документах, зокрема в Законах України «Про освіту», «Про вищу освіту».
Сучасні соціальні та економічні умови в нашій державі сприяють підвищенню вимог до якостей спеціаліста, зумовлюють формування такої особистості, яка характеризується не репродуктивним, а творчим типом мислення, ініціативою, самостійністю при розв’язанні проблем. Тому навчання молодих спеціалістів повинно ґрунтуватися не на трансляції готових знань, а на створенні умов для творчої активності.
Методичними засобами, які реалізують такий підхід, є інтерактивні методи навчання. Суть інтерактивного навчання у тому, що навчальний процес відбувається за умов постійної активної взаємодії всіх студентів. Це співнавчання, взаємонавчання (колективне, групове, навчання у співпраці), само- і взаємоконтроль якості засвоєних знань, де і студент, і викладач є рівноправними, рівнозначними суб’єктами навчання, розуміють, що вони роблять, знають, уміють і здійснюють.
Використання інтерактивних методів навчання вимагає активізації навчальних можливостей студента замість переказування абстрактної «готової» інформації, відірваної від їхнього життя і суспільного досвіду.
При застосуванні інтерактивних методів навчальна діяльність набуває для студента творчого характеру, а тим самим викликає у нього інтерес до вивчення даного матеріалу.
Використання нових педагогічних технологій у освітньому процесі дозволяє викладачам реалізувати свої педагогічні ідеї, а студентам дає можливість краще засвоїти навчальний матеріал. Так реалізується найважливіша вимога сучасної освіти − вироблення в суб'єктів освітнього процесу індивідуального стилю діяльності, культури самовизначення, відбувається особистісний розвиток.
Головним питанням сьогодення в системі нової освіти є опанування студентами вмінь і навичок саморозвитку особистості, що значною мірою досягається шляхом впровадження інноваційних технологій в процес навчання.
При цьому можуть і повинні бути використані особистісно-зорієнтовані інноваційні педагогічні технології. Ефективність їх значною мірою залежить від того, як реалізується творчий потенціал особистості студента. Тому повинні змінитися пріоритети в діяльності викладача. Від пояснювально-ілюстративного методу, від трансляції готового навчального змісту, від просвітительства студентів викладач повинен перейти до нових особистісно-зорієнтованих методів, у яких посилено творчо-діяльнісний компонент. Це зумовлює появу освітніх інновацій, покликаних істотно змінити освітній процес.
Перехід сучасного суспільства до інформаційної епохи свого розвитку висуває перед освітою одне з головних завдань − формування основ інформаційної культури майбутнього фахівця. Реалізація цього завдання неможлива без включення інформаційного компонента в систему хімічної освіти.
Семінар − вид навчальних занять практичного характеру, спрямованих на поглиблення, розширення, деталізацію і закріплення теоретичного матеріалу. Семінарські заняття сприяють активізації пізнавальної діяльності студентів, формуванню самостійності суджень, умінню відстоювати власні думки, аргументувати їх на основі наукових фактів. Вони сприяють оволодінню фундаментальними знаннями, допомагають розвивати логічне мислення, формувати переконання, оволодівати культурою толерантності, активно впливати на соціальне становлення особистості. За способом проведення семінарські заняття бувають різних видів: розгорнута бесіда, диспут, коментоване читання, розв’язування задач, обговорення доповідей, повідомлень, результатів творчих робіт.
А проведення семінарського заняття з використанням комп’ютерних технологій це і є впровадженням інноваційних технологій в освітній процес.
Тема «Властивості розчинів» поділена на 5 органічно пов’язаних між собою питань. Розгляд одного питання є основою для наступного. Це дає змогу залучити до обговорення питань максимум студентів. Доцільно заохочувати слухачів виступати з уточненнями і доповненнями. Семінар передбачає попередню підготовку студентів.
За тиждень до семінару викладач дає студентам питання з теми, до яких треба підготуватися. У підготовці до семінару студентам рекомендується опрацювати основну і додаткову літературу. В ході підготовки до семінару студенти радяться з викладачем, консультуються, готують творчі завдання.
Під час проведення семінарського заняття викладач використовує слайди з теми за допомогою комп’ютерної програми Power Point як засіб наочності з одночасним коментуванням. Форма сприйняття слайдів пов’язана з їх змістом та несе в собі аналітичний та синтезуючий характер. Використання комп’ютерної техніки дозволяє студентам краще засвоїти, систематизувати матеріал з теми.
НАВЧАЛЬНО – МЕТОДИЧНА КАРТКА
План заняття
Дисципліна |
|
|
Тема заняття |
|
Вид заняття(тип уроку) |
Семінарське заняття
|
Форма проведення: |
|
|
Навчальна: |
|
перевірити засвоєння знань студентами за темою, поглибити знання про властивості розчинів. |
|
Розвиваюча: |
|
формування наукового світогляду, самостійного логічного мислення. |
|
Виховна: |
|
виховання свідомого засвоєння дисципліни; |
|
формування відчуття відповідальності, самостійності студентів, збільшення ступеня організованості. |
|
Забезпечуючі: технологія виробництва кулінарної продукції, товарознавство |
|
харчових продуктів, неорганічна, органічна хімія. |
|
Забезпечувані: основи стандартизації та контроль якості харчової продукції, технологія |
|
виробництва кулінарної продукції. |
 Забезпечення заняття
Забезпечення заняття
Наочні посібники: періодична система хімічних елементів Д.І Мендєлєєва, таблиця розчинності.
Роздавальний матеріал: картки контролю знань студентів.
Технічні засоби навчання: мультимедіа, ноутбук.
Навчальне місце: кабінет хімії
ЛІТЕРАТУРА:
Обов’язкова:
- В.Е. Ліпатніков, К.М. Казаков «Фізична і колоїдна хімія» М. Вища школа, 1981 р. с. 89-118.
Додаткова:
- С.В. Горбунова, Е.А. Муловрова «Фізична і колоїдна хімія» М., 2013 р.
Хід заняття
|
№ елемента |
Елементи заняття, навчальні питання, форми її методи навчання |
Добавлення, змінення, зауваження |
|
1 |
2 |
3 |
|
І.
ІІ.
ІІІ.
IV.
V.
VІ.
VІІ.
|
Організаційний момент.
Ознайомлення студентів з темою та навчальною метою. Викладач повідомляє, що темою семінарського заняття є «Властивості розчинів» . Навчальна мета і основне завдання – перевірка і систематизація отриманих знань за темою. Мотивація навчання Значення теми «Властивості розчинів» у майбутній професійній діяльності, для вивчення хімічних сполук, що становлять основу харчових продуктів, для фізико-хімічних методів аналізу якості сировини, напівфабрикатів і готової продукції. Семінар 4.1 Обговорення плану. 4.2 Узагальнення теоретичного навчального матеріалу за планом: 1. Розчинність газів, рідини та твердих речовин. 2. Дифузія та осмос. 3. Закони Рауля. 4. Властивості розчинів електролітів. 5. Дисоціація води. Водневий показник. Реферативні доповіді студентів (презентації)
Коментар відповідей, доповідей студентів. Виставлення оцінок. Підсумок семінарського заняття. Логічне завершення дискусії. Студенти самостійно роблять висновки про значення теми. Домашнє завдання: В.Е. Ліпатніков, К.М. Казаков «Фізична і колоїдна хімія» М. Вища школа, 1981 р. с. 89-118.
|
3 хв.
3 хв.
5-7 хв.
40-45 хв. слайд 40 хв. презентація
7-10 хв. слайди
5 хв. 3-5 хв.
2-3 хв.
|
СЕМІНАР
за темою «Властивості розчинів»
Мета: перевірити засвоєння знань за темою «Властивості розчинів»
ПЛАН
1. Розчинність газів, рідини та твердих речовин.
2. Дифузія та осмос.
3. Закон Рауля.
4. Властивості розчинів електролітів.
5. Дисоціація води. Водневий показник.
Реферати за темами:
- Гідратна теорія розчинів Д.І. Менделєєва.
- С. Арреніус – авто теорії електролітичної дисоціації.
Література:
Обов’язкова: В.Е. Ліпатніков, К.М. Казаков «Фізична і колоїдна хімія» М. Вища школа, 1981р.
Додаткова: С.В. Горбунова, Е.А. Муловрова «Фізична і колоїдна хімія» М., 2013 р.
О.А. Стрельцов. Фізична і колоїдна хімія. Львів. Ліга-прес., 2002р.
МЕТОДИКА ПРОВЕДЕННЯ СЕМІНАРСЬКОГО ЗАНЯТТЯ
Успішність проведення семінарського заняття залежить як від якісної підготовки студентів так і підготовки викладача. Потрібно підготувати навчальну аудиторію, забезпечити її технічними засобами навчання, наочними посібниками. Треба перевірити роботу комп’ютера та мультимедійної системи. Основна умова правильного проведення заняття - це старанна підготовка викладача до заняття. Для цього потрібно скласти план заняття, написати навчально-методичну карту, передбачити час на виконання кожного завдання, скласти питання до опитування студентів. Викладач завчасно готує завдання, проводить консультації зі студентами.
Заняття починається з організаційного моменту:
1) перевірка наявності студентів;
2) перевірка готовності аудиторії до занять;
3) відповіді на запитання студентів, які виникли під час підготовки домашнього завдання.
Ознайомлення студентів з темою та навчальними цілями заняття
Викладач повідомляє тему заняття та нагадує питання, які студенти повинні були вивчити, готуючись до семінару, пропонує студентам провести семінарське заняття в дискусійній формі. Кожен студент згідно питань до теми готується до семінару. Вони готують презентації, реферати, доповіді. Навчальна мета і основне завдання – перевірка і систематизація отриманих знань за темою.
Мотивація навчальної теми
Викладач мотивує вивчення даної теми, вказавши на її значення у майбутній професійній діяльності, для вивчення хімічних сполук, що становлять основу харчових продуктів, для фізико-хімічних методів аналізу якості сировини, напівфабрикатів і готової продукції.
Вступне слово викладача
Розчини в житті людини мають велике значення, особливо водні розчини. Скільки води знаходиться в організмі людини? Де у повсякденному житті використовується вода? Чи можливо приготувати їжу без використання води? Що таке розчини?
На ці та інші питання стосовно водних розчинів відповідають студенти у фронтальній бесіді.
Доцільно тут використання кадрів з фільму про воду.
Далі проводиться узагальнення теоретичного навчального матеріалу за планом:
1. Розчинність газів, рідини та твердих речовин.
2. Дифузія та осмос.
3. Закони Рауля.
4. Властивості розчинів електролітів.
5. Дисоціація води. Водневий показник.
При розгляді питань використовуються слайди презентації «Властивості розчинів».
Реферативні доповіді студентів (презентації).
1. Гідратна теорія розчинів Д.І. Менделєєва.
2.С. Арреніус – автор теорії електролітичної дисоціації.
Студенти роблять реферативні доповіді надають інформацію з питань семінарського заняття і використовують при цьому слайди презентацій.
В процесі дискусійного обговорення проводяться уточнення та доповнення матеріалу з питань семінару.
Коментар відповідей, доповідей студентів
За активну роботу, за виконання завдань викладач виставляє оцінку, коментує їх. Визначаються позитивні і негативні (якщо є) моменти по кожному студенту.
Підсумок семінарського заняття
Логічне завершення дискусії. Студенти самостійно роблять висновки про значення теми «Властивості розчинів».
Домашнє завдання
Як форма самостійної роботи домашнє завдання студентів відіграє важливу роль в освітньому процесі. Виконуючи його, студенти запам’ятовують цілий ряд фактичних знань, встановлюють причинно-слідчі зв’язки, вчаться використовувати знання,
Викладач задає студентам домашнє завдання. Виділяє час на ознайомлення з методичними рекомендаціями по вивченню теми.
Теоретичний матеріал «Властивості розчинів»
Склад розчинів. Способи вираження концентрації
Склад розчинів найчастіше виражають через вміст розчиненої речовини. Вміст розчиненої речовини у розчині називають концентрацією. Є такі способи вираження концентрації (в дужках у деяких випадках наводяться колишні назви, які зараз вживати не рекомендується):
1. Масова частка со (масовий процент, процентна концентрація), визначається як відношення маси розчиненої речовини т(Х) до загальної маси розчину тр:
![]()
V - об’єм, р - густина розчину. Якщо розчин складається з двох компонентів, тр= т(Х) + m(S), де m(S) - маса розчинника.
Сума масових часток усіх компонентів розчину дорівнює одиниці або 100%: ω (S) + (O(X1) + ω(Х2) +... = 1 (100%).
- Молярна частка N - це відношення кількості розчиненої речовини п(Х) до загального числа молів усіх речовин у розчині Σ n1:
![]()
Наприклад, для двокомпонентної системи:![]() , де n(S) - число молів розчинника. Сума молярних часток усіх компонентів розчину також дорівнює одиниці:
, де n(S) - число молів розчинника. Сума молярних часток усіх компонентів розчину також дорівнює одиниці: ![]()
Масова та молярна частки - безрозмірні величини.
- Молярна концентрація C(X) визначається як відношення кількості розчиненої речовини п(Х) до об’єму розчину (розмірність моль/л, або моль/дм3):
![]()
де Vp - об’єм розчину.
-
Молярна концентрація еквівалентів
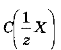 (нормальна або еквівалентна концентрація; визначається як відношення числа молів еквівалентів розчиненої речовини
(нормальна або еквівалентна концентрація; визначається як відношення числа молів еквівалентів розчиненої речовини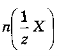 до об’єму розчину Vp (розмірність моль-екв./л):
до об’єму розчину Vp (розмірність моль-екв./л):
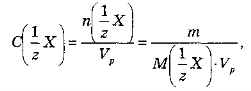
де т - маса (наважка) розчиненої речовини;![]() молярна маса еквівалентів розчиненої речовини; г - число еквівалентності.
молярна маса еквівалентів розчиненої речовини; г - число еквівалентності.
- Моляльність (моляльна концентрація) b(Х) - кількість розчиненої речовини п(Х) в 1 кг розчинника (розмірність моль/кг):
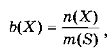
де m(S) - маса розчинника (кг).
Якщо задані маси, об’єм або кількість розчиненої речовини та розчинника (чи розчину), для розрахунків концентрації використовують наведені вище вирази, а також відомі співвідношення між масою та об’ємом речовин (т = p-V) та між масою і кількістю речовини:![]()
Процес розчинення. Сольватація. Теплота розчинення
Розчинення - складний фізико-хімічний процес взаємодії розчинника і розчиненої речовини. Про це свідчить зокрема те, що утворення розчинів супроводжується тепловими ефектами, іноді досить значними. Так, під час розчинення гідроксиду калію у воді теплота виділяється, а розчинення хлориду калію у воді супроводжується поглинанням теплоти.
В процесі утворення істинних розчинів між частинками речовини, що розчиняється, руйнуються зв’язки, внаслідок чого утворюються окремі молекули або іони, які під дією теплового руху частинок та дифузії рівномірно розподіляються в розчиннику. Наприклад, при розчиненні хлориду калію іони K+ та Cl-, що утворюють кристалічну гратку, треба відірвати один від одного, для чого витрачається енергія, яка відповідає енергії іонної кристалічної гратки.
При розчиненні йоду у воді треба подолати сили дисперсійної міжмолекулярної взаємодії між молекулами I2. Тобто процес розриву зв’язків між частинками речовини, що розчиняється, Є ендотермічним, ΔН розр.зв. > 0. Якби не відбувались якісь інші процеси, то розчинення завжди супроводжувалося б поглинанням теплоти.
Однак численні приклади розчинення з виділенням теплоти свідчать, що одночасно відбуваються й інші процеси. Дійсно, рушійною силою розчинення є утворення нових зв’язків, що виникають при взаємодії частинок розчиненої речовини з молекулами розчинника. Цей процес називається сольватацією (для водних розчинів - гідратацією). Він супроводжується виділенням енергії, ΔН cольв < 0.
Явище сольватації зумовлене відомими видами взаємодії між молекулами розчинника і частинками розчиненої речовини: орієнтаційною, індуктивною, дисперсійною та водневим зв’язком. Коли розчиняється неполярна речовина в неполярному розчиннику, наприклад бензол у гексані, сольватація зумовлена дисперсійною взаємодією. При розчиненні неполярної речовини в полярному розчиннику (наприклад, йоду у воді) до дисперсійної взаємодії додається індукційна. Якщо полярну речовину розчиняти в полярному розчиннику, наприклад метанол у воді, мають місце всі згадані вище види міжмолекулярної взаємодії, але найсуттєвішим є вклад водневого зв’язку.
Іноді під час розчинення відбуваються хімічні перетворення речовин. Наприклад, при розчиненні хлороводню у воді відбувається процес дисоціації HCl на іони і утворення іона гідроксонію H3O+ за рахунок донорно-акцепторного зв’язку між іоном Н+(акцептор) та молекулою H2O (донор).
Загальний тепловий ефект розчинення ΔН rpозч дорівнює алгебраїчній сумі зазначених вище теплових ефектів:
![]()
Знак теплового ефекту розчинення залежить від співвідношення складових![]() Якщо в процесі сольватації енергії виділяється більше, ніж витрачається на розрив зв’язків між частинками речовини, що розчиняється, процес розчинення екзотермічний, ΔН розч < 0. Якщо ж на розрив зв’язків енергії витрачається більше, ніж виділяється при сольватації, то речовина розчиняється із вбиранням теплоти, ΔН pозч > 0. Теплоти розчинення деяких речовин у воді подані в таблиці.
Якщо в процесі сольватації енергії виділяється більше, ніж витрачається на розрив зв’язків між частинками речовини, що розчиняється, процес розчинення екзотермічний, ΔН розч < 0. Якщо ж на розрив зв’язків енергії витрачається більше, ніж виділяється при сольватації, то речовина розчиняється із вбиранням теплоти, ΔН pозч > 0. Теплоти розчинення деяких речовин у воді подані в таблиці.
Таблиця 1. Теплоти розчинення деяких речовин у п молях води за 298 K
|
Речовина |
n |
ΔН р, КДж/моль |
Речовина |
n |
ΔН р, КДж/моль |
|
CH3OH(P) |
∞ |
-1,6 |
НГ(г) |
∞ |
-60,7 |
|
СО2(г) |
1600 |
-19,7 |
H3BO3(K) |
∞ |
-21,8 |
|
CaCl 2 (к) |
100 |
-74,8 |
NH3(F) |
100 |
-34,1 |
|
CaCl2-6Н2 О(к) |
400 |
19,1 |
NH4Cl(K) |
∞ |
14,8 |
|
FeCl3(K) |
1000 |
-132,4 |
NaCl(K) |
200 |
5,1 |
|
НВг(г) |
∞ |
-85,1 |
NaOH(K) |
200 |
-42,3 |
|
НС1(г) |
∞ |
-74,8 |
Na2SO4 10Н2O(K) |
400 |
78,5 |
Розчинення як оборотний процес. Розчинність
Утворення розчинів найчастіше є оборотним процесом. Дійсно, якщо, наприклад, невелику порцію хлориду калію внести у воду, то ця порція солі розчиниться; те ж саме відбудеться і з наступною порцією. Але при подальшому додаванні хлориду калію можна помітити, що процес розчинення поступово уповільнюється. Врешті розчинення цієї сполуки у воді припиняється. Чому? Адже має місце великий надлишок молекул води, і далі був би можливий процес сольватації іонів солі, завдяки якому може відбуватися процес розчинення. Дійсно, процес розчинення продовжується, але треба врахувати, що одночасно має місце і зворотний процес - виділення речовини з розчину. Швидкість зворотного процесу зростає при збільшенні концентрації розчину, тому він поступово врівноважує процес розчинення. У насиченому розчині швидкість розчинення дорівнює швидкості виділення речовини з розчину (для розчинених твердих речовин це називають кристалізацією). Такий розчин перебуває в рівновазі з розчиненою речовиною. Концентрація речовини в насиченому розчині є мірою її розчинності.
Якщо концентрація розчину є меншою, ніж у насиченому, швидкість розчинення буде більшою від швидкості виділення речовини з розчину; такий розчин називається ненасиченим.
Для деяких речовин можна отримати розчини, концентрація яких за даної температури вища, ніж концентрація насиченого розчину. Наприклад, за нагрівання можна одержати досить концентрований розчин ацетату натрію, відділити його від твердої фази і обережно охолодити, після чого концентрація солі буде більшою, ніж у насиченому розчині, але її надлишок з розчину не виділяється. Такі розчини називаються пересиченими. Вони нестійкі, і якщо внести в такий розчин центр кристалізації (кристалик розчиненої речовини, пил тощо), надлишок розчиненої речовини викристалізується (швидкість виділення речовини з розчину більша за швидкість розчинення) і розчин стане насиченим. Цей прийом часто застосовують для очищення речовин (метод перекристалізації), оскільки домішки лишаються в розчині.
Розчинність речовин залежить від природи речовин, які утворюють розчин, температури, а для газів - ще й від тиску.
Залежність розчинності від природи компонентів розчину
Ще й досі не існує кількісної теорії, за допомогою якої можна було б розраховувати розчинність речовин. Це пояснюється складним характером процесів, що відбуваються під час розчинення. Але відомі деякі правила та закономірності, за допомогою яких можна якісно пояснити вплив природи речовин на розчинність. Так, ще алхіміки дійшли висновку, що «подібне розчиняється у подібному». Дійсно, у розчинниках, які складаються з полярних молекул (вода, рідкий аміак, спирти) найчастіше добре розчиняються саме полярні речовини (мінеральні кислоти, луги, деякі солі). У ряді випадків розчинність може бути необмеженою (вода - етанол, вода - сульфатна кислота тощо). Навпаки, неполярні речовини, такі, як бензол, йод, мідь, азот, у воді розчиняються мало. Але бензол може необмежено розчинятися у подібній до себе речовині - толуолі, йод добре розчиняється у бензолі, а мідь - у іншому металі - ртуті.
Вплив температури та тиску на розчинність речовин у рідинах
Розчинність речовин залежить не тільки від природи розчиненої речовини і розчинника, але й від температури та тиску.
Коли тверда речовина розчиняється в рідкому розчиннику, відбувається руйнування кристалічної решітки речовини, що розчинюється, на що витрачається енергія (ΔHpозч.зв > 0), і сольватація, яка супроводжується виділенням енергії (ΔHсольв < 0). Найчастіше на руйнування кристалічної гратки енергії витрачається більше, ніж виділяється за сольватації:![]() тобто більшість твердих речовин розчиняється із вбиранням теплоти (ΔHpoзч > 0). Але є тверді речовини, які розчиняються в рідинах з виділенням теплоти (ΔHрозч <0). Це можливе, коли
тобто більшість твердих речовин розчиняється із вбиранням теплоти (ΔHpoзч > 0). Але є тверді речовини, які розчиняються в рідинах з виділенням теплоти (ΔHрозч <0). Це можливе, коли
![]() (приклади див. у табл.1).
(приклади див. у табл.1).
для оборотних процесів вплив температури на розчинність можна пояснити, використовуючи принцип Ле Шательє. З підвищенням температури в системі буде переважати процес, що послаблює зростання температури, тобто ендотермічний процес. А таким процесом найчастіше є розчинення твердих речовин. Тому в більшості випадків розчинність твердих речовин у рідинах за нагрівання зростає. Але відомі випадки, коли розчинення твердих речовин перебігає з виділенням теплоти; тоді за нагрівання їх розчинність зменшується. Якщо розчинення супроводжується незначним тепловим ефектом, то розчинність практично не залежить від температури. Наприклад, розчинність нітрату калію, нітратів плюмбуму і аргентуму з підвищенням температури значно зростає, а хлориду натрію - змінюється незначною мірою. Для сульфату натрію залежність розчинності від температури має складніший характер: до 32,4°С (305,55 К) розчинність його швидко збільшується, а далі з підвищенням температури - зменшується. Це пояснюється тим, що нижче 32,4°С у рівновазі з насиченим розчином перебуває кристалогідрат Na2SO4 IOH2O, розчинення якого супроводжується вбиранням теплоти, вище даної температури кристалогідрат переходить у безводну сіль Na2SO4, яка розчиняється з виділенням теплоти. Відомості про розчинність 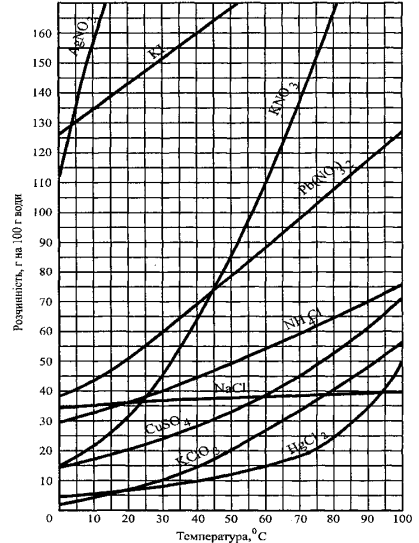 різних речовин залежно від температури можна знайти в спеціальних таблицях, на основі яких будуються графіки - криві розчинності (рис.1).
різних речовин залежно від температури можна знайти в спеціальних таблицях, на основі яких будуються графіки - криві розчинності (рис.1).
Тиск практично не впливає на розчинність твердих речовин у рідинах, оскільки об’єм системи зі зміною тиску в процесі розчинення змінюється мало.
Розглядаючи взаємну розчинність рідин, треба зазначити, що під час їх змішування Рис. 9.1. Криві розчинності деяких солей у воді.
мають місце випадки, коли рідини: а) розчиняються одна в одній необмежено (етанол- вода); б) розчиняються обмежено (фенол-вода), в) практично одна в одній не розчиняються (ртуть-вода). Як вже зазначалося, розчинність перш за все визначається природою цих рідин.
Вплив температури на розчинність розглянемо для випадку “б” - обмеженої розчинності рідин. Так, у системі вода - фенол під час змішування речовин за звичайних умов утворюються дві різні фази - розчини фенолу у воді та води у фенолі. Склад їх неоднаковий і залежить від температури: так за 293 K у першому з цих розчинів міститься 8% фенолу і 92% води, в другому - 72% фенолу та 28% води. Процес розчинення фенолу у воді та води у фенолі супроводжується поглинанням теплоти, тому з нагріванням взаємна розчинність речовин збільшується, тобто зростає концентрація фенолу в першому розчині та води в другому. Склад фаз наближається один до іншого, і за 339 K лишається одна фаза (36% фенолу і 64% води), тобто в системі настає необмежена розчинність. Температура, починаючи з якої дві рідини необмежено змішуються, називаються критичною температурою розчинення. За охолодження система повертається до стану обмеженої розчинності і розшаровується (знову утворюються дві фази).
Зауважимо, що зростання взаємної розчинності рідин та перехід до стану необмеженої розчинності за нагрівання спостерігається далеко не завжди. Вплив температури на розчинність рідин у рідинах часто має досить складний характер.
Розчинність газів у рідинах залежить від природи речовин, що утворюють розчин, температури і тиску.
Розглядаючи вплив температури на розчинність газів, перш за все визначимо, якими тепловими ефектами характеризується цей процес. Відомо, що енергія розриву зв’язків між молекулами газу близька до нуля через велику відстань і слабку взаємодію між молекулами, тобто ΔHpозчs ~ 0. Тому згідно з формулою ΔHpозч = ΔHcoльв. Оскільки ΔHcoльв < 0, то і ΔHpзч < 0, тобто процес розчинення в цьому випадку відбувається з виділенням теплоти. Внаслідок цього, згідно з принципом Ле Шательє, підвищення температури знижує розчинність газів.
Зі збільшенням зовнішнього тиску, згідно з принципом Ле Шательє, у рівноважній системі більшою мірою повинен відбуватися процес, який послабить підвищення тиску. Тому частина молекул газу перейде в розчин і розчинність збільшиться. Залежність розчинності газу від тиску визначається законом Генрі: за сталої температури розчинність газу в рідині прямо пропорційна його парціальному тиску:
![]()
Де т- маса газу, розчиненого в даному об’ємі рідини; P - тиск (ат.); k - коефіцієнт пропорційності, який залежить від природи речовин, що утворюють розчин, і від температури. Коли P=I ат., т = k, тобто k - розчинність газу за нормальним тиском.
Якщо над рідиною знаходиться суміш кількох газів, то розчинність кожного з них визначається його парціальним тиском.
Закон Генрі справедливий тільки для досить розбавлених розчинів за невисоких тисків та відсутності хімічної взаємодії між молекулами розчиненої речовини і розчинника.
Температури кипіння і кристалізації розчинів
Тиск насиченої пари над розчинами
Як зазначалося, багато важливих хімічних реакцій проводять саме в розчинах. Після цього речовини, що утворилися, виділяють перегонкою або кристалізацією, тому велике значення мають питання кристалізації та кипіння розчинів. Температури кипіння і кристалізації розчинів пов’язані зі зміною тиску насиченої пари над розчинами.
Тиск насиченої пари над чистою рідиною залежить тільки від температури. Але якщо за даної температури в рідині розчиняти якусь нелетку речовину, то тиск насиченої пари зміниться. Дійсно, концентрація розчинника в розчині зменшується, внаслідок чого зменшується швидкість випаровування, і тому нова рівновага встановлюється за меншого тиску насиченої пари. Зменшення тиску насиченої пари над розчином можна також пояснити, виходячи з принципу Ле Шателье: при зменшенні концентрації розчинника в рідкій фазі рівновага в системі рідина - пара зміщується таким чином, щоб послабити це зменшення. Тому частина молекул розчинника переходить з пари в рідину; зменшення числа молекул в одиниці об’єму пари приводить до зниження тиску насиченої пари. Французький вчений Ф.М. Рауль (1830-1901) встановив, що зниження тиску насиченої пари над розчином пропорційне концентрації розчиненої речовини.
Якщо через P0 позначити тиск насиченої пари над розчинником, а через P - над розчином, то P0 - P = ΔP - зниження тиску насиченої пари над розчином. Відношення ΔP / P0 називається відносним зниженням тиску насиченої пари. Його величина визначається першим законом Payля:
відносне зниження тиску насиченої пари розчинника над розчином дорівнює молярній частці розчиненої речовини:
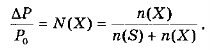
З даного формулювання випливає, що зниження тиску насиченої пари над розчином залежить від кількості частинок (молекул) розчиненої речовини і не залежить від її природи та температури.
Гпідвищення температури кипіння розчинів
Рідина починає кипіти, коли тиск насиченої пари над нею зрівнюється з зовнішнім тиском. Тиск насиченої пари розчинника над розчином нижчий, ніж над чистим розчинником, тому за температури кипіння розчинника T0k розчин не кипітиме. Щоб розчин закипів, його треба нагріти до вищої температури Tk (див. рис. 2), коли тиск його насиченої пари стане рівним зовнішньому тиску. У більш концентрованому розчині підвищення температури кипіння розчину (ATk=Tk-Tk0) буде більшим, оскільки більш значним є зниження тиску насиченої пари над розчином (ΔР). Оскільки ΔР, згідно з першим законом Рауля, пропорційне числу молів розчиненої речовини, то й ATk перебуватиме в такій самій залежності від цієї величини. Тому:
підвищення температури кипіння розчину ΔTk пропорційне числу молів розчиненої речовини в певній кількості розчинника:
![]()
де b (X) - моляльність розчину, тобто число молів розчиненої речовини в 1 кг розчинника.
Фізичний зміст коефіцієнта пропорційності E можна визначити, коли величина b (Х) буде дорівнювати одиниці. За цих умов ΔTk = Е. Це - ебуліоскопічна стала розчинника, яка вказує на підвищення температури кипіння одномоляльного розчину (1 моль розчиненої речовини в 1 кг розчинника).
Якщо взяти розчини різних речовин в одному й тому ж розчиннику, наприклад водні розчини глюкози, цукру, гліцерину, з однаковою моляльною концентрацією, то їх температури кипіння мають бути однаковими. Саме це експериментально довів Рауль. Можна також зробити висновок, що значення ебуліоскопічної сталої E не залежить від природи розчиненої речовини.
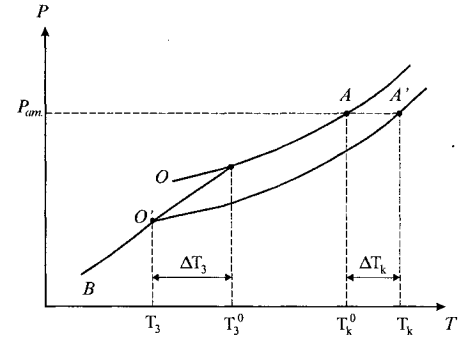
Рис. 2. Підвищення температури кипіння (ΔТк) та зниження температури замерзання (ΔT3) розчину: OA - тиск пари над рідким розчинником; OS - тиск пари над твердим розчинником; О’А’ - тиск пари над розчином.
Аналогічні досліди з розчинами, які містять однакову речовину в різних розчинниках, показують, що величина E залежить від природи розчинника і для кожного даного розчинника є сталою величиною. Так, для води, бензолу і оцтової кислоти ебуліоскопічна стала E становить відповідно 0,52; 2,57 і 3,1 К/моль.
Зниження температури кристалізації (замерзання) розчинів
Як було показано, рідка фаза (вода) і тверда фаза (лід) перебувають у рівновазі, коли тиск насиченої пари над цими фазами однаковий. На рис. 2 ця умова виконується в точці О, де перетинаються криві тиску насиченої пари над рідкою і твердою фазами (криві OA і OB). Отже, точці O відповідає температура кристалізації (замерзання) чистого розчинника.
Коли охолоджувати розбавлений розчин, то за певної температури також починається кристалізація розчинника (при охолодженні розбавленого водного розчину утворюються кристали льоду). Рівновага в системі рідкий розчин ↔ твердий розчинник настане, коли тиск насиченої пари над цими фазами стане однаковим. Оскільки тиск насиченої пари над розчином нижчий, ніж над чистим розчинником, криві тиску пари над розчином (О' А') і над твердим розчинником (OB) перетинаються за більш низької температури (точка O'). Отже, кристалізація розчину починається за нижчої температури, ніж розчинника. Різниця температур кристалізації розчинника (T30) і розчину (T3) називається зниженням температури замерзання розчину: ΔT3 = Т° - T3. Чим вищою є концентрація розчину, тим більше знижується тиск насиченої пари і температура кристалізації розчину стає нижчою. Отже, зниження температури замерзання розчину пропорційне числу молів розчиненої речовини в певній кількості розчинника:
![]()
де b (Х) - моляльність розчину, к - кріоскопічна константа розчинника, яка показує зниження температури замерзання одномоляльного розчину (якщо 6 = 1 моль/кг, ΔT3 = к). г: Як і ебуліоскопічна константа, к залежить тільки від природи розчинника. Для води вона становить 1,86, для бензолу 5,12, для оцтової кислоти 3,9 К/моль.
Отже, ΔT3 (як і ΔТК) не залежить від природи розчиненої речовини, а тільки від числа її молів, тобто від числа її частинок у розчині.
Наведені вище залежності ΔT3 і ΔTk розчинів від їх концентрацій називають другим законом Рауля.
Закони Рауля придатні лише для розбавлених розчинів нелетких неелектролітів.
Дисоціація води і водневий показник водних розчинів
Чиста вода за звичайних умов незначною мірою проводить електричний струм. Це пояснюється тим, що приблизно лише одна з 10 млн. молекул дисоціює на іони:
![]()
Константа дисоціації води![]() за ст.у. (298 К) дорівнює 1,8∙10-16. Цей процес є ендотермічним і зворотним до реакції нейтралізації сильної кислоти сильною основою. Внаслідок незначної дисоціації можна вважати, що концентрація недисоційованої частини (молекул H2O) є сталою. Розрахуємо [H2O], прийнявши до уваги, що маса 1 л води за звичайних умов близька до 1000 г (точно 1000 г за 4°С):
за ст.у. (298 К) дорівнює 1,8∙10-16. Цей процес є ендотермічним і зворотним до реакції нейтралізації сильної кислоти сильною основою. Внаслідок незначної дисоціації можна вважати, що концентрація недисоційованої частини (молекул H2O) є сталою. Розрахуємо [H2O], прийнявши до уваги, що маса 1 л води за звичайних умов близька до 1000 г (точно 1000 г за 4°С):
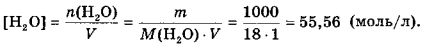
Перенесемо сталі члени у виразі константи дисоціації в ліву частину:![]()
Це означає, що за певної температури добуток K∙[H2O] є сталою величиною. За 298 K він дорівнює 1,8-10-16 ∙ 55,56 = 10-14 і називається іонним добутком води Кв:
![]()
Kв - є сталою величиною не тільки в чистій воді, а й у розбавлених водних розчинах кислот, основ і солей, коли концентрація розчиненої речовини істотно менша від концентрації води. Умовно межею розбавлених розчинів можна вважати такі, концентрація розчиненої речовини в яких не перевищує 1 моль/л, тобто не більше 2% молярної концентрації води.
Іонний добуток залежить від температури. За нагрівання, згідно з принципом Ле Шательє, посилюється процес, що йде з поглинанням теплоти, тобто процес утворення іонів. Тому іонний добуток води збільшується: при 0; 25 і 1000C його значення відповідно дорівнюють 0,13∙10-14, 1∙10-14 і 76 10-14.
У чистій воді та нейтральних розчинах солей і неелетролітів виконується умова: [Н+] = [ОН-]. Оскільки добуток цих величин дорівнює Kв, то: ![]()
За температури 298 К, коли Kв = IO14 , [Н+] = [ОН-] = 10-7моль/л.
У розчинах кислот [H+] збільшується. Рівновага процесу дисоціації води зсувається так, щоб послабити зростання концентрації цих іонів, тобто в бік недисоційованих молекул води. Тому концентрація іонів OH зменшується, а іонний добуток Kb залишається сталим. У кислому середовищі [Н+] > 10 7 моль/л, а [OH-] < 10-7 моль/л.
У розчинах лугів [ОН-] > 10-7 моль/л. Рівновага дисоціації води також зсувається в бік утворення молекул води і концентрація йонів H+ зменшується. Отже, в лужних розчинах [H+] < IO-7 моль/л, а добуток концентрацій іонів H+ і OH- (тобто Kв також не змінюється.
Для характеристики кислотності середовища зручно користуватися водневим показником pH, який дорівнює від’ємному десятковому логарифму активності іонів гідрогену: pH = - Ig ан+.
Щодо розбавлених розчинів, можна вважати, що ан+ ≈[Н+], тому:
pH=-lg[H+].
У чистій воді та в нейтральних середовищах, де [H+] = 10-7 моль/л, pH =-Ig10-7 = 7 . У кислих середовищах, де [H+] > 10-7, значення pH < 7 і в лужних середовищах, де [Н+3 < 10 7 моль/л, значення pH > 7.
Наведемо приклади розрахунків значень pH в розчинах лугів та сильних кислот. Одержані значення pH є наближеними, оскільки в розрахунках знехтуємо різницею між активними та загальними концентраціями іонів. Так, у розчині сильної кислоти, наприклад хлоридної чи нітратної, концентрація якої складає 0,1 моль/л, [H+] = 10-1 моль/л, оскільки кислота дисоціює практично повністю і під час дисоціації однієї молекули кислоти утворюється один іон H+. Тоді дістанемо: pH = -lg[H+] = -Ig0, 1 = 1. Якщо концентрація цієї кислоти складає 1 моль/л (цю концентрацію можна умовно вважати межею розбавленого розчину), pH = - Ig 1 = 0.
У розчині гідроксиду калію за умови, що C(KOH) = 0,01 моль/л, [ОН-] також дорівнює 0,01 моль/л, оскільки KOH дисоціює повністю. З виразу для іонного добутку води (10.9) випливає: [H+ ] • 0,01 = IO-14, звідки [H+ ] = IO-12 моль/л, а pH = 12. Якщо C(KOH) = 1 моль/л, [ОН-] = 1 моль/л. Тоді добуток [H+] I = IO14, концентрація H+ = IO14, звідки pH = 14.
Таким чином, у розбавлених водних розчинах, коли концентрація сильної кислоти або лугу не перевищує 1 моль-екв/л, за 298 K (25°С) можна прийняти, що у кислому середовищі значення pH змінюється в межах від 0 до 7, а в лужному - від 7 до 14, виключаючи саме значення 7 (нейтральне середовище). Наведені значення pH є дещо наближеними, оскільки в розрахунках нехтували різницею між активними та аналітичними концентраціями іонів.
На практиці для визначення pH середовища використовують індикатори та спеціальні вимірювальні прилади – іономіри (рН-метри).
ВИСНОВКИ ТА РЕКОМЕНДАЦІЇ
Одне з основних направлень сучасного освітнього процесу − вміння студентів працювати з інформацією, находити і вибирати необхідний матеріал, аналіз та використання інформації в реальних умовах.
Студенти при проведенні семінарського заняття включаються у пошукову, пізнавальну діяльність, вчаться находити та обробляти інформацію.
Цей метод сприяє організації спільної діяльності, діалогічному спілкуванню, як між викладачами і студентами, так і між самими студентами в процесі приготування відповідей на запитання семінару, розвитку комунікативних вмінь, що важливо для успішної професійної реалізації студентів.
Елементи семінарського заняття дають можливість підвищити зацікавленість студентів до процесу навчання і більш активно сприймати навчальний матеріал. Таким чином реалізується головна мета − навчити студентів орієнтуватися в потоці інформації і вміти користуватися нею.
Методична розробка може бути рекомендована викладачам для застосування у підготовці семінарських занять та використання в роботі викладачів хімічних дисциплін.
ЛІТЕРАТУРА
1. Горбунова С.В., Муловрова Е.А. «Фізична і колоїдна хімія» М., 2013 р.
2. Ліпатніков В.Е., Казаков К.М. «Фізична і колоїдна хімія» М. Вища школа, 1981 р. с. 89-118.
3. Стрельцов О.А., Мельничук Д. О. та ін. Фізична і колоїдна хімія: Підручник для студентів аграрних закладів освіти. – Львів: Ліга-Прес, 2002. – 456с.
4. Інтернет ресурси:
1


про публікацію авторської розробки
Додати розробку

