Тема: Фізичні властивості середніх солей. Хімічні властивості середніх солей: взаємодія з металами, кислотами.
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ЦЕНТРАЛЬНОУКРАЇНСЬКИЙ ДЕРЖАВНИЙ ПЕДАГОГІЧНИЙ УНІВЕРСИТЕТ ІМЕНІ ВОЛОДИМИРА ВИННИЧЕНКА
“ЗАТВЕРДЖУЮ”
Груповий методист : Форостовська Т. О
Вчитель хімії: ________
«____»________________2022 р
КОНСПЕКТ УРОКУ
з хімії у 8 –Б класі
з теми : «Фізичні властивості середніх солей. Хімічні властивості середніх солей: взаємодія з металами, кислотами.»
студентки - практикантки IV курсу
факультету математики, природничих наук та технологій
спеціальність 014 Середня освіта (Біологія та здоров’я людини)
Осікової Марини Володимирівни
Дата проведення:
“______” _________________ 2022 року
Оцінка вчителя _______ ____________
(підпис вчителя)
Урок 9. Тема: Фізичні властивості середніх солей. Хімічні властивості середніх солей: взаємодія з металами, кислотами.
Мета:
- повторити склад та назви середніх солей; ознайомити з фізичними та хімічними властивостями солей: взаємодія з металами, кислотами;
- розвивати вміння узагальнювати, спів ставляти, робити висновки;
- виховувати трудолюбиву особистість.
Тип уроку: вивчення нового матеріалу
Обладнання і реактиви: пробірки, реактиви.( розчин купрум (ІІ) сульфату, цинк сульфату, шматочки мідного дроту, гранули цинку.); підручник, робочий зошит, презентація.
Методи:
Словесні: пояснювально-ілюстративні - бесіда, розповідь;
наочні - демонстрації;
практичні - виконання вправ; інтерактивні; репродуктивні, частково-пошукові, творчі, ігрові.
Прийоми розумової діяльності: порівняння та аналіз, спостереження, формулювання висновків, міркування, припущення, висування гіпотези, експеримент.
Базові поняття і терміни: солі, реакція заміщення, обміну.
Структура уроку та хронометраж:
І. Організація класу (2 хв.)
ІІ. Перевірка домашнього завдання (3 хв)
ІІІ. Актуалізація опорних знань (7 хв.)
I V. Мотивація навчальної діяльності, повідомлення теми та мети (3 хв.)
V. Вивчення нового матеріалу (17 хв.)
VІ. Узагальнення та систематизація знань (10 хв.)
VІI. Підбиття підсумків уроку (2 хв.)
VІIІ. Домашнє завдання (1 хв.)
Хід уроку
І. Організація класу
(привітання, перевірка наявності учнів; організація уваги учнів до уроку).
ІІ. Перевірка домашнього завдання
Перевірка домашнього завдання учнів біля дошки та в зошитах.
ІІІ. Актуалізація опорних знань
Завдання 1. Закінчити речення очікувань, використовуючи метод «Мікрофона».
1.Я знаю, що солі складаються з_______________ та ____________________________.
2.Я знаю, що сучасною українською номенклатурою назва солі утворюється від назви _______________ та ____________________
3.Я знаю, що солі класифікують на _____________ , ___________ , ___________ ,____________ , ___________________.
Завдання 2.
|
1.Встановити відповідність між формулами солей та їхніми назвами: 1.NaCІ А)ферум(ІІ) нітрат 2.Fe(NO3)3 Б)натрій хлорид 3.K2S В)натрій карбонат 4. Na2CO3 Г)калій сульфід Д)ферум(ІІІ) нітрат |
1.Встановити відповідність між формулами солей та їхніми назвами: 1. K2SО4 А)калій сульфід 2. K2SО3 Б)калій сульфат 3. Ва3(РО4)2 В)натрій силікат 4. Na2SiO3 Г)калій сульфіт Д)барій ортофосфат. |
IV. Мотивація навчальної діяльності, повідомлення теми та мети
(застосовується метод «мікрофон»). Учні відповідають на питання: навіщо потрібно знати фізичні та хімічні властивості солей? Де можна застосувати ці знання?
Запишемо тему уроку: Фізичні властивості середніх солей. Хімічні властивості середніх солей: взаємодія з металами, кислотами.
V. Вивчення нового матеріалу
ФІЗИЧНІ ВЛАСТИВОСТІ СОЛЕЙ. За нормальних умов солі перебувають лише у твердому стані. Це досить тугоплавкі кристалічні речовини, а тому для переведення їх у рідкий стан, не кажучи вже про пароподібний, потрібні високі температури. Так, температура плавлення барій сульфіду дорівнює 2200 °С. Солі — речовини без запаху.
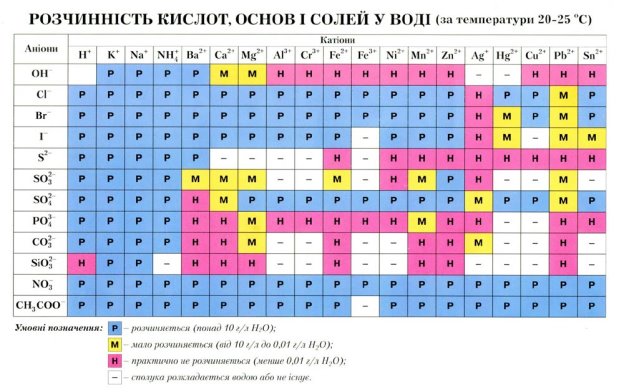
За здатністю розчинятись у воді солі поділяють на розчинні (наприклад, натрій хлорид, калій нітрат), малорозчинні (наприклад, магній сульфіт, плюмбум(ІІ) хлорид) і нерозчинні (наприклад, кальцій карбонат, барій сульфат). Інформацію про розчинність солей, а також кислот й основ можна дістати з таблиці розчинності цих сполук у воді
Може здатися, що клас речовин «Солі» дістав таку назву через солоний смак його сполук. Насправді ж є лише одна сіль із дійсно солоним смаком, і вона добре вам відома, бо це — натрій хлорид. Лікарі застерігають від надмірного вживання кухонної солі, проте життєво необхідних порцій натрій хлориду потребують організми і людини, і тварин. А потрібна вона для підтримання складу крові, а також вироблення шлункового соку. Фізіологічний розчин, крапельниці з яким використовують для лікування хворих, є розчином натрій хлориду.
Солодкі на смак солі Берилію, гіркі — Магнію, не має смаку кальцій карбонат СаСО3 (крейда). Здебільшого солі мають змішаний смак — солодко-кислий, солоно-гіркий тощо.
ПАМ'ЯТАЙТЕ! У хімічному кабінеті солі (як і будь-які інші речовини) у жодному разі не можна куштувати на смак!
Солі здебільшого мають білий колір. Проте колір ферум(ІІІ) хлориду FeCl3 — коричнево-червоний, арґентум ортофосфату Ag3PO4 — жовтий, кобальт(ІІ) нітрату — смарагдово-зелений, нікель(ІІ) нітрату — рожевий.
Перегляд відео «Солі. Зразки солей»: https://www.youtube.com/watch?v=zly98HH5Vfo
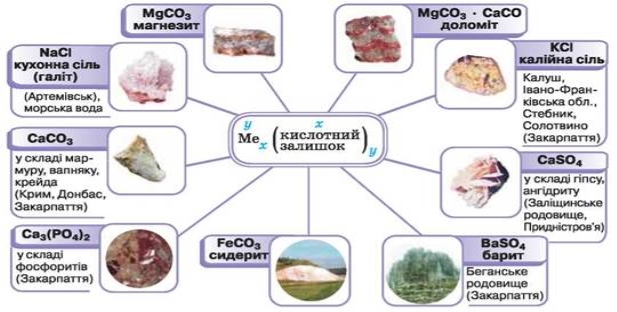 На підтвердження фізичних властивостей солей уважно розгляньте зразки солей, які вчитель демонструє вам на уроці, й ті, що зображені на малюнку 45. Про їхнє поширення в природі ви дізнаєтеся вже у цьому навчальному році.
На підтвердження фізичних властивостей солей уважно розгляньте зразки солей, які вчитель демонструє вам на уроці, й ті, що зображені на малюнку 45. Про їхнє поширення в природі ви дізнаєтеся вже у цьому навчальному році.
Мал. 45. Солі в природі
1. Взаємодія розчинів солей із металами.
Працями М. Бекетова доведено, що метали проявляють різну хімічну активність. Тому в реакціях між металом і сіллю активніший метал витіснить менш активний.

Бекетов Микола Миколайович (1827-1911) — український фізико-хімік. Розробив теорію витіснення металів, установив ряд активності металів, описав метод відновлення металів за допомогою алюмінію. Захистив докторську дисертацію з теми «Дослідження над явищами витіснення одних металів іншими». Учений працював у Харківському університеті, де вперше читав курс фізичної хімії як самостійну наукову дисципліну. Був членом Петербурзької академії наук. Праці М. Бекетова та його учнів заклали підвалини харківської фізико-хімічної школи.
Наприклад, якщо мідну монету покласти в розчин меркурій(ІІ) нітрату, вона поступово покриється шаром ртуті, а мідь перейде в розчин:
Cu + Hg(NO3)2 = Cu(NO3)2 + Hg.
Дослідимо взаємодію солей з металами в процесі лабораторного досліду.
Переглянемо відео «Взаємодія металів із солями у водному розчині»: https://www.youtube.com/watch?v=jvi_rpEw9IA&ab_channel=%D0%AE%D0%BB%D1%96%D1%8F%D0%91%D0%B0%D1%82%D1%83%D1%80%D0%B0
Лабораторний дослід № 4
Взаємодія металів із солями у водному розчині
Обладнання: штатив із пробірками, піпетки.
Реактиви: розчини купрум(ІІ) сульфату, цинк сульфату; гранули цинку, мідний дріт.
Правила безпеки:
- під час виконання дослідів використовуйте невеликі кількості реактивів;
- остерігайтеся потрапляння реактивів на одяг, шкіру, в очі; у разі потрапляння їдкої речовини її слід негайно змити великою кількістю води.
Хід роботи
1. У першу пробірку налийте розчин купрум(ІІ) сульфату об’ємом 2 мл, у другу — розчин цинку сульфату об’ємом 2 мл.
2. У першу пробірку з купрум(ІІ) сульфатом занурте одну – дві гранули цинку, а в другу — шматочок мідного дроту. Що спостерігаєте? Чи зміняться ознаки реакції, якщо в розчин купрум(ІІ) сульфату опустити гранули цинку, а в розчин цинку сульфату — шматочок мідного дроту? А якби в обох випадках використали срібну пластину?
3. Запишіть свої спостереження. Складіть відповідні рівняння реакцій.
4. Зробіть висновок, де обґрунтуйте можливість взаємодії солей із металами з погляду розташування металів у ряду активності.
Висновки
- 1. Усі метали, розміщені в єдиний ряд за зменшенням їх активності, утворюють ряд активності металів. До нього також занесений водень як речовина, відносно якої визначають активність металів.
- 2. Метали, розміщені в ряду активності ліворуч від водню, витісняють його з кислот. Чим лівіше розміщений метал, тим активніше він вступає в реакції.
- 3. Метали можуть витісняти один одного із солі: активніший метал завжди витісняє менш активний. Для проведення таких реакцій із водними розчинами солей не можна використовувати метали, розміщені в ряду активності до магнію, оскільки вони взаємодіятимуть із водою, а не з розчиненою в ній сіллю.
2. Взаємодія солей з кислотами.
Водні розчини солей реагують з кислотами, унаслідок чого утворюється нова сіль і нова кислота.
Перегляд відео «Взаємодія кислот із солями»: https://www.youtube.com/watch?v=_XnwMMjUleI&t=20s&ab_channel=%D0%94%D0%9E%D0%A1%D0%9B%D0%86%D0%94%D0%98%D0%97%D0%A5%D0%86%D0%9C%D0%86%D0%87%D0%94%D0%9B%D0%AF%D0%97%D0%A0%D0%A3%D0%A7%D0%9D%D0%9E%D0%93%D0%9E%D0%9D%D0%90%D0%92%D0%A7%D0%90%D0%9D%D0%9D%D0%AF
Виконання завдань в кінці відео.
Отже, зробимо висновок про взаємодію розчинів солей з кислотами. Реакції між солями й кислотами в розчинах відбуваються за умови, якщо:
1) утворюються нова сіль і нова кислота. Нова кислота є нестійкою та розкладається на відповідний їй оксид і воду. Унаслідок реакції виділяється газ;
2) випадає нерозчинний у кислотах осад.
VІ. Узагальнення та систематизація знань
1. Перелічіть відомі вам фізичні властивості солей.
2. Визначте за таблицею розчинності кислот, основ, амфотерних гідроксидів і солей у воді розчинні й нерозчинні солі з переліку речовин, що подані формулами: Ca(NO3)2, MgCl2, CaCO3, CuSO4, AgCl, Al2(SO4)3, BaSO4, AgBr, Na2S, Zn3(PO4)2, FeBr3.
3. Закінчіть рівняння реакцій:
Na2CO3 + HCl →
NaCl + H2SO4 →
K2SO3 + HNO3 →
4. Спрогнозуйте, де будуть проходити реакції між такими речовинами.
Zn + Pb(NO3)2 →
H2SO4 + MgSiO3→
Al + SnCl2 →
HNO3 + Ca3(PO4)2 →
VІI. Підбиття підсумків уроку
Рефлексія
- Чи сподобався вам урок і чому?
- Ваші пропозиції по організації і проведенню наступного уроку?
- Ваше відношення до хімії перед уроком і після нього?
VІIІ. Домашнє завдання
1.Опрацювати 31 параграф підручника.
2.Розв’язати задачу:
Задача. Обчисліть масу міді що утвориться при взаємодії цинку з 40г розчину купрум (ІІ) хлориду.


про публікацію авторської розробки
Додати розробку
