Урок №1. Основні положення молекулярно-кінетичної теорії та їх дослідне обґрунтування (конспект)
Урок №1. Основні положення молекулярно-кінетичної теорії та їх дослідне обґрунтування (конспект)
Мета: враховуючи знання учнів, отримані в 7-8 класах, ознайомити учнів з основними положеннями молекулярно-кінетичної теорії та їх дослідним підтвердженням.
–Розвивати в учнів інтерес до фізики, як науки.
–Розвивати логічне мислення школярів.
Тип уроку: Урок вивчення нового матеріалу.
Обладнання: модель броунівського руху, таблиця взаємодія молекул, розчин фурациліну, вода, пробірки; комп'ютер, інтерактивна дошка, програмне забезпечення SMART Notebook, презнтація (електронний додаток ППЗ «Фізика 10. Основи МКТ»).
Демонстрації:
1. Фрагмент відеофільму «Молекули молекулярний рух».
2. Механічна модель броунівського руху.
3. Дифузія в газах і рідинах (Відеодослід).
4. ОК-1
Урок №1. Основні положення молекулярно-кінетичної теорії та їх дослідне обґрунтування
Мета: враховуючи знання учнів, отримані в 7-8 класах, ознайомити учнів з основними положеннями молекулярно-кінетичної теорії та їх дослідним підтвердженням.
– Розвивати в учнів інтерес до фізики, як науки. – Розвивати логічне мислення школярів.
Тип уроку: Урок вивчення нового матеріалу.
Обладнання: модель броунівського руху, таблиця взаємодія молекул, розчин фурациліну, вода, пробірки; комп’ютер, інтерактивна дошка, програмне забезпечення SMART Notebook, презнтація (електронний додаток ППЗ «Фізика 10. Основи МКТ»).
Демонстрації:
1. Фрагмент відеофільму «Молекули молекулярний рух».
2. Механічна модель броунівського руху.
3. Дифузія в газах і рідинах (Відеодослід).
4. ОК-1
План викладення нового матеріалу.
1. Основні положення МКТ.
2. Дослідні підтвердження МКТ.
3. Основна задача МКТ.
МПЗ: фізика 7кл., хімія, історія.
План
|
Етапи уроку |
Методи й форми роботи з класом |
|
I. Організаційний етап. |
Якісні запитання. |
|
II. Актуалізація опорних знань. |
Фронтальне опитування. |
|
III. Повідомлення теми, мети й завдань уроку; мотивація навчальної діяльності учнів. |
Розв’язування задач із коментарем біля дошки, запис в зошити. |
|
IV. Сприймання й осмислення нового матеріалу. |
Бесіда, презентація |
|
V . Закріплення нового матеріалу. |
Фронтальне опитування. |
|
VI. Підведення підсумків уроку та повідомлення домашнього завдання. |
Коментар учителя. |
Викладання нового матеріалу.
Молекулярна фізика і термодинаміка – це по суті дві різні по своїх підходах, але тісно зв'язані науки, що займаються одним і тим же – вивченням макроскопічних властивостей фізичних систем, але абсолютно різними методами.
В основі молекулярної фізики або молекулярно-кінетичної теорії лежать певні уявлення про будову речовини. Для встановлення законів поведінки макроскопічних систем, що складаються з величезного числа частинок, в молекулярній фізиці використовуються різні моделі речовини, наприклад, моделі ідеального газу.
Молекулярна фізика є статистичною теорією, тобто теорією, яка розглядає поведінку систем, що складаються з величезного числа частинок (атомів, молекул), на основі моделей ймовірності. Вона прагне на основі статистичного підходу встановити зв'язок між експериментально виміряними макроскопічними величинами (тиск, об'їм, температура і т.д.) і мікроскопічними характеристиками частинок, що входять до складу системи (маса, імпульс, енергія і т.д.).
На відміну від молекулярно-кінетичної теорії, термодинаміка при вивченні властивостей макроскопічних систем не спирається ні на які уявлення про молекулярну структуру речовини. Термодинаміка є наукою феноменологічною. Вона робить висновки про властивості речовини на основі законів, встановлених на досліді, таких, як закон збереження енергії. Термодинаміка оперує лише із макроскопічними величинами (тиск, температура, об'їм і т.п.), які вводяться на основі фізичного експерименту.
Обидва підходи – термодинамічний і статистичний – не суперечать, а доповнюють один одного. Лише спільне використовування термодинаміки і молекулярно-кінетичної теорії може дати якнайповніше уявлення про властивості систем, що складаються з великого числа частинок.
. Основні положення МКТ.
Розділ фізики, в якому розглядаються закономірності атомно молекулярної будови макроскопічних тіл (систем), називається молекулярною фізикою.
Основоположником МКТ є Демокріт (V – IVст. до н.е.), М.В.Ломоносов (XVIIIст.). Молекулярно-кінетична теорія зародилася в XIX столітті з метою пояснити будову та властивості речовини на основі уявлення про те, що речовина складається з дрібних частинок – молекул, які безперервно рухаються та взаємодіють одна з одною. Особливих успіхів ця теорія досягла у поясненні властивостей газів.
Молекулярно-кінетичною теорією називають вчення, що пояснює будову та властивості тіл рухом і взаємодією частинок, з яких складаються тіла. В основі МКТ лежать три найважливіші положення:
• усі речовини складаються з молекул або інших структурних одиниць (атомів, електронів, іонів), розділених проміжками;
• частинки речовини перебувають у безперервному хаотичному русі (його часто називають тепловим рухом);
• частинки речовини взаємодіють одна з одною (притягуються і відштовхуються), а рівнодіюча цих сил називається силою молекулярної взаємодії.
. Дослідні підтвердження МКТ. 1) Припущення про молекулярну будову речовини підтверджувалося лише побічно. Розміри молекул та атомів такі малі, що розрізнити їх у звичайний мікроскоп неможливо. Тому навіть у XIX столітті багато вчених ще сумнівалися в існуванні молекул. Сьогодні техніка досягла рівня, за якого можна роздивитись навіть окремі атоми. Переконатися в існуванні молекул і оцінити їхні розміри можна досить просто. Якщо помістити крапельку олії на поверхню води, олія розтечеться по ній дуже тонким шаром. Максимальна площа олійної плівки відповідає її товщині в одну молекулу. Знаючи об'єм крапельки і площу олійної плівки, яка утворилася з неї, можна оцінити розмір однієї молекули олії. Наприклад, крапелька олії об'ємом 1 мм3 розтікається по площі, яка не більша 1м2. Звідси випливає, що товщина олійної плівки становить близько 10-9м. Таким чином, характерною довжиною у світі молекул є розмір 10-10м.
Доказом дискретної побудови речовини є фотографії, одержані за допомогою іонного, електронного і тунельного мікроскопів. Про наявність проміжків між молекулами свідчить зміна об'єму твердих тіл і рідини при змінюванні їхньої температури.
2) Дифузія – це процес перерозподілу концентрації атомів у просторі шляхом хаотичної, тобто теплової міграції.
Осмос – одностороння дифузія.
Броунівський рух – хаотичний рух завислих у рідині або в газі частинок твердого тіла.
Переконатися в тому, що молекули рухаються, можна зовсім просто: капніть крапельку парфумів в одному кінці кімнати, і через кілька секунд цей запах пошириться по всій кімнаті.
У повітрі, що нас оточує, молекули рухаються зі швидкістю артилерійських снарядів - сотні метрів за секунду. Дивною властивістю руху молекул є те, що він ніколи не припиняється. Цим рух молекул істотно відрізняється від руху оточуючих нас предметів: адже механічний рух неминуче припиняється внаслідок тертя. На початку XIX століття англійський ботанік Броун, спостерігаючи в мікроскоп частинки пилку рослин, замулені у воді, помітив, що ці частинки здійснюють «вічний танок». Причину так званого «броунівського руху» зрозуміли лише через 50 років після його відкриття: окремі удари молекул рідини об частинку не компенсують один одного, якщо ця частинка достатньо мала. З того часу броунівський рух розглядається як наочне дослідне підтвердження руху молекул.
Найяскравішим експериментальним підтвердженням представлень молекулярно-кінетичної теорії про безладний рух атомів і молекул є броунівський рух. Цей тепловий рух найдрібніших мікроскопічних частинок, зважених в рідині або газі. Він був відкритий англійським ботаніком Р. Броуном. в 1827 р. Броунівські частинки рухаються під впливом безладних ударів молекул. Через хаотичний тепловий рух молекул ці удари ніколи не зрівноважують один одного. В результаті швидкість броунівської частинки безладно міняється по модулю і напряму, а її траєкторія є складною зигзагоподібною кривою (рис.1). Теорія броунівського руху була створена А. Ейнштейном в 1905 р. Експериментально теорія Ейнштейна була підтверджена в дослідах французького фізика Ж. Перрена, проведених в 1908-1911 р.р.

Рис.1. Траєкторія броунівської частинки
Головний висновок теорії А. Ейнштейна полягає в тому, що квадрат зміщення <r2> броунівської частинки від початкового положення, усереднений по багатьох броунівських частинках, пропорційний часу спостереження t.
<r2> = Dt.
Це співвідношення виражає так званий дифузійний закон. Як випливає з теорії коефіцієнт пропорційності D монотонно зростає із збільшенням температури.
Постійний хаотичний рух молекул речовини виявляється також в іншому легко спостережуваному явищі – дифузії. Дифузією називається явище проникнення двох або декількох дотичних речовин один в одного. Найбільш швидко процес протікає в газі, якщо він неоднорідний по складу. Дифузія приводить до утворення однорідної суміші незалежно від густини компонентів. Так, якщо в двох частинах посудини, розділених перегородкою, знаходяться кисень O2 і водень H2, то після видалення перегородки починається процес взаємопроникнення газів один в одного, що приводить до утворення вибухонебезпечної суміші – гримучого газу. Цей процес йде і у тому випадку, коли легкий газ (водень) знаходиться у верхній половині посудина, а більш важкий (кисень) – в нижній.
Значно повільніше протікають подібні процеси в рідинах. Взаємопроникнення двох різнорідних рідин один в одного, розчинення твердих речовин в рідинах (наприклад, цукру у воді) і утворення однорідних розчинів – приклади дифузійних процесів в рідинах.
В реальних умовах дифузія в рідинах і газах маскується більш швидкими процесами перемішування, наприклад, через виникнення конвекційних потоків.
Найбільш поволі процес дифузії протікає в твердих тілах. Проте, досліди показують, що при контакті добре обчищених поверхонь двох металів через тривалий час в кожному з них виявляється атоми іншого металу.
Дифузія і броунівський рух – споріднені явища. Взаємопроникнення дотичних речовин один в одного і безладний рух найдрібніших частинок, зважених в рідині або газі, відбуваються унаслідок хаотичного теплового руху молекул.
3) Доказом є виникнення пружних сил при деформації тіл, виникнення сил поверхневого натягу. Сили, діючі між двома молекулами, залежать від відстані між ними. Молекули є складними просторовими структурами, що містять, як позитивні, так і негативні заряди. Якщо відстань між молекулами достатньо велика, то переважають сили міжмолекулярного тяжіння. На малих відстанях переважають сили відштовхування. Залежність результуючої сили F і потенційної енергії Eр взаємодії між молекулами від відстані між їх центрами якісно зображена на рис. 2. При деякій відстані r = r0 сила взаємодії обертається в нуль. Цю відстань умовно можна прийняти за діаметр молекули. Потенційна енергія взаємодії при r = r0 мінімальна. Щоб віддалити одна від одної дві молекули, що знаходяться на відстані r0, потрібно надати їм додаткову енергію E0. Величина E0 називається глибиною потенціальної ями або енергією зв'язку.
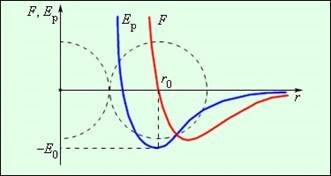
Рис.2.
Сила взаємодії F і потенціальна енергія взаємодії Eр двох молекул. F > 0 – сила відштовхування, F < 0 – сила притягання.
Молекули мають надзвичайно малі розміри. Прості одноатомні молекули мають розмір близько 10-10м. Складні багатоатомні молекули можуть мати розміри в сотні і тисячі раз більше.
Безладний хаотичний рух молекул називається тепловим рухом. Кінетична енергія теплового руху росте із зростанням температури. При низьких температурах середня кінетична енергія молекули може виявитися менше глибини потенційної ями E0. В цьому випадку молекули конденсуються в рідку або тверду речовину; при цьому середня відстань між молекулами буде приблизно рівна r0. При підвищенні температури середня кінетична енергія молекули стає більшою E0, молекули розлітаються, і утворюється газоподібна речовина.
В твердих тілах молекули здійснюють безладні коливання біля фіксованих центрів (положень рівноваги). Ці центри можуть бути розташовані в просторі нерегулярним чином (аморфні тіла) або утворювати впорядковані об'ємні структури (кристалічні тіла)).
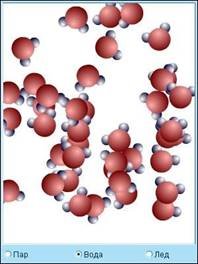 В рідинах молекули мають
значно велику свободу для теплового руху (рис. 3). Вони не прив'язані до певних
центрів і можуть переміщатися по всьому об'єму. Цим пояснюється текучість
рідин. Близько розташовані молекули рідини також можуть утворювати впорядковані
структури, декілька, що містять, молекул. Це явище називається ближнім порядком
на відміну від дальнього порядку, характерного для кристалічних тіл.
В рідинах молекули мають
значно велику свободу для теплового руху (рис. 3). Вони не прив'язані до певних
центрів і можуть переміщатися по всьому об'єму. Цим пояснюється текучість
рідин. Близько розташовані молекули рідини також можуть утворювати впорядковані
структури, декілька, що містять, молекул. Це явище називається ближнім порядком
на відміну від дальнього порядку, характерного для кристалічних тіл.
У газах відстані між молекулами звичайно значно більше їх розмірів. Сили взаємодії між молекулами на таких великих відстанях малі, і кожна молекула рухається вздовж прямої лінії до чергового зіткнення із іншою молекулою або із стінкою посудини. Середня відстань між молекулами повітря за нормальних умов близько 10–8 м, тобто в десятки разів перевищує розмір молекул. Слабка взаємодія між молекулами пояснює
Рис. 3. Характер розташування молекул у воді здатність газів розширятися і заповнювати весь об'єм посудини. В границі, коли
взаємодія прагне нуля, ми приходимо до уявлення про ідеальний газ.
MЕкспериментальні завдання.
 Перед виконанням експериментальних завдань демонструємо
слайд презентації
Перед виконанням експериментальних завдань демонструємо
слайд презентації
(рис. 5).
1.Щоб дістати деяке уявлення про величину сил взаємодії між молекулами, спробуйте розірвати сталеву або капронову нитку з площею поперечного перерізу 1мм2. Мало хто може це зробити, але ж зусиллям усього вашого тіла «протистоять» сили притягання малесеньких молекул у малому Рис. 5. Слайд 3 презентації перерізі нитки!
 2.Якщо
щільно притиснути один до одного свинцеві циліндри з добре зачищеними торцями, вони
внаслідок сил між молекулярного притягання «зчіплюються»
настільки міцно, що до них можна підвісити кілограмову гирю (рис. 4). Цей
дослід також свідчить про наявність сил міжмолекулярного притягання.
2.Якщо
щільно притиснути один до одного свинцеві циліндри з добре зачищеними торцями, вони
внаслідок сил між молекулярного притягання «зчіплюються»
настільки міцно, що до них можна підвісити кілограмову гирю (рис. 4). Цей
дослід також свідчить про наявність сил міжмолекулярного притягання.
3.Дифузія розчину фурациліну у воді.
Якби молекули не притягалися одна до одної, не було б ні рідин, ні твердих тіл – вони просто розсипалися б на окремі молекули. Проте, якби молекули тільки притягалися, вони «злипалися» б у надзвичайно щільні згустки, а молекули газів під час ударів об стінки посудини «прилипали» б до них. Взаємодія молекул має електричну природу. Хоча молекули загалом електрично нейтральні, розподіл позитивних і негативних електричних зарядів у
Рис. 4. Вивчення них такий, що на великих відстанях (порівняно з розмірами взаємодії молекул самих молекул) молекули притягаються, а на малих відстанях – відштовхуються.
. Основна задача МКТ. Параметри газу, пов'язані з індивідуальними характеристиками молекул, які його складають, називають мікроскопічними параметрами (маси молекул, їх швидкості, концентрація).
Параметри, що характеризують стан макроскопічних тіл без урахування їхньої молекулярної будови, називають макроскопічними параметрами (об'єм, тиск, температура).
Співвідношення між макроскопічними параметрами – температурою, об'ємом і тиском – називають рівнянням стану.
Основна задача молекулярно-кінетичної теорії – установити зв'язок між макроскопічними та мікроскопічними параметрами речовини і, виходячи з цього, знайти рівняння стану даної речовини.
Наприклад, знаючи маси молекул, їхні середні швидкості та концентрацію, знайти об'єм, тиск і температуру даної маси газу, а також виразити тиск газу через його об'єм і температуру.
Молекула – найменша стійка частинка речовини, яка зберігає її основні хімічні властивості. Вона складається з атомів однакових або різни х хімічних елементів, наприклад, Н2, NaCl,C6H12O6. Сукупність молекул зберігає фізичні властивості речовини.
Речовина – те, з чого складається фізичне тіло.
Атом – найменша частинка речовини, яка не ділиться при хімічних реакціях, наприклад H, Na, Cl, C, O.
Запитання до учнів у ході викладання нового матеріалу.
1.Перелічіть відомі вам докази існування молекул.
2.Наведіть факти, що показують подільність речовин.
3.У чому полягає явище дифузії?
4.У чому полягає суть броунівського руху?
5.Які досліди доводять, що між молекулами твердих і рідких тіл діють сили притягання й відштовхування?
За допомогою інтерактивної дошки повторюємо і закріплюємо вивчений матеріал
(рис. 6).
Рис. 6. Інтерактивна вправа «Анаграми»
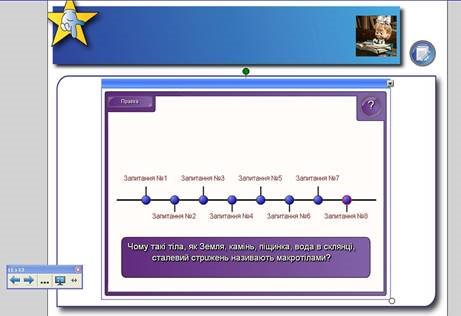
Рис. 7. Інтерактивна вправа «Мозковий штурм»
Задачі, розв'язувані на уроці.
1. Якщо не працює вентиляція, дрібний деревний пил у столярному цеху годинами «висить» у повітрі навіть після вимикання деревообробних верстатів. Чому?
2. Дві скляні пластинки важко відірвати одну від одної, якщо між ними є трохи води. Якщо ж скло сухе, то пластини відокремлюються одна від одної без зусиль. Чому?
3. Чому полірування поверхонь, які дотикаються може призвести не до зменшення тертя, а, навпаки, до збільшення?
До конспекту учня ОК-1
|
Молекулярно-кінетичною теорією називають вчення про будову і властивості речовини на основі уявлення про існування атомів і молекул як якнайменших частинок хімічних речовин. |
|
|
Основні положення МКТ: |
Дослідні підтвердження основних положень МКТ: |
|
1)усі речовини складаються з молекул або інших структурних одиниць (атомів, електронів, іонів), розділених проміжками;
|
фотографії, одержані за допомогою іонного, електронного і тунельного мікроскопів. Про наявність проміжків між молекулами свідчить зміна об'єму твердих тіл і рідини при змінюванні їхньої температури. Розчинення фарби, солі та цукру у воді; поділ, дроблення твердих тіл. Існування граничної площі масляної плівки на поверхні води. |
|
2)частинки речовини перебувають у безперервному хаотичному русі (його часто називають тепловим рухом);
|
Дифузія – це процес перерозподілу концентрації атомів у просторі шляхом хаотичної, тобто теплової міграції. Осмос – одностороння дифузія. Броунівський рух – хаотичний рух завислих рідині або в газі частинок твердого тіла. |
|
3)частинки речовини взаємодіють одна з одною (притягуються і відштовхуються), а рівнодіюча цих сил називається силою молекулярної взаємодії. |
Доказом є виникнення пружних сил при деформації тіл, виникнення сил поверхневого натягу. (Притягання свинцевих циліндрів; злиття двох крапель рідини в одну.) |
|
Основна задача молекулярно-кінетичної теорії – установити зв'язок між макроскопічними та мікроскопічними параметрами речовини і, виходячи з цього, знайти рівняння стану даної речовини. |
|
Це цікаво.
Харчування і дихання – типові дифузійні процеси. У процесі дихання відбувається дифузія кисню О2 і вуглекислого газу СО2 через стінку легеневого пухирця, а значне усмоктування живильних речовин відбувається в тонких кишках, стінки яких спеціально для цього пристосовані. Процес усмоктування живильних речовин у кишечнику можливий завдяки дифузії. У семикласників виникає потреба більше дізнатися про дифузію як фізичне явище, під час вивчення цього поняття, учням доцільно нагадати про явище осмосу, поняття якого вони вивчили під час вивчення природознавства у 6-му класі та запропонувати провести дослідження, виконуючи експериментальне завдання «Морквяний насос» [2; 3, с. 89-92].
Для формування ПІ у учнів до фізики дуже важливо пояснювати МПЗ отриманих знань. Наприклад, факт застосування дифузії в медицині: апарат «штучна нирка». Біля 30 років тому німецький лікар Вільям Кольф застосував апарат «штучна нирка». З тих пір він застосовується для невідкладної швидкої допомоги при гострій інтоксикації; для підготовки хворих із хронічною нирковою недостатністю до трансплантації нирок; для тривалого (10-15 років) життєзабезпечення хворих із хронічним захворюванням нирок.
Отже, використання міжпредметних завдань стимулює увагу учнів, зацікавлює, дає можливість підтвердити нерозривний зв’язок фізики із життєдіяльністю людини, тобто формує стійкий пізнавальний інтерес до фізики як науки.
Домашнє завдання: [4] §39; [1] дослід; [5] Взяти два шматочки скла (або два однакові дзеркальця), вимити, висушити й притиснути одне до одного. Легко чи важко їх роз’єднати? Те саме виконати з мокрим склом. Пояснити результати досліду.
Список використаних джерел
1. Бузько В. Л. Дидактичний матеріал для перевірки знань з фізики. 7 клас : [навч. посіб. для учнів] / В. Л. Бузько, С. П. Величко. – [2-е вид.]. – К. : ТОВ «СІТІПРІНТ», 2013. – 136 с.
2. Бузько В. Л. Інтеграція природничих знань при вивченні поняття дифузії / В. Л. Бузько // Збірник наукових праць Кам’янець-Подільського державного університету. Серія : педагогічна. – 2009. – Вип. 15 : Управління якістю підготовки майбутніх учителів фізики та трудового навчання. – С. 119-122.
3. Бузько В. Л. Развитие познавательного интереса учащихся основной школы к физике путем использования разных видов учебной деятельности / В. Л. Бузько, С. П. Величко // Актуальные проблемы естественных наук и их преподавания (посвященная 100-летию МГУ имени А. А. Кулешова) : междунар. научн.-практ. конф., 20-22 февр. 2013 г. : сборник материалов. – Могилев, 2013. – С. 89-92.
4. Коршак Є. В. Фізика : 10 кл. : [підруч. для загальноосвіт. навч. закл. : рівень стандарту] / Є. В. Коршак, О. І. Ляшенко, В. Ф. Савченко. – К. : «Генеза», 2010. – 192 с. 5. Туманцова О. О. Фізика. 10 клас. Рівень стандарту: Розробки уроків /
О. О. Туманцова. – Х.: «Ранок», 2010. – 320 с.
6. Уроки фізики у 10 класі. Молекулярна фізика і термодинаміка / Руденко А. В., упорядник. – Х.: Вид. група «Основа», 2010. –139 с. – (Б-ка журн. «Фізика в школах України». Вип. 11 (83)).
7. Щербина Т. Чому? Цікаві питання з фізики.10 клас / Т. Щербина. – К. : Ред.
загальнопед. газ., 2003. – 128 с. – (Бібліотека «Шкільного світу»).


про публікацію авторської розробки
Додати розробку
