Урок №2. Маса і розміри молекул. Кількість речовини. Число Авагадро. Молярна маса (конспект)
Урок №2. Маса і розміри молекул. Кількість речовини. Число Авагадро. Молярна маса
Мета:познайомити учнів з величинами, що характеризують молекули (порядок розмірів і маси, кількість речовини, стала Авогадро), і методами їх вимірювання.
Тип уроку: Урок вивчення нового матеріалу.
Обладнання: фотографії молекул; комп'ютер, інтерактивна дошка, програмне забезпечення SMART Notebook, презнтація (електронний додаток ППЗ «Фізика 10. Основи МКТ»).
Демонстрації:
1. Фотографії молекул.
2. ОК-2.
Урок №2. Маса і розміри молекул. Кількість речовини. Число
Авагадро. Молярна маса
Мета: познайомити учнів з величинами, що характеризують молекули (порядок розмірів і маси, кількість речовини, стала Авогадро), і методами їх вимірювання.
Тип уроку: Урок вивчення нового матеріалу.
Обладнання: фотографії молекул; комп’ютер, інтерактивна дошка, програмне забезпечення SMART Notebook, презнтація (електронний додаток ППЗ «Фізика 10.
Основи МКТ»).
Демонстрації:
1. Фотографії молекул.
2. ОК-2.
План викладення нового матеріалу.
1. Оцінка розмірів молекули.
2. Кількість речовини.
3. Відносна молекулярна маса.
4. Молярна маса.
5. Стала Авогадро.
МПЗ: хімія, математика.
Пллан.
|
Етапи уроку |
Методи й форми роботи з класом |
|
I. Організаційний етап. |
Якісні запитання. |
|
II. Перевірка домашнього завдання. |
Фронтальне опитування. |
|
III. Повідомлення теми, мети й завдань уроку; мотивація навчальної діяльності учнів. |
Бесіда |
|
IV. Вивчення нового матеріалу. |
Розв’язування задач. Тест (Flash Movie) 10 запитань. |
|
V . Застосування набутих знань. |
Гра «Запитання від Незнайки» (SMART Notebook) |
|
VI. Підведення підсумків уроку та повідомлення домашнього завдання. |
Коментар учителя. |
Актуалізація опорних знань, умінь і навичок учнів.
Фронтальне опитування.
1. Сформулюйте основні положення МКТ.
2. Що є найнаочнішим експериментальним підтвердженням існування молекул?
3. У чому відмінність дифузії та броунівського руху?
4. Наведіть приклади фактів застосування дифузії в природі, діяльності людини.
Викладання нового матеріалу.
.Оцінка розмірів молекул. Приблизну оцінку розмірів молекул можна дістати з дослідів, проведених німецьким фізиком В. Рентгеном і англійським фізиком Д. Релеєм. Якщо капнути на поверхню води крапельку олії, то вона розпливеться, утворивши тонку плівку завтовшки усього лише в одну молекулу. Товщину цього шару неважко визначити, а отже, оцінити розміри молекули олії. У цей час існує низка методів, які дозволяють визначити розміри молекул і атомів. Наприклад, лінійні розміри молекул кисню становлять 3·10-10м, води – приблизно 2,6·10-10м. Таким чином, характерною довжиною у світі молекул є розмір 10-10м. Корисно не тільки запам'ятати цей параметр (10-10м), але й образно уявити його собі. Це допоможе нам «увійти» у світ молекул. Легко перевірити, що якщо молекулу води збільшити до розмірів яблука, то саме яблуко стане розміром із земну кулю.
|
|
Капля олеїнової кислоти в басейні, 0,5% розчин олеїнової кислоти в спиртіðПлямаðрозмір 1 молекули. ðòспирт випаровується і молекули зближуються. |
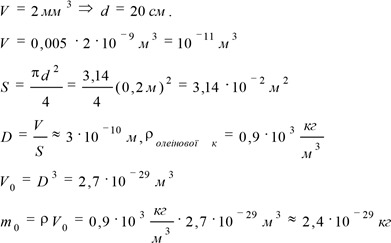
m0(Н2)=3,34·10-27кг, m0(О2)=5,32·10-26кг, m0(С2)=7,3·10-26кг.
. Кількість речовини. У минулому столітті італійський учений Авогадро виявив дивний факт: якщо два різних гази займають посудини однакового об'єму за однакових температур і тисків, то в кожній посудині міститься одне й те саме число молекул. Зауважимо, що маси газів при цьому можуть відрізнятися дуже сильно: наприклад, якщо в одній посудині водень, а в іншій – кисень, маса кисню в 16 разів більша від маси водню.
Це означає, що деякі, причому досить важливі, властивості тіла визначаються кількістю молекул у цьому тілі: кількість молекул виявляється навіть важливішою, ніж маса.
@Фізичну величину, що визначає кількість молекул у даному тілі, називають кількістю речовини й позначають буквою v. (Ввели у 1971р. Парижі.)
Оскільки маси окремих молекул відрізняються одна від одної, то однакові кількості різних речовин мають різну масу. Наприклад, 1025 молекул водню й 1025 молекул кисню вважають однаковою кількістю речовини, хоча вони мають різні маси (33,45 і 531,45г відповідно). Таким чином, маса не є мірою кількості речовини. Одиницею кількості речовини є моль:
@Один моль – це кількість речовини, що містить стільки ж молекул, скільки атомів Карбону міститься в 12г вуглецю.
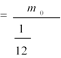
. Відносна молекулярна маса. Маси окремих молекул дуже малі. Наприклад, маса однієї молекули води дорівнює близько 2,7·10-26кг. Молекули інших речовин мають маси такого ж порядку. Оскільки маси молекул дуже малі, зручно використовувати в обчисленнях не абсолютні значення мас, а відносні. За міжнародною угодою маси всіх атомів і молекул порівнюють з 1/12 маси атома Карбону. Головна причина такого вибору полягає в тому, що Карбон входить до складу багатьох різних хімічних сполук.
За одиницю маси атомів і молекул приймається 1/12 маси атома ізотопу вуглецю С12 (із масовим числом 12). Вона називається атомною одиницею маси (а. е. м.):
1 а. е. м. = 1,66·10–27 кг.
Ця величина майже співпадає із масою протона або нейтрона. Відношення маси атома або молекули даної речовини до 1/12 маси атома вуглецю С12 називається відносною масою.
@Відносна молекулярна маса речовини МГ дорівнює відношенню маси молекули т0 даної речовини до 1/12 маси атома Карбону m0С:
M r
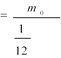 m0C
m0C
Аналогічно до відносної молекулярної маси визначається й відносна атомна маса як відношення маси атома даної речовини до 1/12 маси атома Карбону.
Отже, зручність вибору моля як одиниці вимірювання кількості речовини пов'язана з тим, що маса одного моля речовини в грамах чисельно дорівнює його відносній молекулярній масі.
![]() . Молярна маса. Маса т тіла пропорційна кількості
речовини v, що міститься в m даному тілі. Тому відношення - характеризує речовину, з якої
складається це тіло: чим «важчі» молекули речовини, тим більше це відношення.
. Молярна маса. Маса т тіла пропорційна кількості
речовини v, що міститься в m даному тілі. Тому відношення - характеризує речовину, з якої
складається це тіло: чим «важчі» молекули речовини, тим більше це відношення.
@Відношення маси речовини т до кількості речовини v називають молярною масою й позначають М:
M ![]() .
.
Якщо прийняти в цій формулі v=1, дістанемо, що молярна маса речовини чисельно дорівнює масі одного моля цієї речовини. кг
Наприклад, молярна маса водню дорівнює
М=2г/моль=2·10-3 ![]() моль . Одиницею
вимірювання молярної маси в СІ є кг/моль, оскільки маса виміряється в
кілограмах, а кількість речовини - у молях. Якщо молярна маса М і кількість
речовини v відомі, можна знайти масу речовини: m
моль . Одиницею
вимірювання молярної маси в СІ є кг/моль, оскільки маса виміряється в
кілограмах, а кількість речовини - у молях. Якщо молярна маса М і кількість
речовини v відомі, можна знайти масу речовини: m![]() M .
M .
. Стала Авогадро. Число N молекул, які містяться в
тілі, також пропорційне кількості речовини v, що міститься в цьому тілі.
Коефіцієнт пропорційності є сталою величиною; його називають сталою Авогадро й
позначають NА: N A ![]() .
.
Звідси випливає, що стала Авогадро чисельно дорівнює кількості молекул в 1 моль.
Стала Авогадро була виміряна багатьма способами. У результаті було здобуте
1
значення NА=6,02·1023 ![]() моль
. У наближених обчисленнях зазвичай приймають
моль
. У наближених обчисленнях зазвичай приймають
NА=6·1023моль-1. Якщо
кількість речовини v у даному тілі відома, легко знайти число молекул N
у цьому тілі: N ![]() N A .
N A .
Значення сталої Авогадро дозволяє знайти масу однієї молекули. Справді, нехай дане тіло містить 1 моль речовини. Тоді маса тіла чисельно дорівнює М, а кількість молекул у ньому чисельно дорівнює NА. Позначаючи масу однієї молекули m0,
M ![]() дістаємо: m0.
дістаємо: m0.
N A
NА – «місток» між макросвітом(світом оточуючих нас тіл) і мікросвітом (світом атомів і молекул).
Якщо дане тіло містить v молів речовини, то число молекул N у цьому тілі
![]() m
m
N A N A .
M
Відношення числа молекул N до об'єму V, який займають ці молекули, називають
![]() N концентрацією молекул і позначають n: n. V
N концентрацією молекул і позначають n: n. V
Одиниця вимірювання концентрації молекул – 1/м3.
Запитання до учнів у ході викладання нового матеріалу.
1.Якою є відносна атомна маса Оксигену? Відносна молекулярна маса кисню? Води? Вуглекислого газу?
2.Виразіть у кілограмах на моль молярну масу води, кисню й вуглекислого газу. Гра «Запитання від Незнайки».
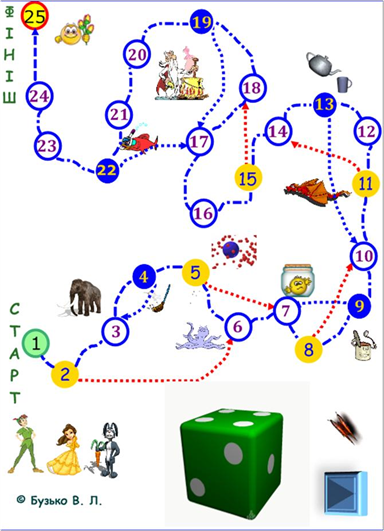 На слайді (рис. 8) представлено
ігрове поле з ілюстраціями, що зображають маршрут гравців Фізичною
країною. Учасники гри (команда або індивідуальні гравці) поспішають до фінішу.
На шляху вони зустрічають багато труднощів і перешкод у вигляді запитань, зміст
яких треба пояснити. Подолати їх допомагає знання
фізики.
На слайді (рис. 8) представлено
ігрове поле з ілюстраціями, що зображають маршрут гравців Фізичною
країною. Учасники гри (команда або індивідуальні гравці) поспішають до фінішу.
На шляху вони зустрічають багато труднощів і перешкод у вигляді запитань, зміст
яких треба пояснити. Подолати їх допомагає знання
фізики.
Як фішки гравці використовують зображення під картою: Пітера Пена, Принцеси, Зайця. Представники команд по черзі «кидають» інтерактивний кубик і пересувають відповідну фішку у відповідності з кількістю позначок на кубику. Якщо фішка потрапила на синій або жовтий кружок, то гравці команди повинні дати відповіді на поставлені запитання (перехід за гіперсилкою). Якщо пояснення вірне, то гравці жовтого кружка пересувають фішку вперед за напрямком стрілки, а гравці синього кружка
Рис. 8. Інтерактивна гра-подорож «Запитання від залишаються на місці. При
Незнайки» неправильній відповіді фішка залишається на місці, якщо
знаходилася на жовтому кружку, або йде назад уздовж стрілки, якщо вона знаходилася на синьому кружку. Виграє та команда, яка перша прийшла до фінішу (рис. 9,а,б). Запитання.
1. Чому нагрівання чи охолодження тіл, плавлення чи випаровування називають тепловими явищами?
– Тому що ці явища повязані зі зміною температури тіл
2. Чи варто під час ремонту школи однаково старанно покривати лаком або воском паркетну підлогу і класну дошку?
– Покривати лаком дошку не можна, бо на такій дошці крейда не лишатиме сліду.
3. Чому процес засолювання огірків чи капусти досить тривалий? Чи можна його прискорити?
– Сіль крізь товсті стінки клітин дифундує досить повільно. Щоб прискорити процес, можна підвищити температуру розсолу, або, не подрібнюючи овочів, зробити в їх стінках дуже вузькі отвори.
4. У косому промінні Сонця в запиленому приміщенні неозброєнним оком добре видно хаотичний рух пилу. Чи можна вважати цей рух прикладом броунівського руху?
– Ні, не можна: пилинки мають дуже великі розміри і їх рух визначає сила тяжіння та конвективні течії повітря.
5. Чи може молекула речовини складатись з 1/2 атома? – Ні.
6. Чому, якщо молекули перебувають на відстанях, які перевищують їх розміри в кілька разів, то сили взаємодії практично не виникають?
– Тому що сили, які виникають між електрично нейтральними молекулами, є короткодіючими.
7. Чому молекули не проникають одна в одну, а шматки речовини ніколи не стискуються до розмірів однієї молекули?
– Тому що на дуже малих відстанях між молекулами діють сили відштовхування.
Чому існує атмосфера Землі, якщо газ має здатність до необмеженого розширення?
Тому що на газ діє сила тяжіння Землі, яка і втримує молекули повітря біля її поверхні.
Чому безладний рух молекул називають «тепловим рухом»?
Тому що він повязаний зі зміною температури тіл.

Рис. 9, а. Запитання
Задачі, розв'язувані на уроці.
1.Скільки молів міститься в 4г водню?
2.Якою є маса 10моль води?
3.Яка маса молекули водню?
4.Яким є об'єм, який займають 4моль алюмінію?
Розв'язання: Об'єм алюмінію можна виразити через
його масу й густину: V ![]() .
.
Масу ж алюмінію можна виразити через кількість речовини й
молярну масу: m![]() M . Звідси дістаємо: V
M . Звідси дістаємо: V ![]() . Відповідь: 40см3.
. Відповідь: 40см3.
До конспекту учня ОК-2
|
Фізичну величину, що визначає кількість молекул у даному тілі, називають кількістю речовини й позначають буквою v. |
|
|
Один моль – це кількість речовини, що містить стільки ж молекул, скільки атомів Карбону міститься в 12г вуглецю. |
|
|
Атомна одиниця маси (а. о. м.): 1 а. е. м. = 1,66·10–27 кг |
|
|
Відносна молекулярна маса речовини МГ дорівнює відношенню маси молекули т0 даної речовини до 1/12 маси атома Карбону m0С: |
M r
|
|
Відношення маси речовини т до кількості речовини v називають молярною масою й позначають М: |
M |
|
Молярна маса: |
M |
|
маса: |
m |
|
Кількість речовини: |
M N A |
|
Кількість молекул: |
N A N A M |
|
Концентрація молекул: Відношення числа молекул N до об'єму V, який займають ці молекули (позначають n): |
N
V |
Домашнє завдання: [1]§40.
Визначити масу молекул кисню О2, метану СН4, сірководню Н2S. Обчислити молярні маси кисню О2, метану СН4, сірководню Н2S.
Список використаних джерел
1. Коршак Є. В. Фізика : 10 кл. : [підруч. для загальноосвіт. навч. закл. : рівень стандарту] / Є. В. Коршак, О. І. Ляшенко, В. Ф. Савченко. – К. : «Генеза», 2010. – 192 с. 2. Туманцова О. О. Фізика. 10 клас. Рівень стандарту: Розробки уроків /
О. О. Туманцова. – Х.: «Ранок», 2010. – 320 с.
3. Уроки фізики у 10 класі. Молекулярна фізика і термодинаміка / Руденко А. В., упорядник. – Х.: Вид. група «Основа», 2010. –139 с. – (Б-ка журн. «Фізика в школах України». Вип. 11 (83)).
4. Щербина Т. Чому? Цікаві питання з фізики.10 клас / Т. Щербина. – К. : Ред.
загальнопед. газ., 2003. – 128 с. – (Бібліотека «Шкільного світу»).

про публікацію авторської розробки
Додати розробку