Урок 11 клас Будова атома. Дослід Резерфорда.
Розробка уроку буде корисною не лише для роботи в 11 класі, а й для роботи у 9 класі за новою програмою. Урок є однією із форм по створенню проектів. Остані використовується, як прийом залучення до активної розумової діяльності груп учнів, Дає можливість опрацювання великого обсягу теоретичного матеріалу. Використано ряд проийомів по створенню умов для командної роботи. Передбачено проведення рефлексії.Уроки-проекти є емоційно забарвленими, яскравими, викликають багато позитивної енергетики. Дитина відчуває себе лідером, творцем, це підвищує її самооцінку. Методика дає можливість залучати до роботи як сильних, так і слабких учнів. Формування відповіді, складання опорного конспекту дає можливість глибоко аналізувати теоретичний матеріал, знаходити взаємозв'язки, асоціації, які втілюються в художньому відображенні проекту. При виконанні поставленого завдання відбувається згуртування учнів навколо спільної діяльності, формується навичка командної роботи, яка до речі є однією з вимог сучасності, але найголовнішим залишається те, що ці уроки подобаються дітям.
Клас 11
Тема : Будова атома. Дослід Резерфорда
Мета: Формувати в учнів знання про теорії будови атома та атомного ядра, досліди та відкриття Резерфорда; розвивати логічне мислення, науковий світогляд, навички творчо-дослідницької роботи; виховувати почуття колективізму, відповідальне ставлення до уроку, зацікавленість фізикою та технікою, старанність, охайність.
Тип: Засвоєння нових знань.
Форма проведення: Урок-проект.
Обладнання і посібники: роздаткові картки з теоретичним матеріалом, схеми дослідів, ватман, кольорові олівці, кольоровий папір, клей, маркери заготовка шкали, опитувальник, стікери.
Хід уроку:
1. Організаційна частина.
2. Активізація пізнавальної діяльності учнів. Пропоную учням назвати слова асоціації до словосполучення «будова атома».

3. Мотивація навчальної діяльності. Отже, ви дійсно багато знаєте з даної теми. Але на сьогоднішньому уроці більш детально познайомимось із історією даного питання, а при вивченні подальших тем дізнаємося більш глибоко й про ті поняття, які ви сьогодні називали. Тема нашого уроку: «Будова атома. Дослід Резерфорда». Як відомо поняття атома як неподільної частинки було введено давньогрецьким філософом ще до нашої ери. Багато сторіч дана теорія вважалась істинною аж поки... А що сталося потім, ми дізнаємось на сьогоднішньому уроці.
4. Організаційний момент. Об’єднання в групи, розподіл завдань та обов’язків, визначення назви групи.
5. Вивчення нового матеріалу. Кожна група працює самостійно над матеріалом.
Запропонований матеріал:
І група: Модель атома Томсона

 Вчені не відразу прийшли до правильних уявлень про будову атома. Першу модель атома запропонував англійський фізик. Сер Джозеф Джон Томсон (18 грудня 1856 30 серпня 1940) англійський фізик, який відкрив електрон, лауреат Нобелівської премії по фізиці 1906 р. На думку Томсона, позитивний заряд атома займає весь об’єм атома й розподілений у цьому об’ємі зі сталою густиною. Найпростіший атом – атом водню – це позитивно заряджена куля радіусом близько 10-7см, у якій знаходиться електрон. У складніших атомів у позитивно зарядженій кулі є кілька електронів, так що атом подібний до кексу з родзинками, у якому родзинками є електрони.
Вчені не відразу прийшли до правильних уявлень про будову атома. Першу модель атома запропонував англійський фізик. Сер Джозеф Джон Томсон (18 грудня 1856 30 серпня 1940) англійський фізик, який відкрив електрон, лауреат Нобелівської премії по фізиці 1906 р. На думку Томсона, позитивний заряд атома займає весь об’єм атома й розподілений у цьому об’ємі зі сталою густиною. Найпростіший атом – атом водню – це позитивно заряджена куля радіусом близько 10-7см, у якій знаходиться електрон. У складніших атомів у позитивно зарядженій кулі є кілька електронів, так що атом подібний до кексу з родзинками, у якому родзинками є електрони.
![]()
![]()
![]() Проте модель атома Томсона не узгоджувалась дослідами з вивчення розподілу позитивного заряду в атомі. Ці досліди, уперше поставлені англійським фізиком Е.Резерфордом, мали велике значення для розуміння будови атома.
Проте модель атома Томсона не узгоджувалась дослідами з вивчення розподілу позитивного заряду в атомі. Ці досліди, уперше поставлені англійським фізиком Е.Резерфордом, мали велике значення для розуміння будови атома.
П група: Досліди Е. Резерфорда.
 Маса електронів у кілька тисяч разів менша від маси атомів. Оскільки в цілому атом нейтральний, то основна маса атома припадає на його позитивно заряджену частину.
Маса електронів у кілька тисяч разів менша від маси атомів. Оскільки в цілому атом нейтральний, то основна маса атома припадає на його позитивно заряджену частину.
Ернест Резерфорд (30 серпня 1871 19 жовтня 1937) британський фізик новозеландського походження. Відомий як «батько» ядерної фізики. Лауреат Нобелівської премії з хімії 1908 р.
Щоб експериментально дослідити розподіл позитивного заряду, а отже, і маси в атомі, Е. Резерфорд запропонував у 1906 р. застосувати зондування атома за допомогою α-частинок. Ці частинки виникають під час розпаду радію та деяких інших елементів. Їх маса приблизно у 8000 раз більша від маси електрона, а позитивний заряд за модулем дорівнює подвоєному заряду електрона. Це не що інше, як цілком іонізовані атоми гелію. Швидкість а-частинок дуже велика: вона дорівнює 1/15 швидкості світла.
Цими частинками Резерфорд бомбардував атоми важких елементів. Електрон має малу масу і тому не може помітно змінити траєкторію а-частинки, подібно до того, як камінчик у кілька десятків грамів, зіткнувшись з автомобілем, не може помітно змінити його швидкість.
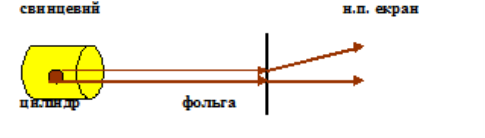
Альфа-частинки можуть розсіюватися (змінювати напрям руху) лише під дією позитивно зарядженої частини атома. Отже, за розсіюванням а-частинок можна визначити характер розподілу позитивного заряду й маси в атомі. Схему дослідів Резерфорда показано на малюнку.
Радіоактивний препарат, наприклад радій, вміщували в свинцевий циліндр Ц, уздовж якого було просвердлено вузький канал. Пучок α-частинок з каналу потрапляє на тонку фольгу Ф з досліджуваного матеріалу (золото, мідь та ін.). Після розсіювання α-частинки потрапляли на напівпрозорий екран Е, вкритий сульфідом цинку. Зіткнення кожної частинки з екраном супроводжувалося спалахом світла (сцинтиляцією), який можна було спостерігати в мікроскоп М. У весь прилад містився в посудині, з якої було відкачане повітря.
Коли в приладі був вакуум і не було фольги, то на екрані виникав світлий кружок, що утворювався від сцинтиляцій, збуджених тонким пучком α -частинок. А коли на шляху пучка ставили фольгу, то α-частинки внаслідок розсіювання розподілялися на екрані по кружку більшої площі.
Ш група: Дослід Е. Резерфорда
Модифікуючи експериментальну установку, Е. Резерфорд спробував виявити відхилення α-частинок на великі кути. І цілком несподівано виявилося, що невелика кількість α-частинок (приблизно одна з двох тисяч) відхилялась на кути, більші від 90 градусів. Пізніше Резерфорд зізнався, що, запропонувавши своїм учням експеримент – спостереження розсіювання а-частинок на великі кути, сам не вірив у позитивний результат. «Це майже так само неймовірно, говорив Резерфорд, ніби ви вистрелили 15-дюймовим снарядом у клапоть тонкого паперу, а снаряд повернувся б до вас і вдарив вас».
І справді, передбачити цей результат було на основі моделі Томсона неможливо. Розподілений у всьому об’ємі атома позитивний заряд не може створити таке інтенсивне електричне поле, яке могло б відкинути а-частинку назад. Максимальна сила відштовхування визначається законом Кулона:
|q1||q2|
F = k —————.
r2
Де q заряд α-частинки, q позитивний заряд атома, R його радіус, F електрична сила. Напруженість електричного поля рівномірно зарядженої сфери максимальна на її поверхні й спадає до нуля з наближенням до центра сфери. Тому, чим менший радіус R, тим більша сила, що відштовхує α-частинки.
ІV група: Визначення розмірів атомного ядра
Резерфорд зрозумів, що α-частинка відкидається назад тільки тоді, коли позитивний заряд атома і його маса сконцентровані в дуже малій частині простору. Так Резерфорд прийшов до ідеї атомного ядра – тіла малих розмірів, у якому сконцентровані майже вся маса й увесь позитивний заряд атома.
На малюнку показано траєкторії α-частинок, що пролітають на різних відстанях від ядра.
Підраховуючи кількість α-частинок, розсіяних на різні кути. Резерфорд зміг визначити розміри ядра. Виявилося, що ядро має діаметр порядку 10-12 10-13см (у різних ядер різні діаметри). Розмір же самого атома 10-8см, тобто в 10-100тис. раз більший від розмірів ядра. Згодом удалося встановити й заряд ядра. Якщо заряд електрона взяти за одиницю, то заряд ядра точно дорівнює порядковому номеру даного хімічного елемента в періодичній системі Д.І. Менделєєва.

V група: Планетарна модель атома
З дослідів Резерфорда безпосередньо випливає планетарна модель атома. У центрі міститься позитивно заряджене ядро, у якому зосереджена майже вся маса. У цілому атом нейтральний, тому кількість внутрішньоатомних електронів дорівнює, як і заряд ядра, порядковому номеру елемента в періодичній системі. Зрозуміло, що електрони в атомі не можуть бути в стані спокою, бо вони впали б на ядро. Вони рухаються навколо ядра, подібно до того, як планети обертаються навколо Сонця. Цей рух відбувається під впливом кулонівської сили, з якою діє ядро.
В атомі водню навколо ядра обертається лише один електрон. Ядро атома водню має позитивний заряд, який за модулем дорівнює заряду електрона, і масу, приблизно в 1836,1 рази більшу від маси електрона. Це ядро дістало назву протона, і його почали розглядати як елементарну частину. Розмір атома – це радіус орбіти його електрона.
Проста й наочна планетарна модель атома має пряме експериментальне обґрунтування. Вона конче потрібна для пояснення дослідів на розсіювання α-частинок. Але ця модель зовсім не може пояснити сам факт існування атома, його стійкість. Адже електрони рухаються по орбітах з прискоренням, і не малим. Заряд, який рухається з прискоренням, за законами електродинаміки Максвела має випромінювати електромагнітні хвилі з частотою, що дорівнює частоті його обертання навколо ядра. Випромінювання супроводжується втратою енергії. Втрачаючи енергію, електрони мають наближатися до ядра, подібно до того, як супутник наближається до Землі внаслідок гальмування у верхніх шарах атмосфери. Як показують точні розрахунки, що ґрунтуються на механіці Ньютона й електродинаміці Максвела, електрон за інтервал часу порядку 10-8 секунди має впасти на ядро. Атом має припинити своє існування.
Насправді нічого подібного не відбувається. Атоми стійкі і в не збудженому стані можуть існувати необмежено довго, зовсім не випромінюючи електромагнітних хвиль.
Висновок про неминучу загибель атома внаслідок втрати енергії на випромінювання не узгоджувався з дослідом і був результатом застосування законів класичної фізики до явищ, які відбуваються в атомі. Звідси виходить, що до явищ атомних масштабів закони класичної фізики незастосовні.
Резерфорд створив планетарну модель атома: електрони обертаються навколо ядра подібно до того, як планети обертаються навколо Сонця. Ця модель проста, обґрунтована експериментально, але не пояснює стійкості атома.
6. Захист проектів. Виступ учнів по запропонованій темі, запитання інших груп, тощо. Наприклад, проект І групи, тощо.


7. Закріплення вивченого матеріалу проходить у вигляді запитань і відповідей між групами.
8. Підсумок (обговорення та виставлення оцінок). Отже, на сьогоднішньому уроці ви дізналися про розвиток науки щодо вивчення атома, який протягом багатьох віків вважався найдрібнішим.
Для того, щоб я могла дізнатися про ваші враження від уроку прошу надіслати мені телеграму, а я вам у відповідь надішлю телеграму із вашими оцінками (кожен учень виходить до дошки й прикріплює на спеціально приготовлене місце заздалегідь розданий стікер із своїми враженнями, паралельно озвучуючи їх).
9. Домашнє завдання. Опрацювати §___, підібрати цікаві дані з біографій учених.


про публікацію авторської розробки
Додати розробку
