Урок 61.Електричний струм в електролітах. Закон Фарадея для електролізу. (Урок)
8 клас
Урок 61
Електричний струм в електролітах.
Закон Фарадея для електролізу.
Мета уроку:
навчальна:
- поглибити поняття електролітичної дисоціації;
- сформувати знання учнів про природу струму в розчинах і розплавах електролітів на основі електронних уявлень,використовуючи міжпредметні зв’язки з хімією;
- з’ясувати фізичний зміст законів електролізу Фарадея, поняття електрохімічного еквіваленту речовини;
- навчити користуватися формулою для закону Фарадея під час розв’язування задач, розуміти фізичний зміст електрохімічного еквіваленту речовини;
розвивальна:
- розвивати в учнів уміння і наполегливість у розв’язанні поставленої проблеми, у досягненні поставлених завдань;
- розвивати логічне мислення учнів, вміння аналізувати;
виховна:
- виховувати в учнів старанність, самостійність,відповідальність і наполегливість у навчанні
Тип уроку: комбінований
Обладнання: фільтрувальний папір, скляна пластинка, склянка з водним розчином сульфату міді (CuSO4); склянка з дистильованою водою, батарейка, дріт,лампочка від ліхтарика,цукор, кухонна сіль, мідні електроди; джерело постійного струму; секундомір або годинник з секундною стрілкою; ключ; з’єднувальні провідники; таблиця електрохімічних еквівалентів різних речовин.
Чим більше в мене роботи,
Тим більше я навчаюся
/М. Фарадей/
Хід уроку
І. Організаційний момент
Психологічна вправа «Програмування себе на успіх»
Напевно, кожен із вас відчував, яке то щастя, коли все вдається. Тоді ви відчуваєте за спиною крила, а в тілі надзвичайну легкість.
Спробуйте згадати те надзвичайне відчуття польоту, нехай ваше тіло зазвучить мелодією – і успіх вам забезпечений!
І обов’язкова умова – ніколи не втрачайте надії!
ІІ. Актуалізація опорних знань
- Електричним струмом називають…..
- Електричний струм у металах створюють…
- Розчини хімічних речовин проводять електричний струм, якщо речовина…
- Електролітична дисоціація – це…
- Атом складається з….
- Позитивний йон –це…
- Негативний йон – це…
- Які речовини називають провідниками?
- Які частинки створюють струм у металах?
- Як ці частинки рухаються за відсутності електричного поля?
- Як створюється електричний опір металевого провідника й від чого він залежить?
- Чи під час проходження струму в металевих провідниках вільні електрони беруть участь у хаотичному русі?
- Чи залежить опір металевого провідника від температури? Яка це залежність?
ІІІ. Мотивація навчальної діяльності
- Чи всі рідини проводять струм?
- Як ви вважаєте, чи світитиметься лампочка, ввімкнена в електричне коло, якщо електроди опустити в дистильовану воду ?
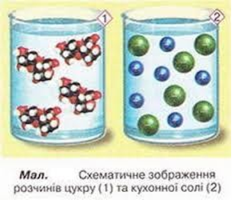
Дослід 1. На електроди намотуємо кінці мідних провідників (2-3 витки), які потім опускаємо в склянку з дистильованою водою. Складаємо електричне коло. Лампочка не світиться. Електричного струму немає. Додаємо у воду цукор – результат від’ємний.
Отже, дистильована вода не проводить електричного струму. Дистильована вода – діелектрик, тому що в ній майже немає вільних заряджених частинок.
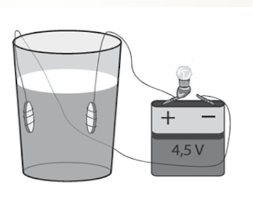
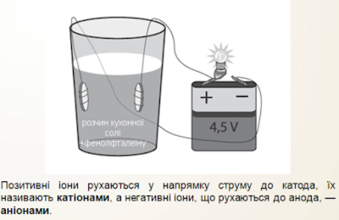
Візьмемо другу склянку з дистильованою водою і додамо у неї кілька крапель кислоти або кухонної солі. Лампочка починає світитися, а навколо електродів піднімаються бульбашки газів. Причому її яскравість збільшується, по мірі додавання кухонної солі, тобто провідність розчину залежить від його концентрації .
Отже, розчин кухонної солі у воді – провідник.
- Як з’явились заряджені частинки ?
Молекула води полярна, тобто її можна уявляти об’єктом видовженої форми, на кінцях якого зосереджені електричні заряди протилежних знаків.
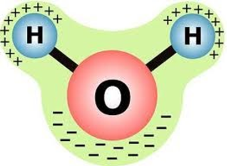
Відтак електричне поле молекул води сприяє розпаду йонних кристалічних ґраток на вільні йони.
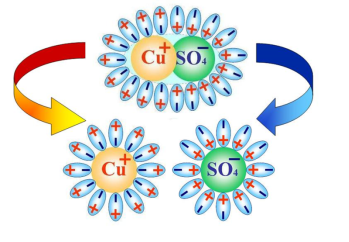
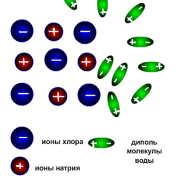
Молекули багатьох речовин (наприклад, солей) являють собою позитивні і негативні йони, з’єднані в одне ціле силою електричного притягання. Так, макромолекула кухонної солі (NaCl ) складається з позитивних йонів натрію(Na+) і Хлору (Cl- ) , макромолекула купрум сульфату (CuSO4 ) - з позитивних йонів Купруму (Cu2+ ) і негативних йонів сульфату(SO4)2- . Якщо ці речовини розчинити, наприклад, у воді, то притягання між йонами стане набагато слабшим і молекули речовини можуть розпастися на окремі йони.
Лампочка засвітилася, значить у розчині з’явились заряджені частинки
Дослід 2.
Фільтрувальний папір просочуємо розчином кухонної солі і закріплюємо на скляній пластинці. Зверху на неї кладемо дві такі ж смужки паперу, просочені відповідно мідним купоросом і розчином двохромовокислого калію і з’єднані: перша з позитивним полюсом джерела струму, а друга – з негативним. Спостерігаємо появу біля катода жовтої смуги, а біля анода – синьої.
ІV. Вивчення нового матеріалу
Рідини за своїми властивостями діляться на провідники і діелектрики.
Речовини, водні розчини або розплави яких є провідниками , називаються електролітами.
1. Електролітична дисоціація.
Як відомо, провідниками електричного струму можуть бути не тільки тверді тіла, але й рідини. Досліди показують, що електроліти (розчини солей, кислот і лугів у воді) є гарними провідниками електричного струму.
Процес розпаду молекул розчиненої речовини на іони під дією розчинника називається електролітичною дисоціацією.
Молекули речовин, що розчиняються, складаються із взаємозв'язаних іонів протилежних знаків (наприклад Na+Cl-, Н+ Cl-, К+ Cl-, Сu++SO4--). Сили тяжіння між іонами забезпечують цілісність таких молекул. Взаємодія цих молекул із полярними молекулами розчинника, наприклад води, приводить до послаблення взаємного тяжіння протилежно заряджених іонів. Із збільшенням температури ступінь дисоціації зростає, і, отже, збільшується концентрація позитивно й негативно заряджених іонів.
У розчині може відбуватися також і процес, що називають рекомбінацією.
Рекомбінація — процес об’єднання іонів у нейтральні молекули.
Між процесами електролітичної дисоціації й рекомбінації іонів за незмінних умов встановлюється динамічна рівновага, коли число молекул, що розпадаються на іони в одиницю часу, дорівнює числу пар іонів, які за цей час об'єднуються в нейтральні молекули.
Процес дисоціації молекули мідного купоросу (CuSO4)
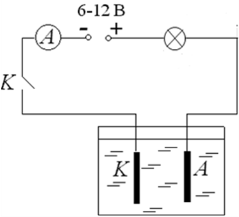
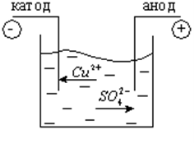
Іони в електролітах рухаються хаотично до тих пір, поки в рідину не опускаються електроди (катод і анод). Тоді на хаотичний рух іонів накладається їх впорядкований рух до відповідних електродів і в рідині виникає електричний струм
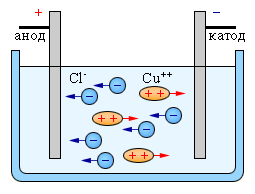
Електрод, з’єднаний з позитивним полюсом джерела струму, називають анодом. Електрод, з’єднаний з негативним полюсом джерела струму, називають катодом.
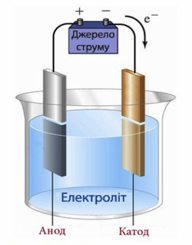

Електроди.
Носіями електричного струму у розчинах і розплавах електролітів є позитивні та негативні йони.
Під час проходження струму через електроліти позитивні йони рухаються до негативного електрода - катода, тому їх називають катіонами; негативні йони рухаються до позитивного електрода - анода, і їх відповідно називають аніонами.
При підвищенні температури кількість вільних йонів електроліту збільшується, тому опір - зменшується і навпаки.
2. Електроліз.
За іонної провідності проходження струму пов’язане з перенесенням речовини. На електродах відбувається виділення речовин, що входять до складу електролітів.
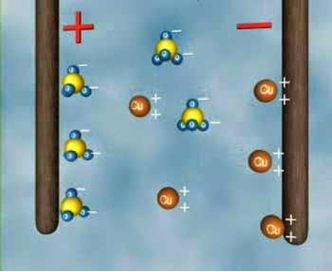
Процес виділення речовини на електродах під час проходження електричного струму через електроліт називається електролізом.
На аноді негативно заряджені іони віддають свої зайві електрони (в хімії цей процес називається окисною реакцією), а на катоді позитивні іони дістають електрони, яких їм бракує (відновна реакція).
Розглянемо явище електролізу на прикладі мідного купоросу. В результаті електролітичної дисоціації CuSO4 = Cu2+ + SO42-. Позитивно заряджені іони міді під дією електричного струму будуть переміщуватися до катода, де отримають електрони і виділяться на ньому у вигляді нейтральних атомів міді. Негативно заряджені іони під дією електричного поля перемістяться до анода, де віддадуть вільні електрони і також виділяться на ньому.
У 1833-1834 pp. видатний англійський вчений Майкл Фарадей експериментально встановив кількісні співвідношення, що описують явище електролізу.

Перший закон Фарадея: маса речовини, яка виділяється на одну електроді, пропорційна кількості електрики яка проходить через електроліт:
m = kq
де, m– маса речовини, яка виділилась на електроді;
q – заряд, який пройшов через електроліт;
k – коефіцієнт пропорційності, який залежить від речовини, яка виділяється на електроді.
q = It ,
m = kIt .
де, m – маса речовини, яка виділилась на електроді;
І – сила струму, який іде через електроліт;
t – час електролізу;
k – коефіцієнт пропорційності, який залежить від речовини, яка виділяється на електроді.
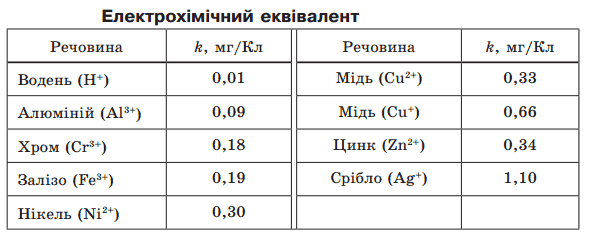
Електрохімічні еквіваленти різних речовин дуже істотно відрізняються один від одного.
- Від яких же властивостей речовини залежить величина її електрохімічного еквівалента?
Відповідь на це запитання дає такий важливий закон, який так само встановив Фарадей на досліді.
Другий закон Фарадея: електрохімічний еквівалент речовини прямо пропорційний молярній масі речовини і обернено пропорційний валентності .
k = (1/F) · (M/n)
де M (кг/моль) – молярна маса речовини;
n – валентність цієї речовини;
F – коефіцієнт пропорційності, який є універсальною сталою, тобто має однакове значення для всіх речовин і називається сталою Фарадея.
F=9,6·104 кг/ моль – стала Фарадея.
Коефіцієнт k називається електрохімічним еквівалентом даної речовини. Значення цього коефіцієнта можна з’ясувати з виразу:
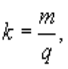
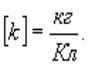
Електрохімічний еквівалент чисельно дорівнює масі речовини в кілограмах (кг), що виділяється під час проходження 1 Кл електрики.
Коефіцієнт k залежить від молярної маси речовини й валентності.
Отже, електрохімічні еквіваленти неоднакові не тільки для різних речовин, але й для однієї й тієї самої речовини в різних сполуках, у яких воно має різну валентність (наприклад CuCl і CuSO4 ).
Є спеціальні таблиці електрохімічних еквівалентів речовин
V. Застосування та закріплення знань
Розв’язування задач
Задача 1.Під час електролізу розчину цинк сульфату виділилося 2,45 г цинку. Визначте електрохімічний еквівалент цього металу, якщо крізь електроліт протягом 60 хв. проходив електричний струм 2 А.


Задача 2.Скільки часу потрібно для нікелювання металевого тіла площею
120 см2, якщо товщина поверхні має становити 0,03 мм? Сила струму дорівнює 0,5 А.
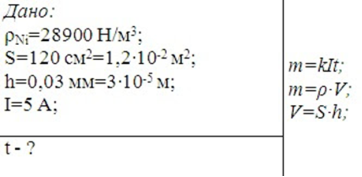
VІ. Підсумок уроку.
Прочитати учням вірш О.Бондаренка «Електроліз»
Електроліз
Нема давно нових ідей
Про струм в електроліті,
Бо їх давно подав ще Фарадей
В минулому столітті.
Він перший ввів слова
«анод», «катод», «іони»
І електролізу аж два
Відкрив свої закони.
Хоч солі різні, та завжди
В них спільна є ознака:
Дають попавши до води,
Іони різних знаків,
Така ж властивість кислоти,
Така ж молекул лугу,
А як до ванни підвести
До джерела напругу.
Тоді іони, як в строю,
Йдуть в електричнім полі,
І кожний порцію свою
Несе заряду в колі.
До електродів підійдуть,
На них осядуть сходу,
Заряд негайно віддадуть
Аноду чи катоду.
І в тім немає дивини,
Що пропорційна маса
Осілої речовини
До сили струму й часу.
Отож, як бачимо, ясна
І мудра та ідея,
Яка втілилась сповна
В законах Фарадея.
О.Бондаренко
VIІ. Домашнє завдання
1. Опрацювати §37
2. Вправа 37(2,3,6)
3.Підготувати повідомлення «Практичне застосування електролізу


про публікацію авторської розробки
Додати розробку