Урок 7. "Ковалентний зв'язок. Донорно-акцепторний механізм утворення ковалентного зв’язку (на прикладі катіону амонію)".
Клас: 11 Дата
Урок 7. Ковалентний зв'язок. Донорно-акцепторний механізм утворення ковалентного зв’язку (на прикладі катіону амонію).
Мета: -навчальна: познайомити учнів з основними принципами утворення ковалентного зв’язку; поглибити знання про поняття хімічний зв’язок; дати уявлення про донорно-акцепторний механізм утворення ковалентного зв’язку (на прикладі катіону амонію); формувати уміння створювати схему утворення ковалентного зв’язку.
-розвиваюча: розвивати логічне мислення та усне мовлення; уміння аналізувати, зіставляти, робити висновки.
-виховна: виховувати любов до предмету, самостійність та творчий підхід.
Тип уроку: комбінований урок засвоєння знань, умінь і навичок та їх творчого застосування на практиці.
Хід уроку:
І. Організаційний момент.
ІІ. Актуалізація опорних знань.
Дайте відповіді на запитання:
- У чому виявляється електронна природа хімічного зв'язку?
- Дайте визначення: а) хімічному зв'язку; б) йонному зв'язку. завдяки яким взаємодіям вони утворюються?
- Схарактеризуйте умови виникнення хімічного зв'язку.
- Для яких сполук характерний йонний зв'язок?
ІІІ. Мотивація навчальної діяльності.
На відміну від йонного зв'язку, під час утворення якого атоми металічних елементів віддають валентні електрони, а атоми неметалічних елементів приєднують їх, утворення хімічного зв'язку між атомами неметалічних елементів відбувається по-іншому. Атоми не віддають і не приєднують електрони в односторонньому порядку, а утворюють із валентних неспарених електронів спільні електронні пари в такій кількості, що забезпечує кожному атому завершену будову зовнішнього енергетичного рівня. Утворений у такий спосіб хімічний зв'язок називають ковалентним.
IV.Вивчення нового матеріалу.
З'ясовувати особливості утворення цього зв'язку розпочнемо на прикладі молекули гідроген хлориду НCl.
Спершу складемо електронні та графічні електронні формули атомів обох хімічних елементів.

Найближчим до Гідрогену інертним елементом є Гелій, електронна оболонка атома якого складається з двох електронів. Отже, Гідрогену достатньо утворити одну спільну з Хлором електронну пару, аби досягти завершеності енергетичного рівня.
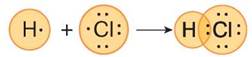
Мал. Модель утворення молекули гідроген хлориду
Зовнішньому енергетичному рівню атома Хлору не вистачає одного електрона, аби мати однакову електронну конфігурацію з найближчим до нього інертним хімічним елементом Аргоном. Маючи по одному неспареному електрону, атом Гідрогену й атом Хлору утворюють спільну електронну пару і в такий спосіб їхні зовнішні енергетичні рівні стають завершеними.
Ковалентний хімічний зв'язок — це хімічний зв'язок, утворений завдяки тому, що два атома роблять спільними пару (пари) валентних електронів у кількості, необхідній їм для завершення зовнішніх енергетичних рівнів.
Утворення спільних електронних пар відбувається з виділенням енергії. Це енергетично вигідно, оскільки молекула більш енергетично стійка, ніж поодинокий атом. Щоб зруйнувати ковалентний зв'язок, необхідно затратити стільки ж енергії, скільки її виділилося під час утворення хімічного зв'язку.
ВИДИ КОВАЛЕНТНОГО ЗВ'ЯЗКУ. Від утворення спільних електронних пар виникає область з відносно високою електронною густиною й між нею та атомними центрами діють сили притягання. Якщо молекула утворена атомами елементів з однаковим значенням електронегативності, то електронна густина спільної пари електронів не зміщується в бік одного з них, бо кожен атом діє на неї з однаковою силою. Такий ковалентний зв'язок називають неполярним.
Ковалентний неполярний зв'язок — це зв'язок, у якого спільна пара електронів локалізована симетрично відносно центрів обох атомів.
Повернемося до вже розглянутої будови атомів Гідрогену і Хлору, щоб з'ясувати хімічний зв'язок у двохатомних молекулах простих речовин водню Н2 і хлору Cl2. Розглянемо електронні формули молекул цих речовин:
![]()
Вони свідчать про утворення ковалентного неполярного зв'язку.
Електронна формула молекули — це запис складу речовини за допомогою символів хімічних елементів і крапок, що позначають електрони зовнішнього енергетичного рівня.
Якщо ж ковалентний зв'язок утворюють атоми з різною електронегативністю, то ймовірність перебування електронів хімічного зв'язку поблизу зв'язаних атомів буде різною. Для більш електронегативного атома вона більша. І це показано на схемі утворення ковалентного зв'язку в молекулі гідроген хлориду.
Ковалентний зв'язок, утворений атомами різних елементів, у якому розподіл електронної густини спільної електронної пари є несиметричним відносно центрів обох атомів, називається полярним ковалентним зв’язком.
Утворення спільних електронних пар відбувається з неспарених електронів. Кількість їх може збільшуватися завдяки переходу атома у збуджений стан.
Залежно від кількості електронних пар, які стають спільними для сполучених атомів, ковалентні зв'язки можуть бути одинарними, подвійними та потрійними.
Прикладом одинарного зв'язку в молекулах неорганічних речовин є зв'язок атомів Гідрогену в молекулі водню Н - Н; подвійного — атомів Оксигену в молекулі кисню О = О; потрійного — атомів Нітрогену в молекулі азоту N ≡ N.
ДОНОРНО-АКЦЕПТОРНИЙ МЕХАНІЗМ УТВОРЕННЯ КОВАЛЕНТНОГО ЗВ'ЯЗКУ.
Розглянемо його утворення на прикладі катіона амонію NH+4, а для цього виконаємо спершу демонстраційний дослід. Ополоснемо одну чисто вимиту колбу концентрованим розчином амоніаку, іншу — концентрованою хлоридною кислотою. З'єднаємо отвори колб, як показано на малюнку. Спостерігатимемо, що колби починають у верхніх своїх частинах заповнюватися білим «димом». Такий вигляд мають дрібні кристалики солі амоній хлориду NH4Cl — продукту реакції сполучення цих двох летких сполук неметалічних елементів з Гідрогеном.
NH3 + НСl = NH4Cl (амоній хлорид)

Взаємодія амоніаку з гідроген хлоридом: а — колби з реагентами; б — утворення амоній хлориду
У реакції катіон Гідрогену, утворений унаслідок дисоціації хлоридної кислоти, приєднався до молекули амоніаку й утворився амоній-катіон NH+4.
NH3 + H+ + Cl- = NH+4 + Cl-
Амоній-катіон — це однозарядний позитивний йон NH+4, що утворюється внаслідок приєднання Гідроген-катіону до молекули амоніаку.
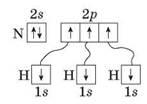
Утворення амоній-катіону відбувається за допомогою ковалентного зв'язку, але його механізм особливий — донорно-акцепторний. Щоб зрозуміти цей механізм, розглянемо електронну формулу молекули амоніаку:
![]()
Як свідчить електронна формула, за рахунок трьох неспарених електронів Нітроген утворив три ковалентні полярні зв'язки з трьома атомами Гідрогену. Усі атоми молекули амоніаку досягли завершення зовнішніх енергетичних рівнів. В атома Нітрогену він складається з восьми електронів, у атомів Гідрогену — з двох.
Електронегативність Гідрогену дорівнює 2,1; Нітрогену — 3,5. Тому спільні електронні пари зміщені до більш електронегативного Нітрогену. Цим пояснюється полярність утворених ковалентних зв'язків.
Зверніть увагу, що серед чотирьох електронних пар атома Нітрогену в молекулі амоніаку одна є особливою в тому сенсі, що утворена не внаслідок взаємодії з атомом Гідрогену. За походженням — це ті два спарені s-електрони зовнішнього енергетичного рівня атома Нітрогену, що є в нього на 2s-nідрівні:
Катіон Гідрогену Н+, що утворюється внаслідок електролітичної дисоціації гідроген хлориду в розчині, має вільну електронну орбіталь ⃞. За рахунок неї та вільної електронної пари Нітрогену утворюється ще один ковалентний зв'язок. У його утворенні Нітроген виступив донором електронів (надав свою вільну електронну пару катіону Гідрогену), а катіон Гідрогену став акцептором — її приймачем. Утворився катіон амонію
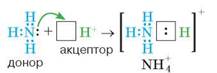
Утворення катіона амонію NH+4
Як видно з малюнка, у катіоні амонію чотири ковалентні зв'язки, з яких три утворені спільними електронними парами, а один — за донорно-акцепторним механізмом.
Ковалентний зв'язок може виникати між двома атомами, один з яких має пару електронів, а другий — вакантну (незаповнену електронами) орбіталь. Такий механізм утворення ковалентного зв'язку називається донорно-акцепторним. Атом, який надає власну (вільну) електронну пару, називається донором, а атом, який має вільну орбіталь, називають акцептором.
V. Підбиття підсумків уроку.
VІ. Домашнє завдання.
- Параграф 6
- Вправи: 47, 48.


про публікацію авторської розробки
Додати розробку
