Урок "Багатоманітність речовин. Прості і складні речовини. Метали і неметали"
Урок хімії в інклюзивному класі (7 клас)
Боровська Яна Олександрівна,
учитель хімії Пологівського НВК
|
Тема уроку: Багатоманітність речовин. Прості і складні речовини. Метали і неметали |
Тема уроку: Багатоманітність речовин. Прості і складні речовини. Метали і неметали |
|
|
Мета уроку: навчальна: розширити науковий світогляд учня на основі засвоєння системи знань про багатоманітність речовин, їх початкову класифікацію, формувати поняття «прості і складні речовини», «неорганічні і органічні речовини», вчити розрізняти прості і складні речовини, метали й неметали; розвивальна: розвивати загальнонавчальні вміння й навички учнів (спостерігати, аналізувати, порівнювати, робити висновки), вміння застосовувати знання в конкретній ситуації, описувати фізичні властивості речовин і порівнювати їх; виховна: формувати життєві компетентності — бажання вчитися, співпрацювати, відстоювати свою точку зору, використовувати джерела інформації для власного розвитку. |
Мета уроку: навчальна: працювати над закріпленням та навичками розпізнавати хімічні елементи та їх символи; формувати вміння розпізнавати формули простих та складних речовин; познайомити зі зразками простих та складних речовин, що зустрічаються в побуті. розвивальна: розвивати уважність, спостережливість, пам'ять, логічне мислення; збагачувати словниковий запас,працювати над розвитком мовлення; виховна: виховувати інтерес до уроку хімії; виховувати культуру поведінки на уроці,охайність,любов до навчання |
|
|
Тип уроку: урок формування нових знань учнів Обладнання і матеріали: картки з завданнями, таблиця Менделеєва, аудіозапис , аплікації молекул простих і складних речовин та магніти, речовини (у склянках з написами назви і формули речовини ): метали (залізо, цинк, алюміній), неметали (графіт, сірка), складні речовини (NaCl, CaCO3, CH3COOH, C2H5OH, C12H22O11, C6H12O6, CuSO4·5H2O) Педагогічний інструментарій: технології: проблемного навчання, інтерактивні вправи; методи: розповідь-пояснення, постановка проблемних запитань, демонстрація наочних матеріалів; прийоми: мозковий штурм, активізація уваги та мислення, формування висновків, пізнання закономірностей. Структура уроку І. Організаційний етап...............……………..…………………… 2 хв II. Актуалізація опорних знань…………………………..….………………………6 хв ІІІ.Мотивація навчальної діяльності ……………………………………………..6 хв ІV. Вивчення нового матеріалу………………………………….……………….. 20 хв V. Домашнє завдання ……………………………………………………..…………3 хв V. Застосування набутих знань………………………………………………… 4хв VІ. Узагальнення вивченого матеріалу…………………………………… …3хв VІІ. Домашнє завдання …………………………………………………………1хв
|
||
|
ХІД УРОКУ
І. Організаційний етап Продзвенів уже дзвінок, Всім пора нам на урок, Встаньте всі рівненько, Привітаємось гарненько: «Добрий день!»
|
||
|
ІІ. Актуалізація опорних знань 1.Фронтальна бесіда за питаннями: -Які частинки є структурними частинками речовини? -Що таке молекула? -Із чого складаються молекули? -Що таке атом? -Дайте визначення поняття «хімічний елемент». -Що таке хімічна формула речовини? -На що вказує коефіцієнт у формулі? Індекс? 2. Доповідь учня «Цікаві хімічні елементи»
3. Вправа «прочитай формулу» Mg(OH)2, H2SO3, SO2, CO, Al(OH)3, H2S, P2O5, 3N2, 2Cu, 10Li+, 7H2O.
|
||
|
4.Робота з віртуальним учителем (Хімічний диктант) Записати хімічні формули речовин: 1)СаСО3 2)Мg3(PO4)2 3)Zn(OH)2 4)4CO2 5)7Al 6)Na+ 7)H2 8)Fe(NO3)3 9)13H2SO4 10)2Cl-
|
4.Робота з картками Гра «Впізнай хімічний елемент» Учень має встановити відповідність між назвою та символом хімічних елементів, а також вписати із ПС порядковий номер кожного хімічного елемнта до відповідної картки.
|
|
|
ІІІ. Мотивація навчальної діяльності
-Всі ви добре знаєте, що хімія – це наука, яка займається вивченням речовин. -Чи знаєте ви скільки відомо речовин на сьогоднішній день? Їх близько 20 млн.! Пропоную дослідження: використовуюючи цифри 4, 5, 6 утворіть одно-, дво-, трицифрові числа. На роботу одна хвилини. Підрахуйте кількість утворених вами чисел. Отже, їх багато. (Можна навести приклади із буквами алфавіту (33), нотами у музиці (7), цифрами у математиці (10)). Отже, ми сьогодні вивчаємо багатоманітність речовин, яка в більшій мірі залежить від здатності атомів сполучатися між собою. (Учні записують тему уроку, разом формулюємо мету, виходячи з теми уроку). -Мало чи багато речовин можна утворити із 118 відомих хімічних елементів? (Звичайно, учні відповідають, що багато.) Ось цим і пояснюється багатоманітність речовин — близько 20 млн.! Записуємо тему нашого уроку: « Багатоманітність речовин. Прості і складні речовини. Метали і неметали» Мета нашого уроку: засвоїти систему знань про багатоманітність речовин, їх початкову класифікацію, сформувати поняття «прості і складні речовини», «неорганічні і органічні речовини», навчитися розрізняти прості і складні речовини, метали й неметали. |
||
|
IV. Вивчення нового матеріалу. 1. Класифікація. Всі речовини поділяють на органічні і неорганічні. Ще Я. Берцеліус, видатний хімік, запропонував речовини, які є типовими для живої природи (оливкова олія, жири, цукор) називати органічними, а неорганічними називати речовини, що є типовими для неживої природи (сіль, вода). Отже, органічні речовини - це сполуки Карбону (за невеликим винятком) з Гідрогеном, Оксигеном і деякими іншими елементами. Вони становлять світ живої природи. До цих речовин відносять жири, цукор, крохмаль, глюкоза, лимонна кислота, білки, целюлоза. Неорганічні речовини – це речовини, які утворюють мінеральний світ природи. До них належать кисень, вуглекислий газ, пісок, алмаз, вода та ін. 2. Перевіряю вашу увагу. Вправа ,,Навчаймося разом“ Вкажіть неорганічні і органічні речовини: калійна селітра, спирт, глюкоза, азот, жир, білок, хлорне вапно, вапняк, крохмаль, поташ, аргон, мідь,сірка, амінооцтова кислота, мурашина кислота. 3. Пропоную експеримент. На магнітній дошці аплікації моделей (додаток1) речовин - водню, кисню, озону, води, гідроген пероксиду. (Коротко характеризую кожну речовину, називаючи їхні різні властивості). Об’єднайте речовини у дві групи. Корегую відповіді: - Зі скількох хімічних елементів утворені речовини? -За якими ознаками можна їх згрупувати? -Показую: прості… складні… - Так які речовини можна назвати простими? складними? (Учні висловлюють різні припущення, обговорюємо їх, знаходимо правильний варіант: в одній групі – кисень, водень, озон, в іншій – вода, пероксид гідрогену.) 4. Формулювання визначень. Учні узагальнюють інформацію, пропонують визначення – «прості речовини», «складні речовини», кращий варіант записують їх у зошит. Прості речовини — це речовини, утворені одним хімічним елементом (водень, кисень, озон). Складні речовини — це речовини, які складаються з різних хімічних елементів (вода, пероксид гідрогену). 5. Назви простих речовин відрізняються від назв хімічних елементів, але іноді вони збігаються. Зверніть увагу на табл.4 с.69 (за підрічником О.Г. Ярошенко ) Правила написання назв. Назви хімічних елементів пишуться з великої букви, а простих речовин з маленької. 6. Назви складних речовин даються за певними правилами, з якими ви ознайомитеся пізніше. Часто для складних речовин використовують тривіальні (історичні або побутові назви), якими ми з вами і будемо користуватися у 7 класі, наприклад : кухонна сіль, пісок, сода, крейда, вуглекислий газ. 7. Класифікація простих речовин. Прості речовини поділяються на метали і неметали. Хімічні елементи також поділяються на металічні та неметалічні. Метали утворені металічними елементами, а неметали — неметалічними елементами. Класифікація елементів ґрунтується на здатності віддавати та приймати електрони. Цей поділ умовний , бо всі елементи в тій чи іншій мірі виявляють як металічні, так і неметалічні властивості. Якщо у довгоперіодному варіанті ПС провести діагональ від Алюмінію до Полонію, то вище від неї розташовуються неметалічні елементи, а нижче – металічні елементи. Демонстрація 8. Зразки металів і неметалів. 8. Коротка характеристика властивостей металів і неметалів. Для металів: металічний блиск, ковкість і пластичність, електро- і теплопровідність, немолекулярної будови. Для неметалів: (протилежні за властивостями) крихкі, не мають блиску, не проводять тепло і електричний струм, матова поверхня, різні кольори, мають немолекулярну і молекулярну будову.
|
||
|
V. Застосування набутих знань 1.Робота з картками. Вправа «Третій зайвий»
|
V. Застосування набутих знань 1.Робота з картками. Вправа «Третій зайвий»
|
|
|
VІ. Узагальнення вивченого матеріалу. Вправа «Мікрофон» (передаємо кубик один одному). Обговорення питань : - Що нового ви дізналися на уроці? - На які групи можна поділити речовини? - На які групи діляться прості речовини? -Які властивості характерні для металічних елементів? - Для неметалічних елементів? - Чи досягли ми бажаних результатів?
|
||
|
VІІ. Домашнє завдання
с. 77-78 виконати № 5,6
Підготувати доповідь про поширення елементів у природі*
|
VІІ. Домашнє завдання
Виписати назви складних речовин, які ти можеш знайти вдома на кухні. |
|
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
|
ГІДРОГЕН |
ГЕЛІЙ |
ЛІТІЙ |
КАРБОН |
|
НІТРОГЕН |
ОКСИГЕН |
ФЛУОР |
НАТРІЙ |
|
МАГНІЙ |
АЛЮМІНІЙ |
СІЛІЦІЙ |
ФОСФОР |
|
СУЛЬФУР |
ХЛОР |
БАРІЙ |
ЙОД |
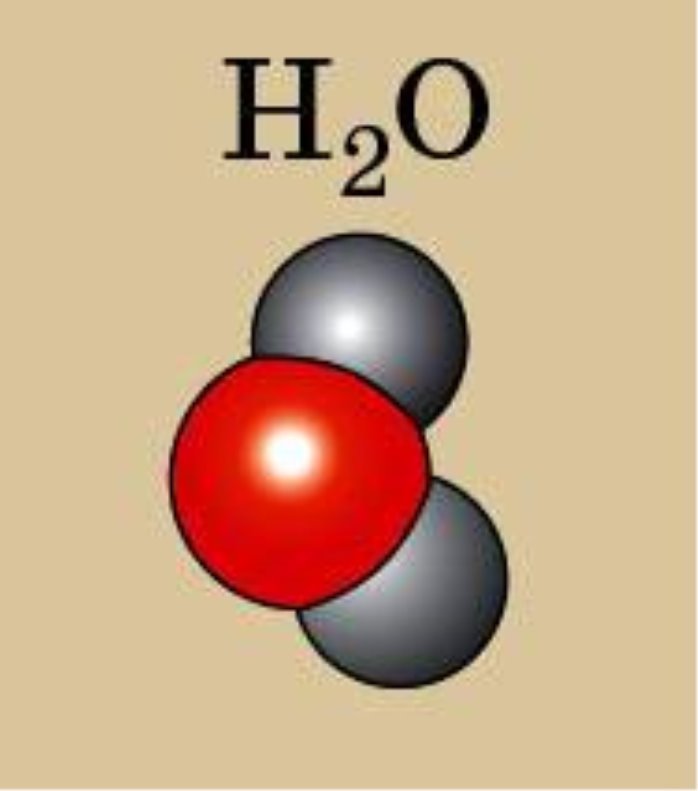 Молекула води
Молекула води
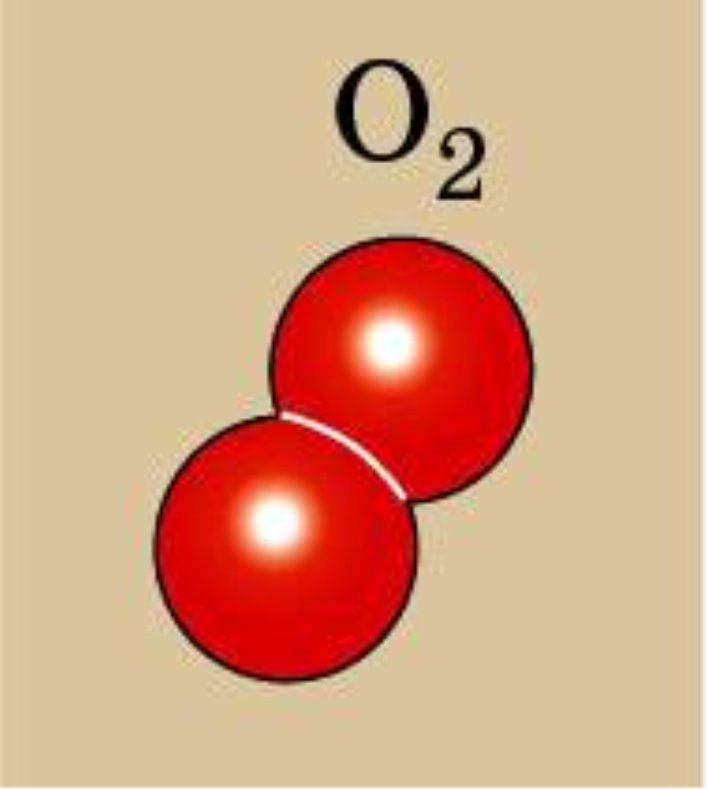
Молекула кисню
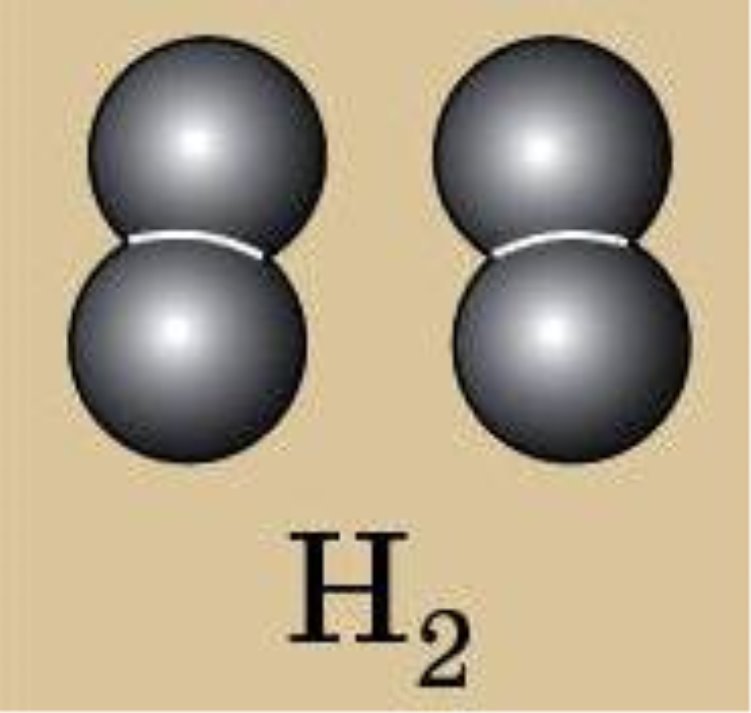
Молекули водню
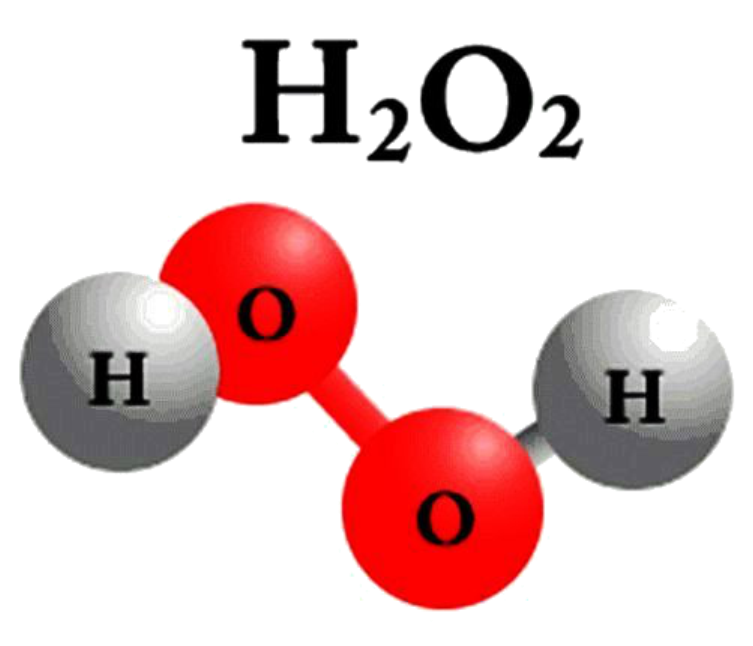
Молекула перекису водню
Молекула озону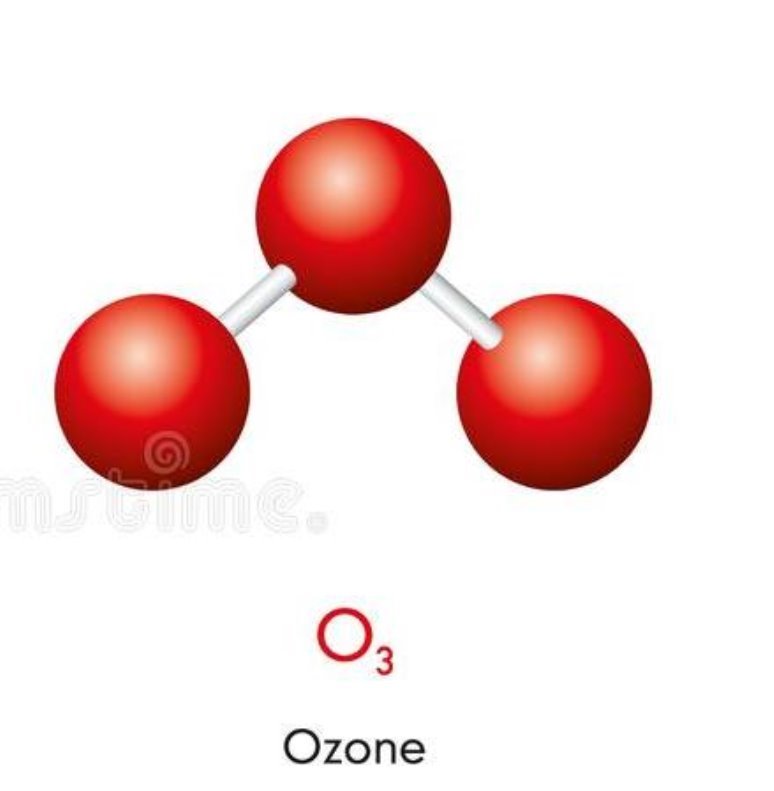
Вправа «Третій зайвий»
Викресли у кожному рядку формулу зайвої сполуки:
|
S |
H2S |
H2O |
|
Al |
C |
CO2 |
|
Ca |
Na |
N |
|
P2O5 |
CuO |
Al2O3 |
|
Cl2 |
H2 |
HCl |
|
H2CO3 |
CuSO4 |
H2SO3 |
|
CO2 |
O2 |
C12H22O11 |
Вправа «Третій зайвий»
Викресли у кожному рядку формулу зайвої сполуки:
|
S |
H2S |
H2O |
|
Al |
C |
CO2 |
|
Ca |
Na |
N |
|
P2O5 |
CuO |
Al2O3 |
|
Cl2 |
H2 |
HCl |
|
H2CO3 |
CuSO4 |
H2SO3 |
|
CO2 |
O2 |
C12H22O11 |
Вправа «Третій зайвий»
Викресли у кожному рядку формулу зайвої сполуки:
|
S |
H2S |
H2O |
|
Al |
C |
CO2 |
|
Ca |
Na |
N |
|
P2O5 |
CuO |
Al2O3 |
|
Cl2 |
H2 |
HCl |
|
H2CO3 |
CuSO4 |
H2SO3 |
|
CO2 |
O2 |
C12H22O11 |
Вправа «Третій зайвий»
Викресли у кожному рядку формулу зайвої сполуки:
|
S |
H2S |
H2O |
|
Al |
C |
CO2 |
|
Ca |
Na |
N |
|
P2O5 |
CuO |
Al2O3 |
|
Cl2 |
H2 |
HCl |
|
H2CO3 |
CuSO4 |
H2SO3 |
|
CO2 |
O2 |
C12H22O11 |
Вправа «Третій зайвий»
Викресли у кожному рядку формулу зайвої сполуки:
|
S |
H2S |
H2O |
|
Al |
C |
CO2 |
|
Ca |
Na |
N |
|
P2O5 |
CuO |
Al2O3 |
|
Cl2 |
H2 |
HCl |
|
H2CO3 |
CuSO4 |
H2SO3 |
|
CO2 |
O2 |
C12H22O11 |
Вправа «Третій зайвий»
Викресли у кожному рядку формулу зайвої сполуки:
|
S |
H2S |
H2O |
|
Al |
C |
CO2 |
|
Ca |
Na |
N |
|
P2O5 |
CuO |
Al2O3 |
|
Cl2 |
H2 |
HCl |
|
H2CO3 |
CuSO4 |
H2SO3 |
|
CO2 |
O2 |
C12H22O11 |
Вправа «Впізнай речовини»
|
Назва речовини |
Фото речовини |
Проста чи складна речовина |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|


про публікацію авторської розробки
Додати розробку








