Урок Багатоманітність речовин. Прості та складні речовини. Метали й неметали.""
Підготовка до уроку здійснювалася з ретельного вивчення програми з предмету, освітніх стандартів та визначення основних виховних і розвивальних завдань у межах навчального предмету з даної теми. Пропоную розробку комбінованого уроку з хімії "Багатоманітність речовин. Прості та складні речовини. Метали й неметали." (7 клас).
Тема: Багатоманітність речовин. Прості та складні речовини. Метали й неметали.
Мета: поглибити знання учнів про класифікацію речовин; сформувати поняття «проста речовина» і «складна речовина»; навчити розрізняти такі поняття як «проста речовина» і «хімічний елемент», «складна речовина» й «суміш речовини»; ознайомити учнів з початковою класифікацією простих речовин – металів та неметалів; навчити відрізняти металічні та неметалічні елементи за фізичними властивостями та їхнім положенням у Періодичній системі хімічних елементів; розвивати вміння аналізувати та використовувати набуті знання на уроках хімії; виховувати спостережливість.
Тип уроку: комбінований
Обладнання: Періодична система хімічних елементів; зразки речовин (сірка, залізо, вугілля, алюміній, вода, натрій хлорид, купрум(ІІ) оксид, цукор); кулестержневі моделі молекул води, кисню і вуглекислого газу.
Базові поняття й терміни: проста речовина, складна речовина, метали, неметали, група, період, складна речовина, органічні та неорганічні сполуки.
Методи навчання:
- словесні (бесіда, розповідь вчителя)
- словесно-наочні (демонстраційний і лабораторний дослід);
- словесно-наочно-практичний (робота з підручником, індивідуальна робота на картках, розв’язування хімічних вправ)
Література:
- Попель П.П., Крикля Л.С. Хімія: підруч. для 7 кл. загальноосвіт. навч. закл. – К. : ВЦ «Академія», 2015. – 72-80 с.
- Григорович О.В. Хімія. 7 клас: зошит для контролю навчальних досягнень учнів. – Х. : Вид-во «Ранок», 2016. – 22 с.
Хід уроку
І. Організаційний етап
Привітання учнів, перевірка присутніх.
ІІ. Актуалізація опорних знань
Перевірка та обговорення домашнього завдання.
- Індивідуальна робота на картках
Картка № 1
- Яку одиницю називають атомною одиницею маси?
- Вкажіть відносні атомні маси наступних елементів: Оксигену, Натрію та Барію.
Картка № 2
- Що показує відносна атомна маса елемента?
- Вкажіть відносні атомні маси наступних елементів: Гелію, Аргону та Алюмінію.
- Бесіда
- Назвіть одиниці вимірювання маси атома?
- Якого порядку ці значення?
- Що означають записи Ar і Ar?
- Який атом легший – Li чи Mg? У скільки разів?
- Хто склав першу таблицю відносних атомних мас?
- Як знайти масу атома хімічного елемента, якщо відома його відносна атомна маса?
ІІІ. Мотивація навчальної діяльності
- Гра «Вірю – не вірю»
Учитель читає запитання і якщо воно правильне, то учнів плескають у долоні, якщо ні – не плескають. Обов’язкова аргументація відповіді.
- Чи вірите ви, що всі метали за звичайних умов тверді?
- Чи вірите ви, що є кольорові метали?
- Чи вірите ви, що метали проводять електричний струм?
- Чи вірите ви, що є м’які метали і їх можна різати ножем?
- Чи відрізняються формули речовин і чим саме?
|
O2 N2 Na S8 I2 O3 Al C |
|
NaCl CO2 H2O CH3COOH CH3OH CaC2 HNO2 |
Учні роблять висновок, що проста речовина – це та речовина, яка утворена одним хімічним елементом;
Речовину, утворену двома або більшою кількістю елементів, називають складною речовиною.
Повідомлення теми уроку. Формулювання разом з учнями мети та завдань уроку.
IV. Вивчення нового матеріалу
Розповідь вчителя
В природі існує багато речовин, з якими ми безпосередньо уже зустрічалися. Це речовини у вигляді газів, рідин або твердих тіл. Завдяки тому, що атоми здатні сполучатися між собою нас оточує велике розмаїття речовин. Серед них є як прості, так і складні речовини.
(Демонстрація кулестержневої моделі O2. Вчитель на прикладі пояснює, що молекула кисню складається лише з атомів Оксигену)
Записати визначення у зошит. Речовину, утворену одним хімічних елементом, називають простою.
Більшість простих речовин називають так, як і відповідні хімічні елементи. Якщо назви різні, їх наведено у клітинках періодичної системи; назва простої речовини розміщена під назвою елемента.
|
С 6 Карбон 12, 011 Вуглець |
Назва хімічного елемента →
↑
Назва простої речовини
- Назвіть прості речовини елементів Натрію, Фосфору, Нітрогену.
Прості речовини поділяють на метали і неметали. Хімічні елементи-метали утворюють прості речовини – метали, а хімічні елементи-неметали утворюють прості речовини – неметали. Таку класифікацію простих речовин запропонував наприкінці XVIII ст. видатний французький учений А.-Л.Лавуазьє.
Метали представляють собою кристалічні речовини немолекулярної будови. Вони відрізняються від решти речовин особливим «металічним» блиском. За звичайних умов тверді (лише ртуть є рідиною), добре проводять електричний струм і теплоту, мають здебільшого досить високі температури плавлення (понад 500 °С), багато з них є пластичними (їх можна кувати, витягувати з них дріт).
Подібність металів зумовлена їхньої внутрішньою будовою. Атоми розміщені в металі уже щільно, і частина електронів постійно переходить від одних атомів до інших.
Неметали відрізняються від металів передусім відсутністю металічного блиску. Лише йод, графіт, кристалічні бор і силіцій мають такий блиск. Неметали не проводять електричний струм (виняток — графіт). За звичайних умов частина неметалів перебуває у газоподібному стані, інші є твердими і тільки бром – рідиною.
Частина неметалів складається з атомів. В алмазі, графіті, борі всі атоми сполучені один з одним, а в інертних газах – гелії, неоні, аргоні, криптоні, ксеноні й радоні – вони роз’єднані.
Інші неметали утворені молекулами. Атоми в кожній молекулі міцно сполучені між собою, а молекули лише слабко притягуються одна до одної. Тому вони мають невисокі температури плавлення і кипіння.
Із молекул складаються прості речовини Оксигену – кисень і озон. Молекула кисню містить 2 атоми, а молекула озону – 3.
(Робота з підручником стор. 74, мал. 43)
Записати визначення у зошит. Речовину, утворену двома або більшою кількістю елементів, називають складною речовиною, або хімічною сполукою.
Більшість складних речовин мають молекулярну будову. Тому температури їх плавлення і кипіння невисокі. Частина таких речовин має запах. Молекулярною сполукою є вода. Вона складається з двох атомів Гідрогену і одного атома Оксигену.
До складних речовин також відносяться оцтова кислота, питна сода, цукор, кухонна сіль.
У 1807 році Берцеліус запропонував речовини, які є типовими для живої природи (оливкова олія, жири, цукор) називати органічними, а неорганічними називати речовини, що належать до неживої природи (сіль, вода).
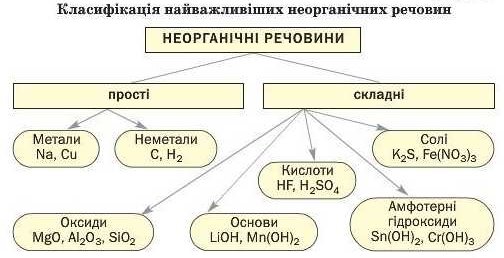
Потрібно чітко розрізняти поняття «суміш» і «складна речовина».
(Робота з таблицею)
|
Хімічні речовини та суміші відрізняються: |
Хімічні речовини |
Суміші |
|
за складом |
постійні |
змінні |
|
за властивостями |
постійні |
залежать від складу |
|
за можливістю розділення |
фізично неподільні |
можна розділити фізичними способами |
Лабораторний дослід № 2. Ознайомлення із зразками простих і складних речовин.
|
Назва речовини |
Проста речовина |
Складна речовина |
Органічна речовина |
Неорганічна речовина |
|
|
Метал |
Неметал |
||||
|
Натрій хлорид |
|
|
+ |
|
+ |
|
Сірка |
|
+ |
|
|
+ |
|
Цукор |
|
|
+ |
+ |
|
|
Залізо |
+ |
|
|
|
+ |
V. Узагальнення та систематизація знань
Завдання: випишіть у 2 стовпчики прості та складні речовини (цукор, водень, вода, сіль, золото, оцтова кислота, бронза, лимонна кислота, кисень, чадний газ, нікель)
Робота з підручником (виконання вправи № 87, стор. 80)
VI. Підведення підсумків уроку
Підбиття підсумків уроку, виставлення оцінок.
Учні доповнюють речення: «Мені запам’яталось…»
VII. Домашнє завдання
Опрацювати параграф 11-12 (стор. 72-80); виконати завдання № 82 (стор. 76) і № 86 (стор. 80)


про публікацію авторської розробки
Додати розробку
