Урок "Оцтова кислота, її молекулярна та структурна формули, фізичні властивості. Функціональна (характеристична) карбоксильна група. Застосування оцтової кислоти."
Під час уроку формуються знання учнів про карбоксильну функціональну групу на прикладі оцтової кислоти; оказати зв'язок між функціональною карбоксильною групою та фізичними властивостями оцтової кислоти, галузями її застосування.
1
Урок № 43/15 Клас 9 Дата______ Вчитель___________________
Тема: Оцтова кислота, її молекулярна та структурна формули, фізичні властивості. Функціональна (характеристична) карбоксильна група. Застосування оцтової кислоти.
Навчальна мета: сформувати знання учнів про карбоксильну функціональну групу на прикладі оцтової кислоти; показати зв'язок між функціональною карбоксильною групою та фізичними властивостями оцтової кислоти, галузями її застосування.
Розвивальна мета: розвивати вміння спостерігати, робити висновки, вміння вільно висловлюватися, оптимально використовувати власні знання й сприйняту на уроці інформацію для результативної комунікації.
Виховна мета: сприяти розширенню кругозору учнів, виховання працьовитості, акуратності, дисциплінованості, виховувати вміння плідно співпрацювати з однокласником та вчителем.
Базові поняття та терміни: карбонові кислоти, оцтова кислота, карбонільна і карбоксильна групи, функціональна група, основність кислот, оксигеновмісні кислоти
Тип уроку: вивчення нового матеріалу
Методи, форми та прийоми роботи: словесні, пояснювально-ілюстративні, репродуктивні, часткові-пошукові, дослідницькі практичні, інтерактивні, методи контролю, самостійна робота учнів у групах.
Обладнання: зразок оцтової кислоти, роздатковий матеріал (макети таблиць для заповнення, куле стержнева модель оцтової кислоти.
Структура уроку і хронометраж:
- Організаційний етап.(1 хв)
- Перевірка домашнього завдання(10 хв)
- Актуалізація опорних знань(3 хв)
- Мотивація навчальної діяльності(2 хв)
- Вивчення нового матеріалу(25 хв)
- Узагальнення та систематизація знань(2 хв)
- Д/з(1 хв)
- Підбиття підсумків(1 хв)
Хід уроку
- Організаційний етап.
Привітання, перевірка готовності учнів до уроку, налаштування їх на робочий лад.
Добрий день! Сідайте будь-ласка. Сьогодні на уроці ви дізнаєтесь дуже багато цікавого, а також Вам доведеться згадати попередньо вивчений матеріал.
- Перевірка домашньго завдання
Спочатку напишемо самостійну роботу:
Самостійна робота:
Варіант №1
1.Укажіть загальну формулу насичених одноатомних спиртів:
А) CnH2nOH Б)CnH2nO2 В)CnH2n+2O Г)CnH2n+1OH
2.Укажіть ознаку якісної реакції на багатоатомні спирти:
А) утворення білого драглистого осаду
Б) виділення фіолетового газу
В) знебарвлення розчину
Г) поява темно-синього забарвлення розчину
3.Укажіть речовину, за допомогою якої можливо визначити гліцерин в розчині:
А) калій перманганат;
Б) арґентум нітрат
В) ферум (III) хлорид
Г) купрум (II) гідроксид
4.Напишіть рівняння реакції взаємодії: етанолу, метанолу, гліцерину з натрієм та неорганічними кислотами.
5.При взаємодії 12,8 г спирту з натрієм утворилось 4,48 л водню. Який це спирт?
Варіант №2
1.Укажіть загальну формулу насичених одноатомних спиртів:
А) CnH2nOH Б) CnH2nO2 В) CnH2n+1OH Г) CnH2n+2O
2.Укажіть ознаку якісної реакції на багатоатомні спирти:
А) утворення білого драглистого осаду
Б) поява темно-синього забарвлення розчину
В) знебарвлення розчину
Г) виділення фіолетового газу
3.Укажіть речовину, за допомогою якої можливо визначити багатоатомні спирти в розчині:
А) калій перманганат;
Б) арґентум нітрат
В) ферум (III) хлорид
Г) купрум (II) гідроксид
4.Напишіть рівняння реакції взаємодії: етанолу, метанолу, гліцерину з галогеноводнями та неорганічними кислотами.
5.Який об’єм водню виділиться при взаємодії 9,2 г натрію з етанолом?
- Актуалізація опорних знань
Фронтальне опитування
- Давайте згадаємо класи неорганічних сполук. (Оксиди, основи, кислоти)
- Що ви пам’ятаєте про кислоти з курсу неорганічної хімії?
- Які речовини називаються кислотами з точки зору електролітичної дисоціації?
(Електролітична дисоціація у водних розчинах – це повний або частковий процес розпаду електроліту на йони під впливом полярних молекул води.
Кислота – це електроліт, при дисоціації якого утворюються катіони Гідрогену й аніони кислотного залишку.)
- За якими ознаками можна класифікувати неорганічні кислоти?
- Які кислоти називають одноосновними та багато основними? Наведіть приклади.
- Які кислоти називають сильними та слабкими? Наведіть приклади.
(Сильні кислоти – це
- Мотивація навчальної діяльності.
Задача. При повному згорянні 6,0 г органічної речовини отримано 8,8 г СО2 і 3,6 г води. Густина парів органічної речовини по водню дорівнює 30. Яка молекулярна формула речовини?
6 г 3,6 г 8,8 г
СxHyOz - ? СxHyOz + O2 → СO2 + H2O
m(СxHyOz) = 6 г 60г/моль 22,4л/моль 44 г/моль
m(СO2) = 8.8 г D(СxHyOz)(H2)= M(СxHyOz) / M(H2)
m(H2O) = 3.6 г M(СxHyOz) = D(СxHyOz)(H2)* M(H2)
D(СxHyOz)(H2)=30 M(СxHyOz) = 30*2=60 (г/моль)
Визначаємо масу атомів Карбону у сполуці СxHyOz:
44 г (СO2) – 12 г (С)
8,8 г (СO2) – x г (С)
x = 8.8*12 / 44 = 2.4 (г) m(C) = 2.4 г.
Визначаємо масу атомів Гідрогену у сполуці СxHyOz:
18 г (H2O) – 2 г (Н)
3,6 г (H2O) – x г (Н)
x = 3.6*2 / 18 = 0.4 (г) m(H) = 0.4 г.
А масса атомів Оксигену у сполуці дорівнює:
m(O) = 6 – 0.4 – 2.4 = 3.2 (г).
x : y : z = ![]() = 0.2 : 0.4 : 0.2 = 1 : 2 :1.
= 0.2 : 0.4 : 0.2 = 1 : 2 :1.
Маємо найпростішу формулу: CH2O.
n = M(СxHyOz) / M(CH2O)
n = 60 / 30 = 2
Формула вуглеводню має вигляд: C2H4O2 або її ще записують так СН3СООН.
Ми з Вами отримали сполуку, давайте спробуємо з’ясувати до якого класу органічних сполук вона належить. Ми з Вами розглянули лише один оксигеновмісний клас органічних сполук.
(Згадуємо загальну формулу спиртів: СnH2n+1OH, адже з вивчених Вами органічних сполук лише спирти мають атоми Оксигену у своєму складі.)
Бачимо, що ця сполука не належить до спиртів, але відгадавши загадку Ви зможете її назвати:
Чи знаєте Ви про таку кислоту,
Яку повсякчас додаємо до борщу,
ЇЇ кладемо ми завжди в маринад
Для всяких смачнючих солінь і принад?
Добре молодці Ви знайшли вірну відповідь. Це дійсно оцет, він є 9%-вим розчином оцтової кислоти, і так записуємо тему нашого уроку «Карбонові кислоти».
- Вивчення нового матеріалу.
Оцтова кислота належить до такого класу органічних оксигеновмісних сполук як КАРБОНОВІ КИСЛОТИ.
Карбонові кислоти – це похідні насичених вуглеводнів що містять одну або декілька карбоксильних груп  .
.
Група атомів С=О називається карбоніл, група С-ОН – гідроксил.
Скорочено її позначають так –СООН. Карбоксильна група є функціональною групою карбонових кислот.
Згадуємо, що таке функціональна група?
Давайте спробуємо записати загальну формулу карбонових кислот, маючи приклад оцтову кислоту і знаючи, що в сполуці обов’язково повинна міститися карбоксильна група –СООН.
Так дійсно, загальна формула має вигляд: СnH2n+1СООН, або ж структурною формулою: 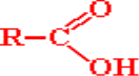 де R – вуглеводневий радикал.
де R – вуглеводневий радикал.
А вуглеводневий радикал це?
Зараз я Вам роздам таблиці схожі на ті, що ви отримали на минулому уроці.
І ми разом з Вами їх заповнимо.
|
Ознаки Властивості |
Оцтова кислота (Етанова) |
|
Структурна формула |
|
|
Емпірична |
СН3СООН |
|
Хімічний зв'язок |
Ковалентний полярний |
|
М, г/моль |
60 |
|
Густина, г/см3 |
1,049 |
|
Тпл,оС |
16,6 |
|
Ткип, оС |
117,7 |
|
Розчинність у воді |
Необмежена |
|
Колір |
Безбарвний |
|
Запах |
Різкий |
|
Назва солі |
Ацетат (етаноат) |
Карбонові кислоти класифікують
За природою вуглеводневого радикалу: насичені; ненасичені, ароматичні.
За к-тю гідроксогруп: одноосновні, двохосновні.
Відповідно до систематичної номенклатури кислотам дають назви:
Назва відповідного вуглеводню + закінчення –ОВА + кислота. Наприклад, метанова НСООН ( по іншому її називають мурашиною), етанова бачимо на дошці і знаємо, що її називають оцтовою, пропанова С2Н5СООН (називають пропіонова), бутанова С3Н7СООН (називають масляна) і т.д.
Нумерацію карбонового скелета починають з атома Карбону карбоксильної групи.
Карбонові кислоти за к-тю атомів більше 10 є твердими речовинами.
Хімічний зв'язок С – Н ковалентний слабо полярний.
Звязки С=О і О – Н ковалентні полярні
Тпл - При охолодженні до 16 оС безводна оцтова кислота перетворюється на прозорі кристали, схожі на лід тому 100%-ву оцтову килоту також називають крижаною.
- Узагальнення та закріплення знань.
- Чому у карбонових кислот на відміну від вуглеводнів немає газуватих речовин? У якому ще гомологічному ряді відсутні гази?
- Які з речовин, формули яких наведені нижче, належать до карбонових кислот: СН3ОН, С3Н6, НСООСН3, СН3СОН, НСООН, С17Н35СООН, С2Н5ОН, С4Н5СООН. За якою ознакою ви вибирали речовини?
- Масові частки Карбону, Гідрогену, Оксигену в одноосновній кислоті дорівнюють відповідно 26,1; 4,35; 69,55%. Візначте відносну молекулярну массу та формулу сполуки.
- Д/з (диференційоване).
- Задача. Яку массу оцтової кислоти й води треба взяти для приготування розчину оцтової кислоти массою 20г з массовою часткою кислоти 9%?
- Підготувати повідомлення про застосування оцтової кислоти.
- §28, с. 195-197 (до хімічних властивостей)
- Підбиття підсумків
Ви молодці, ми добре з Вами попрацювали. Давайте згадаємо, що нового ми сьогодні дізналися.


про публікацію авторської розробки
Додати розробку
