Урок "Ферум — найважливіший d-елемент, його хімічні властивості"
МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ
ЧОРТКІВСЬКИЙ ДЕРЖАВНИЙ МЕДИЧНИЙ КОЛЕДЖ
ЦИКЛОВА КОМІСІЯ ВИКЛАДАЧІВ природничо-математичних дисциплін
Викладач хімії: Цілінська О.Г.
 Методична розробка заняття з навчальної дисципліни «Хімія»
Методична розробка заняття з навчальної дисципліни «Хімія»
для студентів І курсу спеціалізації “Сестринська справа”


![]()
О.Г.Цілінська – викладач хімії Чортківського державного медичного коледжу.
Дана методична розробка підготовлена для студентів І курсу спеціальності "Сестринська справа" ВМНЗ І-ІІ р.а.
Обговорено та схвалено на засіданні циклової комісії викладачів природничо-математичних дисциплін Чортківського державного медичного коледжу. Протокол №3 від. 11. 10. 2018 р.
МЕТОДИЧНА РОЗРОБКА ЗАНЯТТЯ З НАВЧАЛЬНОЇ ДИСЦИПЛІНИ
«ХІМІЯ»
Тема. Ферум — найважливіший d-елемент, його хімічні властивості.
Кількість навчальних годин – 2 год.
Навчальні цілі заняття.
Фахові компетентності:
- знати про метали побічних підгруп на прикладі Феруму; положення Феруму в періодичній системі хімічних елементів; залежність будови і властивостей на прикладі сполук Феруму(ІІ) і Феруму(ІІІ); застосування заліза та сполук Феруму.
- уміти з’ясувати позитивний і негативний вплив Феруму та його сполук на здоров’я людини; проаналізувати негативні впливи заліза на організм людини, запропонувати заходи, що обмежуватимуть такі впливи; показати важливість хімії як науки у вирішуванні актуальних проблем, що постають перед охороною здоров’я;
- оволодіти практичними навичками відтворення методики виконання дослідів та пояснення результатів.
Загальні компетентності: розвивати комунікативні здібності, аналітичне мислення, уміння швидко приймати рішення, працювати в команді, застосовувати отримані знання на практиці, розвивати дослідницькі навики і уміння, виховувати почуття відповідальності, виховувати психологічну готовність до роботи, витримку, терпеливість, ретельність і спостережливість під час проведення досліду.
Методи навчання.
- Словесні: розповідь-пояснення, бесіда.
- Наочні: мультимедійна презентація, відеоролики: «Алюмометрія. Відновлення феруму з ферум оксиду», «Одержання ферум (ІІ) гідроксиду», «Одержання ферум (ІІІ) гідроксиду»; таблиці: «Періодична система елементів Д. І. Мендєлєєва», «Ряд активності металів», «Відносні молекулярні маси неорганічних сполук»; демонстрація колекції «Мінерали».
- Практичні: розв’язування тестів, рівнянь реакцій та задач.
- Інтерактивні методи: хімічний диктант, «Qr-код», прийоми «Міні-практикум», «Хрестики-нулики», «Три-Два-Один», міні-проект, розв’язування кросворду, дидактичні картки.
Міжпредметна інтеграція
|
№ з/п |
Дисципліни |
Знати |
Уміти |
|
Наступні (забезпечувані) дисципліни |
|||
|
1. |
Медична хімія |
|
|
|
2. |
Основи медсестринства |
|
|
|
3. |
Фармакологія |
|
|
|
4. |
Хірургія |
|
|
Література:
- Березан О., Хімія. Комплексна підготовка до ЗНО – Тернопіль: Підручники і посібники, 2016. – 384с.
- Буринська Н. М. та ін. Хімія. 10 клас (профільний рівень). — К: Педагогічна думка, 2010.
- Попель П. П., Крикля Л. С. Хімія. 10 клас (рівень стандарту, академічний рівень). — К: Академія, 2010.
- Ярошенко О. Г. Хімія. 10 клас (рівень стандарту, академічний рівень). — К: Грамота, 2010.
- https://pidruchnyk.com.ua/
- http://www.subject.com.ua/chemistry/
- http://tabletki.pp.ua/zdorovya/6782-yaka-rol-zalza-v-organzm-lyudini.html
- https://uk.wikipedia.org/wiki
Структура заняття
І. Підготовчий етап.
Привітання, встановлення психоемоційного зв’язку зі студентами, перевірка присутності на занятті, наявності та охайності халата, шапочки, перевзуття.
ІІ. Актуалізація опорних знань.
1. Хімічний диктант. У зошит записуються символи хімічних елементів, які зачитуються, ділячи їх на два стовпчики окремо метали, окремо неметали.
Натрій, Сульфур, Оксиген, Залізо, Купрум, Нітроген, Кальцій, Магній, Фофор, Гідроген, Хлор, Барій, Калій, Золото, Карбон, Алюміній, Францій, Йод.
Після виконання завдання два студенти записують відповідь на дошці, група коригує помилки.
2. Фронтальне опитування.
- Чим відрізняються метали й неметали?
- Чим відрізняються метали й неметали за хімічними властивостями?
- Що таке амфотерність?
- Які речовини називаються феромагнетиками?
- Що таке корозія?
- Що таке алюмінотермія?
Здійснюється перевірка домашнього завдання із теми: «Алюміній та його сполуки». Деякі студенти виконують індивідуальні завдання за дидактичними картками, а інші – розв’язують кросворд.
На домашнє завдання потрібно було розв’язати задачу. Отже, один студент розв’язуватиме її біля дошки.
3. Дидактична картка 3а.
На тривалентний метал масою 10,8 г подіяли сульфатною кислотою. Виділився газ об’ємом 13,44 л (н.у.). Який це метал? У якому періоді та групі він знаходиться? Обчисліть число протонів і нейтронів у ядрі.
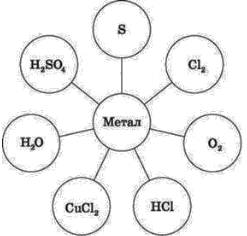
Дидактична картка 3б. Напишіть рівняння реакцій між Алюмінієм та наведеними речовинами, назвіть утворені сполуки.
Дидактична картка 3в. Якими трьома способами можна добути алюміній хлорид.
Дидактична картка 3г. Здійсніть реакції за схемою.
алюміній → алюміній оксид → алюміній хлорид
↓
алюміній хлорид → алюміній гідроксид→ алюміній хлорид
4. Кросворд “Метали".
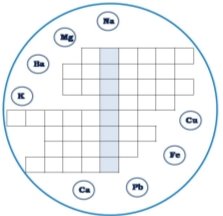
У восьми колах зображені знаки хімічних елементів-металів. Потрібно розташувати їх назви по горизонталі у клітинках таким чином, щоб у вертикальному, виділеному, стовпчику, можна було прочитати назву найпоширенішого металу на Землі.
Схему кросворда переносять у зошит.
Властивості Алюмінію та його сполук вже розглядалися, тому продовжуємо вивчати хімічні елементи які представляють родину Металів.
III. Вивчення нового матеріалу.
Познайомимося з елементом, який є необхідний для всіх живих організмів і без якого не можливо уявити свого життя. Щоб дізнатися що це за елемент потрібно відгадати загадку:
Я поширене в природі,
Кожному стаю в пригоді.
Де мене зустріти можна,
З вас, напевне, знає кожен.
Магнетит і гематит,
Лимоніт і сидерит –
Руди ці – матусі рідні,
А татусь – метеорит
Я умію воювати,
Але вмію й будувати
Рейки, кораблі, машини,
Теплоходи і турбіни.
Кров чому у вас червона?
Бо в крові є мої йони.
Вголос мовте для загалу
Назву чорного металу.
(Залізо)
Залізо це є назва простої речовини, яку утворює металічний елемент Ферум.
Тема: Ферум — найважливіший d-елемент, його хімічні властивості.
План:
- Ферум як хімічний елемент.
- Поширення Феруму у природі.
- Фізичні та хімічні властивості заліза, та його сполук.
- Біологічна роль Феруму в організмі людини.
- Ферум як хімічний елемент.
Положення в Періодичній системі. (Один студент біля дошки, а інші самостійно в зошитах характеризують положення Феруму у Періодичній системі хімічних елементів Д.І. Менделєєва).
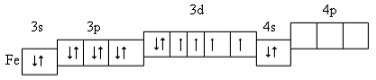
Будова атома Феруму.
(Студенти обговорюють будову атома Феруму).
 Ферум – d-елемент VІІІ групи побічної підгрупи, четвертого періоду періодичної системи.
Ферум – d-елемент VІІІ групи побічної підгрупи, четвертого періоду періодичної системи.
Будова атома:
Електронна конфігурація атома Феруму:
1s22s22p62s23p63d64s2
Розміщення електронів зовнішнього і передостаннього енергетичних рівнів за енергетичними комірками:
В атомі Феруму вісім валентних електронів (3d64s2), тому він виявляє змінні ступені окиснення.
Таким чином найхарактерніші валентності Феруму – ІІ і ІІІ, а ступені окиснення +2 і +3 (інколи +6)
|
Ступені окиснення |
+2 |
+3 |
+6 |
|
Приклади сполук |
FeО, FeCl2, Fe(OH)2 |
Fe2О3, FeCl3, Fe(OH)3 |
K2FeО4 |
- Поширення Феруму у природі.
Про місце знаходження Фруму у періодичній системі знаємо, а тепер дізнаємося де цей хімічний елемент знаходиться у природі.
На попередньому занятті було запропоновано підготувати проект. Зараз ми прослухаємо розповість про «Поширення Феруму у природі і його природні сполуки».
Міні-проект – «Поширення Феруму у природі і його природні сполуки». (див. додаток 2)
(Студентам пропонується розглянути колекцію мінералів. В процесі прослуховування інформації студенти заповняють табличку).
Природні сполуки Феруму Таблиця 1.
|
№ з/п |
Назва мінералу |
Хімічна формула |
Вміст Fe, % |
|
1. |
Магнітний залізняк |
|
|
|
2. |
Червоний залізняк (гематит) |
|
|
|
3. |
Бурий залізняк (лимоніт) |
|
|
|
4. |
Шпатовий залізняк (сидерит) |
|
|
|
5. |
Пірит (залізний колчедан) |
|
|
- Фізичні та хімічні властивості заліза, та його сполук.
А зараз розглянемо фізичні та хімічні властивості Феруму.
Чисте залізо — сріблясто-білий із сіруватим відтінком метал (у порошкоподібному стані блиск втрачається, колір стає сірувато-чорним). Залізо має густину 7,87 г/см3 і температуру плавлення 1539 °С.
Залізо та його сплави притягуються магнітом і легко намагнічуються в магнітному полі, є добрими провідниками струму й тепла. На магнітних властивостях заліза і його сплавів ґрунтується використання їх як матеріалу для виготовлення серцевин трансформаторів, вантажопідіймачів, телефонних мембран тощо.
Під час накалювання метал легко прокатується, кується. Наші прадіди використовували цю його властивість для виготовлення в кузнях плугів, борін, коліс, сокир, підків, молотків, лопат тощо.
 Хімічні властивості визначаються наявністю домішок. Чисте залізо – метал середньої активності. Біля м. Делі (Індія) стоїть залізна колона висотою 7 м і масою 6,5 т без жодних слідів корозії, хоча її вік – понад 2800 р. Колона виготовлена із заліза чистотою 99,72%, стійкого до корозії.
Хімічні властивості визначаються наявністю домішок. Чисте залізо – метал середньої активності. Біля м. Делі (Індія) стоїть залізна колона висотою 7 м і масою 6,5 т без жодних слідів корозії, хоча її вік – понад 2800 р. Колона виготовлена із заліза чистотою 99,72%, стійкого до корозії.
Залізо з високим ступенем чистоти малоактивне й не піддається корозії. Проте навіть невелика частка різних домішок збільшує активність заліза в усіх хімічних реакціях. Подібно до більшості металів залізо окиснюється киснем та іншими неметалами, вступає в реакції заміщення з кислотами і солями менш активних за нього металічних елементів, взаємодіє під час нагрівання з водою.
- Взаємодія заліза з киснем.
Вам уже доводилося спостерігати, як за лічені секунди залізна голка згорає в кисні сліпучим полум’ям, а утворюється в результаті реакції залізна окалина Fе3О4 поширюється в усі боки, нагадуючи бенгальські вогні:
+2 +3
ЗFе + 2О2 = Fе3О4 → (FеО • Fе2О3) (залізна окалина)
Залізна окалина є подвійним оксидом, у якого один атом Феруму проявляє ступінь окиснення +2, два інші +3.
- Взаємодія заліза з водою
Під час пропускання парівводи над нагрітим порошком заліза відбувається реакція, що супроводжується утворенням подвійного оксиду Fе3О4 і водню:
3Fе + 4Н2O →tº Fе3О4 + 4Н2↑
- Взаємодія заліза з іншими неметалами.
При нагріванні залізо реагує з багатьма неметалами, зокрема згоряє в атмосфері кисню, хлору, активно взаємодіє із сіркою:
Fе + S →tº Fе S (ферум сульфід)
2Fе + N2 → 2FеN (ферум нітрид)
2Fе + 3С12 = 2FеСl3 (ферум хлорид)
- Взаємодія заліза з кислотами.
Взаємодія заліза з кислотами залежить від температури та концентрації кислоти. Залізо взаємодіє із хлоридною, розбавленою сульфатною та деякими іншими кислотами з виділенням водню й утворенням солей Феруму (ІІ)
Fе + Н2SO4 (розб.) = FеSO4 + Н2↑
Fе + 2НС1 = FеСl2 + Н2↑
Із концентрованими нітратною і сульфатною кислотами залізо за звичайних умов майже не реагує через утворення на поверхні металу хімічно пасивної оксидної плівки. Тому ці цистерни не транспортують у залізних цистернах. При нагріванні оксидна плівка взаємодіє із кислотою й відразу в реакцію вступає метал:
Fе + НNO3(конц.) →tº Fе(NO3)3 + NO2 + Н2О
Fе + Н2SO4 (конц.) →tº Fе2(SO4)3 + SO2 + Н2О
- Взаємодія заліза із солями.
Залізо «витісняє» (заміщає) із солей у їх розчинах менш активні метали – Купрум, Аргентум, Бісмут… При цьому крім них утворюються солі Феруму (ІІ), але не Феруму (ІІІ):
3Fе + 2ВіСl3 → 3Fе Сl2 + 2Ві
Ви вже знаєте, що Ферум утворює сполуки зі ступенями окиснення +2 і +3, менш характерним є ступінь окиснення +6. Розглянемо властивості оксидів, гідроксидів та солей Феруму(ІІ) і Феруму(ІІІ).
- Ферум (ІІ) оксид FeO — це чорні кристали з атомною кристалічною ґраткою, тому й високою температурою плавлення (1368 °С), практично нерозчинні у воді. Ферум(ІІ) оксид належить до основних оксидів, оскільки має найнижчий ступінь окиснення +2.
Ферум(ІІ) оксид добувають термічним розкладом ферум (ІІ) карбонату в атмосфері азоту
FeCO3 →t FeO + CO2↑
або термічним розкладом ферум (ІІ) гідроксиду:
Fe(OH)2 →t FeO + H2O
Ферум(ІІ) оксид є компонентом кераміки, пігментом для фарб і термостійкої емалі.
- Ферум (ІІ) гідроксид Fe(OH)2 — це порошок білого кольору, малорозчинний у воді, має основний характер і виявляє відновні властивості. Його одержують при взаємодії лугів з розчинними у воді солями Феруму (ІІ). (демонстрація відеодосліду)
FeSO4 + 2KOH → Fe(OH)2↓ + K2SO4
Свіжоосаджений ферум (ІІ) гідроксид має зеленкуватий колір, на повітрі швидко змінює своє забарвлення – буріє Fе+2 → Fе+3
Ферум (ІІ) оксид і Ферум (ІІ) гідроксид взаємодіють із кислотами:
FeO + 2HCl → FeCl2 + H2O
Fe(OH)2 + H2SO4 → FeSO4 + H2O
- Ферум(ІІІ) оксид Fe2O3 — темно-червоного кольору (мал. 128); має атомну кристалічну ґратку, тому й високу температуру плавлення (1565 °С), нерозчинний у воді. Це найстійкіша природна сполука Феруму — червоний залізняк. Ферум(ІІІ) оксид має cлабко виражені амфотерні властивості з переважанням основних, тому взаємодіє з кислотами:
Fe2O3 + 6НС1 = 2FeCl3 + 3H2O
Виявляє слабкі кислотні властивості лише при сплавлянні з лугами, утворюючи солі ферити — натрій ферит NaFeO2:
Fe2O3 + 2NaOH (крист.) = 2NaFeO2 + Н2O
Отже, ферум(ІІІ) оксид — амфотерна сполука з переважанням основних властивостей.
Ферум (ІІІ) оксид можна добути термічним розкладом ферум (ІІІ) гідроксиду або ферум(ІІІ) нітрату:
2Fe(OH)3 →t Fe2O3 + 3H2O
4Fe(NO3)3 →t 2Fe2O3 + 12NO2↑ + 3O2↑
Застосування. Ферум(ІП) оксид застосовують у виготовленні кераміки, цементу, як пігмент у фарбах — жовтий (вохра), червоний (сурик), коричневий (умбра), як полірувальний матеріал тощо.
- Ферум (ІІІ) гідроксид Fe(OH)3 — червоно-бура речовина , нерозчинна у воді, тому слабкий електроліт.
Fe(OH)3 + 3НС1→ FeCl3 + 3H2O
Ферум(ІІІ) гідроксид добувають за реакцією обміну між сіллю Феруму (ІІІ) і лугом: (демонстрація відеодосліду)
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
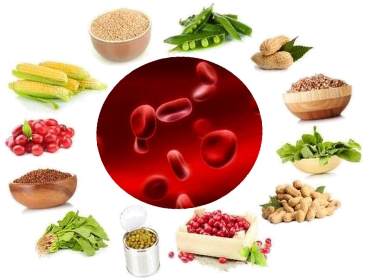
- Біологічна роль Феруму в організмі людини.
Значення заліза для людського здоров'я навряд чи можна переоцінити. Воно входить до складу більшості ферментів. Залізо є важливим мікроелементом, і надходження його має бути регулярним. Не можна допускати дефіциту, адже роль заліза в організмі людини дуже важлива.
На скільки залізо є необхідним для нашого організму зможна дізнатися опрацювавши інформацію з мережі інтернет. Для цього знадобляться мобільні телефони та програма Qr-кодів – посилання на сайт. (Qr-код – роздрукований додається на кожну парту).

(Студенти самостійно опрацьовують матеріал, де виділяють основне з прочитаного і заповняють таблицю).
Біологічна роль Феруму в організмі людини Таблиця 2.
|
№ |
Запитання |
Відповідь |
|
1. |
Яка роль заліза в організмі людини? |
|
|
2. |
Які функції заліза в організмі людини? |
|
|
3. |
Які продукти харчування тваринного походження багаті залізом? |
|
|
4. |
В яких продуктах рослинного походження є залізо? |
|
|
5. |
Яка добова потреба заліза в організмі? |
|
|
6. |
Чим небезпечний надлишок заліза в організмі? |
|
|
7. |
Які ознаки дефіциту заліза? |
|
|
8. |
Чим небезпечна недостатня кількість заліза в організмі? |
|
Закріплення вивченого матеріалу.
Для закріплення вивченого матеріалу виконаємо декілька завдань.
Прийом «Міні-практикум»
Здійснити перетворення та вказати назви утворених речовин.
Варіант І. Fe → FeCl2 → Fe(OH)2 → FeO
Варіант ІI. Fe → FeCl3 → Fe(OH)3 → Fe2O3
Задача 1.
Яку масу сірки слід узяти, щоб у ній було стільки ж атомів, скільки їх міститься в залізі масою 12,32 г?
Задача 2.
Яка маса сульфатної кислоти потрібна для розчинення 3 г ферум (ІІІ) гідроксиду.
Прийом “Хрестики-нулики”.
Визначте виграшні шляхи на схемах, якщо:
а) це хімічні сполуки, що входять до складу залізних руд;
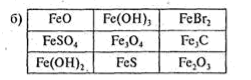
б) це складні речовини, що належать до одного класу;

(схеми перекресліть у зошити)
V. Підсумок заняття. Рефлексія.
Прийом «Три – Два – Один». (Студентам роздаються невеликі аркуші, де є розграфлено три рядки). Пригадавши все що ви вивчили на сьогоднішньому занятті, вам потрібно виконати ще одне завдання. На аркушах, які є у вас на партах, вам потрібно записати:
- в першому рядочку Три факти, які були для вас новими, цікавими, несподіваними на занятті;
- в другому – Два факти, які здалися нецікавими, некорисними, або вже були відомі для вас;
- в третьому – Один факт, який хотілось би вивчити детальніше, поглибити свої знання.
VІ. Домашнє завдання.
- О.Г.Ярошенко, Хімія: Підручник для 10 класів загальноосвітніх навчальних закладів, К.: «Грамота», 2010, §22. Підготуватися до перевірочної контрольної роботи.
- Підгот-уватися до представлення проектів з тем (презентація):
- Метали і сплави в сучасній техніці.
- Метали в медичній галузі.
- Застосування алюмінію, заліза та їхніх сплавів.
- Охорона навколишнього середовища під час виробництва і використання металів.
- Записати рівняння реакцій за схемою перетворень, назвати утворені речовини:
Fe2O3 → Fe2(SO4)3 → Fe(OH)3 → FeCl3
1


про публікацію авторської розробки
Додати розробку