Урок " Ферум як представник металічних елементів побічних підгруп. Фізичні і хімічні властивості заліза"
Вступ
Ферум – один із найважливіших металічних елементів. Його просту речовину – метал залізо – людина використовує вже кілька тисячоліть. Без заліза та його сплавів нині не можна уявити розвиток нашої цивілізації. Сполуки Феруму широко застосовуються в практичній діяльності людей, відіграють дуже важливу роль у живій природі.
Опанувавши матеріал модуля, ви:
- характеризуватимете Ферум за його місцем у періодичній системі та будовою атома, фізичні та хімічні властивості заліза;
- складатимете рівняння відповідних реакцій;
- пояснюватиме утворення металічного зв'язку.
Тема: Ферум як представник металічних елементів побічних підгруп. Фізичні і хімічні властивості заліза
Ферум – неметалічний елемент побічної підгрупи VIII групи, 4 періоду, парного ряду; разом з Кобальтом і Ніколом належить до родини Феруму.
Будова атома Fe – протонне число 26, нуклонне число 56, +26 (заряд ядра), 26p, 30n, 26e.
Вкажіть кількість s-електронів в атомі Феруму
а) 5; б) 8; в) 10; г) 6
Електронна конфігурація Fe1s22s22р63s23р63d64s2
d-елемент, атом якого на зовнішньому енергетичному рівні має 2е і на передостанньому d-підрівні третього енергетичного рівня міститься 6е. У сполуках Ферум проявляє ступінь окиснення +2, +3, рідше +6 та ін.

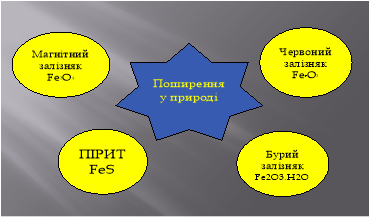
Поширення Феруму в природі. За поширенням у природі йому належить четверте місце, а серед металічних елементів – друге. Ферум трапляється переважно в складі сполук: оксиди, сульфіди, карбонати, що становлять основу його мінералів і руд; у незначній кількості входить до складу живих організмів, наприклад, в організмі дорослої людини міститься майже 4-5г.
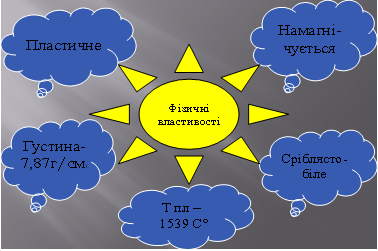
Хімічні властивості. Залізо у хімічних реакціях виявляє достатню активність і взаємодіє з такими речовинами:
- неметалами
3Fe + 2O2 = Fe3O4 (або FeO ∙ Fe2O3)
2Fe + 3Cl2 = 2FeCl3
Fe + S = FeS
- кислотами
Fe + 2HCl = FeCl2 + Н2↑
Зверніть увагу! У реакціях з розбавленими сульфатною та хлоридною кислотами залізо утворює сіль Феруму(ІІ), а у реакції з хлором – Феруму(ІІІ)
- водою при нагріванні
3Fe + 4H2O = Fe3O4 + 4H2↑
- солями
Fe + CuSO4 = FeSO4 + Cu
Тестові завдання
1. За поширенням у природі Ферум займає місце:
а) перше;
б) друге;
в) третє;
г) четверте.
2. У хімічній формулі FeO ступінь окиснення Феруму:
а) +1;
б) +2;
в) +3;
г) +4.
3. У результаті горіння заліза в кисні утворюється речовина:
а) Fe3O4;
б) Fe2O3;
в) FeO;
г) FeS.
4. У медицині застосовують Ферум як засіб:
а) для полегшення дихання;
б) укріплення серцевого м’яза;
в) позбавлення від анемії;
г) протистояння грипу.
5. Як захист від корозії металеві вироби вкривають металами:
а) цинком;
б) ртуттю;
в) сріблом;
г) натрієм.
6. У атомі Феруму, який розташований у побічній підгрупі восьмої групи, на останньому енергетичному рівні знаходиться електронів:
а) вісім;
б) чотири;
в) два;
г) шість.
Перевір себе
Завдання 1. Встановити відповідність. До кожного рядка, позначеного ЦИФРОЮ доберіть відповідник, позначений БУКВОЮ, і впишіть її в таблицю.
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
1. Fe + HCl → А Fe(OH)3 + K2SO4
2. Fe2(SO4)3 + KOH → Б FeCl3
3. Fe + H2O + O2 → В FeCl2
4. Fe + Cl2 → Г FeCl2 + Н2
Д Fe(OH)3
1 – Г; 2 – А; 3 – Д; 4 - Б
Завдання 2. Масова частка Феруму у ферум(III) оксиді становить
а) 0,5; б) 0,35; в) 0,7; г) 0,85
Це цікаво
Цей елемент має величезне значення в житті людини. У 1910 р. в Стокгольмі проходила міжнародна конференція геологів, яка порушила проблему майбутнього «залізного голоду», бо вважалося, що баланс залізних ресурсів Землі незабаром буде вичерпаний.
Академік Фурман передбачав, що станеться з людством, якщо зникне залізо:
«…на вулицях стояв би жах руйнування: ні рейок, ні вагонів, ні автомобілів…гинули б і рослини без живлющого металу. Руйнування ураганом пройшло б по всій Землі і загибель людства зробилася б неминучою.
Утім, людина не повинна була б дожити до цього моменту: втративши 3г Феруму у своєму тілі й крові, вона припинила б своє існування, тому що втрата Феруму (0,005% від ваги тіла) було б для неї смертю».
Глосарій
Пірит – залізний колчедан FeS2
Гематит – червоний залізняк Fe2O3
Магнетит – магнітний залізняк Fe3O4
Лимоніт – бурий залізняк Fe2O3 ∙ nH2O
Домашнє завдання. Опрацювати матеріал модуля


про публікацію авторської розробки
Додати розробку
