Олімпіада з хімії 11 клас (запитання та відповіді)
11 клас
Олімпіада з хімії 2022-2023
Міський (районний) тур
У завданнях 1-6 виберіть правильну відповідь
1. (5 балів) Укажіть формулу вуглеводню ряду ацетилену, відносна густина за гелієм якого дорівнює 10.
А. С 3 Н 6 ; Б. С 3 Н 4 ; В. С 4 Н 6 ; Г. С 5 Н 8
2. (5 балів) Встановіть назву алкану, який має наведену нижче будову. Укажіть суму локантів, що є в його
назві.
Б. 1; В. 2; Г. 6; Д. 4.
3. (5 балів) Формули солей, для кожної з яких правильно зазначено середовище її
розбавленого розчину, наведено в рядку:
Середовище водного розчину солі
кисле нейтральне лужне
А K 2 SO 3 NaNO 3 Al 2 (SO 4 ) 3
Б NaNO 3 Al 2 (SO 4 ) 3 K 2 SO 3
В Al 2 (SO 4 ) 3 NaNO 3 K 2 SO 3
Г Al 2 (SO 4 ) 3 K 2 SO 3 NaNO 3
4. (5 балів) Як відомо, косметичні креми містять жирову та водну складові. Якщо термін придатності
крему скінчився, може спостерігатись їх розділення. Це означає:
І що утворився колоїдний розчин;
ІІ що із часом взаємна розчинність вказаних складових зменшується;
ІІІ що із часом зменшується стійкість вказаних сумішей та вони стають схильними
дорозшарування;
IV що у складі крему відбулись хімічні перетворення, які призвели до розшарування.
Вірні ствердження: А – І
Б – ІІ, ІІІ
В – І, IV
Г – III, IV
Д – ІІ
Е – ІІІ
Є – IV
5. (5 балів) Для проведення реакції взяли тверду речовину X та рідину Y. У результаті реакції добули газ,
властивості якого дослідили так, як показано на рисунку. Під час досліду
спостерігали зміну кольору внаслідок утворення свинцю з плюмбум(ІІ)
оксиду.
Тверда речовина X та рідина Y - це відповідно
А. манган (IV) оксид і розчин гідроген пероксиду
Б. цинк і хлоридна кислота
В. кальцій карбонат і хлоридна кислота
Г. кальцій оксид і вода
До завдань 6-10 наведіть повні розв’язки та пояснення.
6. (15 балів) Суміш натрій ацетату та натрій пропіонату масою 26,1 г прожарили з надлишком натрій
гідроксиду і одержали cуміш газів з відносною густиною за воднем 13,6. Потім отриману суміш спалили в
суміші озону та кисню, з об’ємною часткою озону 20%.
1) Складіть рівняння зазначених в задачі реакцій.
2) Визначте об’ємний склад (у %) компонентів суміші газів.
3) Визначте, який об’єм суміші озону з киснем, який витратили на спалювання суміші вуглеводнів,
одержаних у результаті прожарювання солей.
7. (15 балів) Якщо залізні ошурки, які ретельно очищені від іржі, помістити в колбу з концентрованою
сульфатною кислотою за звичайної температури, то ніякої реакції не відбувається. Якщо колбу нагріти, то
виділяється негорючий газ із неприємним різким запахом. Коли цей газ пропустити через воду, то розчин
змінює забарвлення індикатора метилоранжу на рожевий.
Якщо сульфатну кислоту розвести водою і також додати залізні ошурки, то починається бурхливе
виділення газу. Цей газ легко спалахує від запаленого сірника.
1) Напишіть рівняння всіх описаних реакцій і назвіть гази, які виділяються в кожному випадку.
2) Визначте кількість електронів, які брали участь у процесі відновлення Сульфуру при взаємодії
заліза з концентрованою сульфатною кислотою при нагріванні. Відповідь підтвердьте записом
електронного балансу.
3) Чому залізо не взаємодіє з концентрованою сульфатною кислотою за звичайної температури та
чому його треба очистити від іржі.
4) Визначте маси продуктів реакцій, які утворяться при взаємодії залізних ошурок масою 14 г з
розведеною сульфатною кислотою масою 9,8 г
8. (15 балів) Кінцевим продуктом двох ланцюгів перетворення є сполука Z, яка у малих кількостях є
життєво необхідною, оскільки збуджує дихальний центр мозку, а в дуже великих – пригнічує його.
Напишіть рівняння реакції, що відповідають зазначеній нижче схемі:
Виконайте завдання:
1) Визначте речовини X, Y, Z. Укажіть умови проходження реакцій.
2) Укажіть типи реакцій та назвіть усі продукти реакцій.
3) Для сполук С 2 Н 5 ОН, С 2 Н 4 О та C 2 H 4 O 2 складіть усі можливі ізомери та назвіть їх.
9. (15 балів) Речовину Х уперше отримав у 1671 році англієць Джон Рєєй перегонкою червоних мурах у
приладі, зображеному на рисунку.
При укусі мураха впорскує під шкіру водний розчин, що містить 50%
(за об'ємом) речовини Х. Звичайна руда мураха Formica rufa може
впорснути близько 6,0 × 10 ˗3 см 3 такого розчину; як правило, мураха не
використовує весь розчин речовини Х за один укус у ході такої «ін’єкції», витрачаючи 80% усіх своїх
запасів. Саме речовина Х викликає подразнення шкіри від «опіку» кропивою або укусів мурах. Коли шкіра
чешеться та болить, рекомендують помазати хворе місце розчином питної соди або нашатирного спирту.
Відомо, що речовина Х складається на 4,35 % з Гідрогену, на 26,09 % з Карбону та на 69,56 % з Оксигену.
Дайте відповіді на запитання.
1) Чому в реторти (див. малюнок до задачі) такий довгий «ніс»?
2) Двома - трьома реченнями опишіть процес перегонки.
3) Визначте речовину Х. Який об’єм Х (у розрахунку на чисту речовину) містить одна
середньостатистична мураха?
4) Скільки мурах потрібно було піддати перегонці, щоб отримати 1 літр чистої речовини Х (якщо
припустити, що при перегонці збиралося 100% речовини Х)?
5) Поясніть із хімічної точки зору дію розчинів питної соди та нашатирного спирту на уражені
місця.
10. (15 балів) При спалюванні пари етилацетату в кисні виділилося 620 кДж теплоти. Не
прореагувало 20,16 л кисню (за температури 30 ºС і тиску 106 кПа).
1) Визначте масові частки компонентів у вихідній суміші, якщо відомо, що теплоти утворення
карбон(ІV) оксиду, пари води та пари етилацетату дорівнюють відповідно – 393,5 кДж/моль, – 241,8
кДж/моль та – 486,6 кДж/моль.
2) Запишіть рівняння хімічних реакцій, що ілюструють синтез етилацетату з кальцій карбіду.
ВІДПОВІДІ
У завданнях 1-6 виберіть правильну відповідь
- (5 балів) Укажіть формулу вуглеводню ряду ацетилену, відносна густина за гелієм якого дорівнює 10.
А.С3Н6; Б.С3Н4; В.С4Н6; Г.С5Н8
-
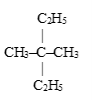 (5 балів)Встановіть назву алкану, який має наведену нижче будову. Укажіть суму локантів, що є в його назві.
(5 балів)Встановіть назву алкану, який має наведену нижче будову. Укажіть суму локантів, що є в його назві.
Б. 1; В. 2; Г.6; Д. 4.
- (5 балів) Формули солей, для кожної з яких правильно зазначено середовище її розбавленого розчину, наведено в рядку:
|
|
Середовище водного розчину солі |
||
|
кисле |
нейтральне |
лужне |
|
|
А |
K2SO3 |
NaNO3 |
Al2(SO4)3 |
|
Б |
NaNO3 |
Al2(SO4)3 |
K2SO3 |
|
В |
Al2(SO4)3 |
NaNO3 |
K2SO3 |
|
Г |
Al2(SO4)3 |
K2SO3 |
NaNO3 |
- (5 балів) Як відомо, косметичнікремимістятьжирову та воднускладові. Якщотермінпридатності крему скінчився, можеспостерігатисьїхрозділення. Цеозначає:
Іщоутворивсяколоїднийрозчин;
ІІщоіз часом взаємнарозчинністьвказанихскладовихзменшується;
ІІІщоіз часом зменшуєтьсястійкістьвказанихсумішей та вони стаютьсхильнимидорозшарування;
IVщо у складі крему відбулисьхімічніперетворення, якіпризвели до розшарування.
Вірніствердження: А – І
Б–ІІ, ІІІ
В – І, IV
Г – III, IV
Д – ІІ
Е – ІІІ
Є– IV
-
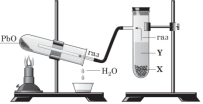 (5 балів)Для проведення реакції взяли тверду речовину X та рідину Y. У результаті реакції добули газ, властивості якого дослідили так, як показано на рисунку. Під час досліду спостерігали зміну кольору внаслідок утворення свинцю з плюмбум(ІІ) оксиду.
(5 балів)Для проведення реакції взяли тверду речовину X та рідину Y. У результаті реакції добули газ, властивості якого дослідили так, як показано на рисунку. Під час досліду спостерігали зміну кольору внаслідок утворення свинцю з плюмбум(ІІ) оксиду.
Тверда речовина X та рідина Y- це відповідно
А. манган (IV) оксид і розчин гідроген пероксиду
Б.цинк і хлоридна кислота
В. кальцій карбонат і хлоридна кислота
Г. кальцій оксид і вода
Дозавдань 6-10наведіть повнірозв’язки та пояснення.
- (15 балів) Суміш натрій ацетату та натрій пропіонату масою 26,1 г прожарили з надлишком натрій гідроксиду і одержали cуміш газівз відносною густиною за воднем 13,6. Потім отриману суміш спалили в суміші озону та кисню, з об’ємною часткою озону 20%.
- Складіть рівняння зазначених в задачі реакцій.
- Визначте об’ємний склад (у %) компонентів суміші газів.
- Визначте, який об’єм суміші озону з киснемвитратили на спалювання суміші вуглеводнів, одержаних у результаті прожарювання солей.
Розв’язування
- CH3COONa + NaОН → Na2CO3 + CH4
C 2H5COONa + NaОН → Na2CO3 + C2H6
СН4 + 2О2 →СО2 + 2Н2О 2С2Н6 + 7О2 →4СО2 + 6Н2О
- Середня молярна маса вуглеводнів дорівнює M(CH4+C2H6)=13,6 ∙2=27,2 г/моль
Припустимо, що φ(СН4)=х, тоді φ(С2Н6)=1-х.
Складемо алгебраїчне рівняння і знайдемо х:
16х + 30(1-х) = 27,2
Звідки х=0,2.
Отже, φ(СН4)=0,2=20%, φ(С2Н6)=0,8=80%.
- Нехай кількість речовини суміші вуглеводнів складає у моль. Тоді n(CH4)=0,2у, а n(С2Н6)=0,8у.
Відповідно n(CH3COONa)=0,2у, а n(CH3CH2COONa)=0,8у.
m(CH3COONa) = 82∙0,2у=16,4у; m(CH3CH2COONa ) = 96∙0,8у=76,8у.
Складаємо алгебраїчне рівняння: 16,4у+76,8у=26,1. Звідки у=0,28.
Тобто n(CH4)=0,2∙0,28=0,056 моль, а n(С2Н6)=0,8∙0,28=0,224 моль.
n1(О2) = 2n(СН4) = 2. 0,056 = 0,112 моль n2(О2) = 7/2n(С2Н6) = 7/2.0,224 = 0,784 моль
На спалювання вуглеводнів витратили 0,112 + 0,784 = 0,896 моль кисню
V(О2) = 0,896.22,4 = 20,07 л
У 100л озоно-кисневої суміші міститься 20л О3 та 80л О2. Озон розкладається за рівнянням
2О3→3О2
З 20 л озону утворюється 30 л кисню. Зі 100 л озоно-кисневої суміші можна добути 80+30 = 110 л кисню Складемо пропорцію:
Зі 100л озоно-кисневої суміші можна добути 110л О2
З V л озоно-кисневої суміші можна добути 20,07 л О2
100/V= 110/20,07, V = 18,25 л.
- (15 балів) Якщо залізні ошурки, які ретельно очищені від іржі, помістити в колбу з концентрованою сульфатною кислотою за звичайної температури, то ніякої реакції не відбувається. Якщо колбу нагріти, то виділяється негорючий газ із неприємним різким запахом. Коли цей газ пропустити через воду, то розчин змінює забарвлення індикатора метилоранжу на рожевий.
Якщо сульфатну кислоту розвести водою і також додати залізні ошурки, то починається бурхливе виділення газу. Цей газ легко спалахує від запаленого сірника.
1) Напишіть рівняння всіх описаних реакцій і назвіть гази, які виділяються в кожному випадку.
2) Визначте кількість електронів, які брали участь у процесі відновлення Сульфуру при взаємодії заліза з концентрованою сульфатною кислотою при нагріванні. Відповідь підтвердьте записом електронного балансу.
3) Чому залізо не взаємодіє з концентрованою сульфатною кислотою за звичайної температури та чому його треба очистити від іржі.
4) Визначте маси продуктів реакцій, які утворяться при взаємодії залізних ошурок масою 14 г з розведеною сульфатною кислотою масою 9,8 г
Розв’язування
- З концентрованою сульфатною кислотою під час нагрівання залізо реагує з утворенням сульфур(ІV) оксиду:
2Fe + 6H2SO4(к) ![]() Fe2(SO4)3 + 3SO2↑+ 6H2O
Fe2(SO4)3 + 3SO2↑+ 6H2O
Оксид SO2 – кислотний, тому під час розчинення у воді утворює відповідну валентності Сульфуру в його молекулі (ІV) сульфітну кислоту, яка і змінює забарвлення індикатора метилоранжу на рожевий:
SO2 + H2O ↔ H2SO3
З розбавленою кислотою залізо реагує з утворенням газу водню, який згоряє на повітрі:
Fe + H2SO4(розб.) = FeSO4 + H2↑
2H2 + O2 = 2H2O
0 + 6 +3 +6 +4
2) 2Fe + 6H2SO (к) →Fe2(SO4)3 + 3SO2↑+ 6H2O
Fe0-3e → Fe+3
2 – відновник, окиснення
S+6 +2e → S+4
3 – окисник, відновлення
У процесі відновлення беруть участь 2 електрона.
3) Залізо за звичайної температури не взаємодіє з концентрованою сульфатною кислотою, тому що концентрована сульфатна кислота пасивує залізо за рахунок утворення захисної оксидної плівки. А ось іржа – пухкий шар оксидів ігідроксидів – може вступати у взаємодію з кислотою.
4) Fe + H2SO4(розб.) = FeSO4 + H2↑
Отже, залізо взято для реакції в надлишку, тому обчислення будемо вести за сульфатною кислотою, яка є у нестачі.
n(H2SO4) = n(H2) = 0,1 моль
m(H2) = n ∙ M = 0,1 моль ∙ 2 г/моль = 0,2 г
m(FeSO4) = n ∙ M = 0,1 моль ∙ 152 г/моль = 15,2 г
n(Fe) = 0,25моль – 0,1моль = 0,15 моль
m(Fe) = 0,15 моль ∙ 56г/моль = 8,4 г
Відповідь: m(H2) = 0,2 г, m(FeSO4) = 15,2 г, m(Fe) = 8,4г.
- (15 балів) Кінцевим продуктом двох ланцюгів перетворення є сполука Z, яка у малих кількостях є життєво необхідною, оскільки збуджує дихальний центр мозку, а в дуже великих – пригнічує його. Напишіть рівняння реакції, що відповідають зазначеній нижче схемі:
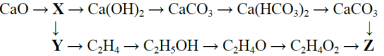
Виконайте завдання:
1)Визначте речовини X, Y, Z. Укажіть умови проходження реакцій.
2)Укажіть типи реакцій та назвіть усі продукти реакцій.
3)Для сполук С2Н5ОН, С2Н4О та C2H4O2 складіть усі можливі ізомери та назвіть їх.
Розв’язування



про публікацію авторської розробки
Додати розробку
