Урок фізики "Тверді тіла та їх властивості. Плавлення і кристалізація твердих тіл. Температура плавлення"
Чи замислювалися ви над тим, чому грудочка снігу, нагріта у руці, тане? А чи знаєте ви, чому утворюються крижані бурульки і коли вони утворюються – у відлигу чи, навпаки, в мороз? Як охолодити трохи снігу без морозильної камери? Чому шматок свинцю можна розплавити в сталевій ложці, а шматок сталі у свинцевій – ні? Через декілька уроків ви впевнено зможете давати відповіді на дані запитання. А сьогодні, ми познайомимося з твердим агрегатним станом речовини, його особливостями.
Тема. Тверді тіла та їх властивості. Плавлення і кристалізація твердих тіл. Температура плавлення
Мета уроку.
- Навчальна: ознайомити учнів із властивостями речовини в різних агрегатних станах, особливостями будови твердих тіл; плавленням та кристалізацією.
- Виховна: виховувати наполегливість, працьовитість, самостійність.
- Розвиваюча: розвивати уявлення учнів про процеси плавлення та кристалізації.
Основні поняття: кристалічні та аморфні тіла, кристалічна гратка, плавлення, кристалізація.
Обладнання: підручник, таблиця «Тверді тіла».
Тип уроку: вивчення нового матеріалу.
Хід уроку
І. Організаційний момент
 ІІ. Актуалізація опорних знань
ІІ. Актуалізація опорних знань
Бесіда «Теплові явища в моїй кімнаті».
Пригадайте, які теплові явища можна спостерігати кожного дня в звичайнісінькій квартирі? Яким чином відбувається обмін теплом між тілами в межах приміщення? Які види теплопередачі можна спостерігати?
ІІІ. Оголошення теми та мети уроку
Чи замислювалися ви над тим, чому грудочка снігу, нагріта у руці, тане? А чи знаєте ви, чому утворюються крижані бурульки і коли вони утворюються – у відлигу чи, навпаки, в мороз? Як охолодити трохи снігу без морозильної камери? Чому шматок свинцю можна розплавити в сталевій ложці, а шматок сталі у свинцевій – ні? Через декілька уроків ви впевнено зможете давати відповіді на дані запитання. А сьогодні, ми познайомимося з твердим агрегатним станом речовини, його особливостями.
ІV. Формування нових знань
Залежно від умов одна й та сама речовина може перебувати в різних агрегатних станах, наприклад рідкому, твердому чи газоподібному. Наочним прикладом цього слугує лід, вода, пара.
Ми знаємо, що молекули однієї й тієї самої речовини у різних агрегатних станах нічим не відрізняються одна від одної. Той або інший агрегатний стан речовини визначається розташуванням, характером руху та взаємодії частинок.
Тепловий рух частинок характеризується їх середньої кінетичною енергією, а вона, як відомо залежить від температури. Взаємодія пояснюється наявністю потенціальної енергії.
 Усі тверді тіла поділяють на кристалічні та аморфні.
Усі тверді тіла поділяють на кристалічні та аморфні.
Чим вони відрізняються? (Відповіді учнів).
 У твердих кристалічних тілах молекули розташовані в певному порядку й можуть лише здійснювати коливальний рух біля положення рівноваги.
У твердих кристалічних тілах молекули розташовані в певному порядку й можуть лише здійснювати коливальний рух біля положення рівноваги.
У рідинах молекули розташовані безладно, хоча й близько одна від одної. Рух молекул у рідині коливально-поступальний.
Молекули рухаються і взаємодіють одночасно, отже вони володіють одночасно і кінетичною і потенціальною енергією. А те бути тілу рідким, твердим чи газоподібним, залежить від обох видів енергії а зміна цього співвідношення й призводить до переходу речовини з одного стану в інший.
Складемо порівняльну таблицю властивостей речовини в різних агрегатних станах.
|
Стан |
Твердий |
Рідкий
|
Газоподібний |
|
Орієнтоване розміщення молекул |
Строга впорядкованість |
Хаотичне |
Хаотичне |
|
Вид руху |
Коливання навколо положень рівноваги |
Коливання з перескакуванням |
Безладний |
|
Відстані між молекулами порівняно з їх розмірами |
Менша |
Менша |
Значно більша |
|
Зберігання об’єму |
Так |
Так |
Ні |
|
Збереження форми |
Так |
Ні |
Ні |
|
Характерні особливості |
Пружні, крихкі, пластичні, тверді |
Нестисливість, текучість, набирає форму наданого посуду |
Заповнює весь наданий об’єм |
Якщо в морозний день набрати надворі трохи снігу й занести до теплої кімнати, то через деякий час він розтане, або, як кажуть фізики, розплавиться.
Плавлення — це процес переходу речовини з твердого стану в рідкий.
Простежимо зміну температури снігу в процесі його танення в теплій кімнаті. На початку досліду температура снігу є нижчою за 00С, сніг не тане, а його температура швидко збільшується. Щойно стовпчик термометра досягає позначки 0°С, температура перестає збільшуватись, а в склянці починає з'являтися вода (сніг починає плавитися). Обережно перемішаємо воду із залишками снігу й відзначимо, що температура суміші залишається незмінною. І тільки після того як сніг повністю розплавиться, температура знову починає зростати.
З цього досліду можна зробити щонайменше два висновки: по-перше, під час плавлення температура снігу не змінюється; по-друге, сніг починає плавитися тільки після досягнення ним температури 0°С.
Досліди показують: практично всі кристалічні речовини плавляться після досягнення певної температури, і в процесі їхнього плавлення температура не змінюється.
Температура плавлення — це температура, за якої тверда кристалічна речовина переходить у рідкий стан.
Так само як тверда речовина в разі досягнення певної температури перетворюється на рідину, рідини за певних умов тверднуть (кристалізуються). Наприклад, якщо ми винесемо воду на мороз або поставимо посудину з водою у морозильну камеру, то вода з часом кристалізується, перетворюючись на лід.
Кристалізація — це процес переходу речовини з рідкого стану в кристалічний.
Вимірюючи температуру речовин у процесі їх охолодження й подальшої кристалізації, доходимо висновків, які аналогічні висновкам щодо плавлення речовини: по-перше, в процесі кристалізації температура речовини не зміниться; по-друге, процес кристалізації починається тільки після охолодження рідини до певної температури.
Вимірювання показують, що температура кристалізації дорівнює температурі плавлення.
Температури плавлення та кристалізації різних речовин досить сильно відрізняються.
|
Речовина |
t, 0С |
|
Речовина |
t, 0С |
|
Водень |
-256 |
|
Алюміній |
660 |
|
Спирт |
-115 |
|
Срібло |
962 |
|
Ртуть |
-39 |
|
Золото |
1065 |
|
Лід |
0 |
|
Мідь |
1087 |
|
Парафін |
55 |
|
Чавун |
1200 |
|
Нафталін |
80 |
|
Сталь |
1400 |
|
Олово |
232 |
|
Залізо |
1535 |
|
Свинець |
327 |
|
Титан |
1660 |
|
Цинк |
420 |
|
Вольфрам |
3387 |
У наведеній таблиці немає аморфних речовин, бо вони, як вам уже відомо із 7-го класу, не мають певної температури плавлення: нагріваючись, вони поступово м'якшають, а в ході охолодження поступово густішають. Надалі, вивчаючи процеси плавлення та кристалізації, ми розглядатимемо тільки кристалічні речовини.
Якщо провести дослід із таненням снігу в холодильній камері, температура в якій є сталою й дорівнює 0°С, з'ясується таке.
Як і в досліді з таненням снігу в теплій кімнаті, температура снігу буде спочатку збільшуватися (правда, повільніше). Це означає, що збільшується внутрішня енергія снігу. Адже температура в камері вища від температури снігу, тому більш нагріте повітря в ній віддає певну кількість теплоти менш нагрітому снігу. Збільшення температури триватиме доти, доки температура снігу не досягне 0°С. І отут починається найцікавіше. Температура снігу сягнула температури плавлення, а сніг не тане. Чому?
Згадайте: перший дослід проводився в теплій кімнаті (температура в якій була вищою від 0°С. Отже, протягом усього часу спостереження відбувався теплообмін між повітрям у кімнаті та снігом. При цьому весь час сніг одержував енергію, зокрема й тоді, коли його температура залишалася незмінною. І сніг при цьому танув. У другому досліді температура плавлення снігу й температура повітря в холодильній камері є однаковими тому теплообмін не відбувається. Сніг не одержує енергії, отже, й не тане.
Робимо висновок: щоб речовина плавилася, потрібно, щоб вона отримувала енергію. А це означає, що за однакової температури внутрішня енергія речовини в рідкому стані більша від внутрішньої енергії речовини у твердому стані.
Отже, якщо до холодильної камери з температурою повітря 0°С помістити теплу воду, то температура води буде зменшуватися до 0°С (тепла вода віддає енергію повітрю в камері). Однак після досягнення 0°С вода не кристалізуватиметься, оскільки тепер, щоб перейти в стан із меншою внутрішньою енергією, їй потрібно віддати довкіллю деяку кількість теплоти, а у випадку теплової рівноваги теплообмін не відбувається.
Для більш детального вивчення процесів плавлення та кристалізації речовини розглянемо графік залежності температури кристалічної речовини (льоду) від часу її нагрівання або охолодження.
Ділянка графіка від точки А до точки D відповідає передачі певної кількості теплоти від нагрівника речовині, а отже, відповідає збільшенню внутрішньої енергії речовини. Ділянки від точки D до точки К відповідає передачі теплоти від речовини холодильнику, а отже, відповідає зменшенню внутрішньої енергії речовини.
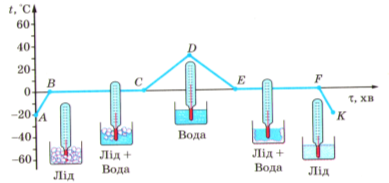
З графіка видно, що в момент початку спостереженим (точки А) температура льоду становила -20°С. Під час подальшої роботи нагрівника температура льоду збільшується (ділянка АВ). З погляду атомно-молекулярної теорії в цей час збільшується кінетична енергія коливального руху молекул води у вузлах кристалічної ґратки льоду.
Після досягнення температури 0°С лід починає плавитися, температура речовини не змінюється (ділянка ВС), незважаючи на те що нагрівник продовжує працювати й передавати льоду певну кількість теплоти. Уся енергія, що надходить від нагрівники, іде на руйнування кристалічної ґратки льоду. У цей проміжок часу внутрішня енергія льоду зростає тільки за рахунок збільшення потенціальної енергії молекул.
Після того як весь лід розплавився й перетворився на воду (точка С), температура знову почала збільшуватися (ділянка СD), тобто почала зростати кінетична енергія руху молекул.
У той момент, коли температура сягнула 30°С (точка D), нагрівник вимкнули. Воду помістили в холодильник, і її температура почала падати (ділянка DЕ). Зниження температури свідчить про те що кінетична енергія, а отже, швидкість руху молекул зменшуються
Коли досягнуто температури кристалізації 0°С (точка Е), швидкість молекул зменшується настільки, що вони вже не можуть перестрибувати з місця на місце. Вони поступово займають фіксоване положення (ділянка ЕF), і до моменту завершення кристалізації вже всі молекули коливаються тільки біля положення рівноваги.
Вода переходить у стан із меншою внутрішньою енергією — повністю перетворюється на лід (точка F).
Під час подальшої роботи холодильника замерзла вода (лід) холоне, а кінетична енергія коливального руху молекул зменшується (ділянка FК).
V. Закріплення вивченого матеріалу
Виконування вправ:
- Чи можна розплавити сталь у свинцевій ложці? Обґрунтуйте свою відповідь.
- У відрі з водою плавають шматки льоду. Що відбуватиметься: танутиме лід чи замерзатиме вода? Від чого це залежить?
-
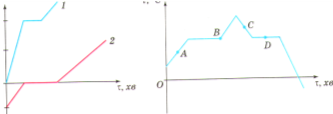 На рисунку подано графіки плавлення деяких речовин. У якої із них вища температура плавлення? Яка з речовин мала вищу початкову температуру?
На рисунку подано графіки плавлення деяких речовин. У якої із них вища температура плавлення? Яка з речовин мала вищу початкову температуру?
- На рисунку наведено графіки плавлення та кристалізації певної речовини. Якому стану речовини відповідають точки А, В, С, і D графіка?
VІ. Підсумок уроку
Інтерактивна вправа «Коло знань»
Учитель починає фразу, учень закінчує її і починає нове твердження – продовжує ланцюжок і т.д.
Наприклад:
Плавлення -…
Температура плавлення - …
VІІ. Домашнє завдання
Опрацювати відповідний параграф підручника.
Експериментальне завдання***:
Змішайте 100г льоду за температури 00С з 30г кухонної солі (1стлова ложка з гіркою). Сніг почне танути швидко й холонути. Якщо в такий розчин опустити шматок картоплини, то він змерзне. Поясніть чому. (Температура замерзання солі набагато менша, ніж температура замерзання води.)
![]()


про публікацію авторської розробки
Додати розробку
