Урок "Хімічні формули речовин. Прості та складні речовини. Багатоманітність речовин".
Урок "Хімічні формули речовин. Прості та складні речовини. Багатоманітність речовин" складаний з використання технології критичного мислення. До складу уроку входять: тест з наданням відповіді "так" або "ні", посилання на відео хімічного експерименту, завдання до експерименту, рефлексія з використанням методу ПМЦ
7 клас
Тема уроку : Хімічні формули речовин. Прості та складні речовини. Багатоманітність речовин. (слайд 1)
Очікувані результати: учень\ учениця
- наводить приклади простих і складних речовин,
- пояснює зміст хімічних формул,
- розрізняє фізичні тіла, речовини, матеріали, чисті речовини і суміші, прості й складні речовини, металічні та неметалічні елементи, використовуючи періодичну систему; метали й неметали, атоми, молекули;
- описує якісний і кількісний склад речовин за хімічними формулами;
- висловлює судження про багатоманітність речовин,
- робить висновки на основі спостережень (за допомогою вчителя).
Тип уроку: Урок з використанням технології критичного мислення.
Обладнання: комп’ютер, екран
Частина 1 Актуалізація опорних знань
«Так чи ні»
Кожен учень отримає текст, де повинен на кожне запитання відповісти «так» або «ні»
Прізвище, ім’я ________________клас ________ Дата_________
- Матеріал - речовина, яку використовують для виробництва інших хімічних речовин
- Властивості речовини це певні ознаки, за якими речовини або відрізняються, або схожі одне з одним.
- Властивості бувають лише фізичні.
- Запах, розчинність у воді, блиск, температура плавлення – це фізичні властивості
- Вода може існувати лише у двох агрегатних станах: рідкий та газуватий.
- Чиста речовина індивідуальна та не містить домішок інших речовин
- Суміші бувають лише однорідними
- Молекула – найменша частинка речовини, що має її основні хімічні властивості та може існувати самостійно
- Атом – найдрібніша частинка речовини, що складається з позитивно зарядженого ядра та негативно зарядженої електронної оболонки
- Атом, що має заряд, називається йоніт
- Хімічній елемент – вид атому з певним зарядом ядра.
- Заряд ядра чисельно дорівнюється відносній атомній масі
Перевірка : можливі варіанти – самоперевірка або взаємоперевірка. Учитель виводить на екран текст з вірними відповідями (слайд 2).
- Матеріал - речовина, яку використовують для виробництва інших хімічних речовин НІ
- Властивості речовини це певні ознаки, за якими речовини або відрізняються, або схожі одне з одним. ТАК
- Властивості бувають лише фізичні. НІ
- Запах, розчинність у воді, блиск, температура плавлення – це фізичні властивості ТАК
- Вода може існувати лише у двох агрегатних станах: рідкий та газуватий.НІ
- Чиста речовина індивідуальна та не містить домішок інших речовин ТАК
- Суміші бувають лише однорідними НІ
- Молекула – найменша частинка речовини, що має її основні хімічні властивості та може існувати самостійно ТАК
- Атом – найдрібніша частинка речовини, що складається з позитивно зарядженого ядра та негативно зарядженої електронної оболонки ТАК
- Атом, що має заряд, називається йоніт НІ
- Хімічній елемент – вид атому з певним зарядом ядра. ТАК
- Заряд ядра чисельно дорівнюється відносній атомній масі НІ
Частина 2 Мотивація пізнавальної діяльності.
Усі відомі нині речовини, а їх вже понад 20 000 000 утворені атомами різних хімічних елементів. Серед такої великої кількості речовин потрібна якась класифікація. Я наведу вам тільки декілька: прості та складні, органічні та неорганічні, метали та неметали. Та вважаю, що ви самі можете визначити та класифікувати речовини за певними ознаками. Спробуємо?
Частина 3. Вивчення нового матеріалу.
Серед наведених ілюстрацій прошу вас визначити прості та складні речовини та обґрунтувати свій вибір. (слайд 3)
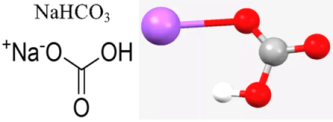
Харчова сода
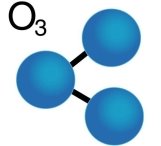
Озон
Звісно, перша речовина – складна, а друга проста.
Отже – визначення простої речовини : (учитель виводить на екран визначення без ключових слів) Доповніть, будь ласка, визначення (слайд 4)
Проста речовина - хімічна сполука, утворена атомами ОДНОГО хімічного елементу.
Складна речовина – хімічна сполука, утворена атомами РІЗНИХ хімічних елементів
Проста речовина має формулу О3. Нагадайте, що таке цифра 3 у цьому запису та що вона означає?
Відповідь виводиться на екран без ключових слів: (слайд 5)
О3: Три - це ІНДЕКС, вказує на кількість АТОМІВ оксигену в молекулі озону.
А якщо я зміню надпис на 2О3, то що означає цифра 2?
2О3 : Два – КОЕФІЦІЄНТ, вказує на кількість МОЛЕКУЛ озону.
Ще одна речовина, з якою кожен день має справу людство. Прошу вас переглянути дослід (https://www.youtube.com/watch?v=gIUOlOUwgNk&vl=ru, 2.43 хв.) , занотувати спостереження та відповісти на питання (виводяться на слайд 6) :
- Яка формула речовини?
- Якою є ця речовина – складною чи простою?
- Скільки усього атомів входить до її складу ( кількісний склад)
- Які види атомів входять до її складу ( якісний склад)
- Чому об‘єм газу у одній пробірці у два рази менше, ніж у другій?
- Як ви вважаєте, до якого типу реакцій можна віднести цей дослід ( обмін, заміщення, розклад, з’єднання)?
Відповіді на ці питання прошу викласти у формі інформаційного повідомлення у ваших зошитах : «Увага, вода» (текст виводиться на слайд 7 без ключових слів)
Формула води Н2О, вода – складна речовина, до її кількісного складу входять 2 атоми гідрогену та 1 атом оксигену, якісний склад – атоми гідрогену та атоми оксигену, об’єм газу у одній пробірці у два рази менше тому, що у цій пробірці виділявся кисень, а його лише один атом у молекулі води, тоді як гідрогену в два рази більше атомів. Цей опит можна віднеси до реакції розкладу.
Перевірка тексту – на екрані слайд з усіма ключовими словами. (слайд 8)
Частина 4. Рефлексія.
У чому ж причина багатоманітності речовин? Прошу Вас прочитати наданий текст (http://shkolyar.in.ua/bagatomanitnist-rechovyn7) та під час читання знаком «+» позначати те, що вам зрозуміло, що ви знаєте, знаком « - « те, що не знав, або ви не згодні, та знаком «?» незрозумілі поняття, формули та інше.
Текст: Багатоманітність речовин.
Прості та складні речовини. Метали та неметали
Зараз відомо понад 20 мільйонів речовин. Хіміки щодня синтезують нові сполуки. Речовини можуть бути простими та складними. До складу простих речовин входять атоми тільки одного елемента. Речовини, молекули яких складаються з атомів різних елементів, пов’язаних між собою постійними співвідношеннями, називають складними речовинами. Складні речовини також називають хімічними сполуками. Наприклад, до складу кисню O2 входять атоми тільки елемента Оксигену. Кисень належить до простих речовин. До складу вуглекислого газу CO2 входять атоми різних елементів: один атом Карбону та два атоми Оксигену. Вуглекислий газ належить до складних речовин.
Дуже важливо розрізняти поняття “хімічний елемент” і “проста речовина”. Наприклад, Карбон як хімічний елемент – це просто вид атомів, який має заряд ядра плюс шість, він може входити до складу простих речовин (графіт, алмаз та ін.) або складних речовин (харчова сода NaHCO3 , крейда CaCO3 . Крім того, необхідно розрізняти поняття “суміш” і “складна речовина”. Речовини, які входять до складу суміші, зберігають свої індивідуальні властивості, тоді як властивості складної речовини суттєво відрізняються від властивостей простих речовин, утворених тими ж самими хімічними елементами.
За своїми властивостями прості речовини поділяються на метали та неметали. Чіткої межі між металами та неметалами не існує. Метали – це ковкі, пластичні речовини, що мають металічний блиск, здатні проводити тепло та електричний струм. Спільні властивості металів пояснюються їх подібною внутрішньою будовою. Їх атоми утворюють особливий тип атомних кристалів, які називаються металічними кристалами. Неметали – це хімічні елементи, які утворюють у вільному стані прості речовини, що не виявляють фізичних властивостей металів. Неметали не мають такої схожості у властивостях, як метали. Наприклад, такі метали як алюміній, залізо, срібло мають сріблясто-білий або сірий колір, металічний блиск. Порівняємо деякі неметали: водень – газ, сірка – тверда речовина, алмаз– дуже міцний, але крихкий.
Для всіх металів характерна немолекулярна будова. Для неметалів найбільш характерна молекулярна будова, але зустрічаються неметали й атомної будови (алмаз та силіцій). У періодичній системі металічних елементів значно більше, ніж неметалічних. Неметалічні елементи переважно розміщені у правій частині періодичної системи.
Прошу висловитися з приводу питання : Чому речовин так багато та вони такі різні? Відповідь прошу починати словами «Тому що..» Учитель на дошці записує висловлювання учнів, узагальнення на слайді 9.
- Атоми з’єднуються у прості та складні речовини
- Окрім речовин існують суміші, до складу яких входять речовини
- Прості речовини поділяються не метали та неметали.
Частина 5.
Оцінювання досягнень учнів. Оцінкою учня є сума балів за кожну з частин уроку.
Частина 6.
Домашнє завдання.
- Прочитати відповідний параграф підручника.
- Завдання на розподіл речовин на прості та складні, метали та неметали.
- У стародавні часи вважалося, що існує лише 7 металів. Алхіміки за допомогою «філософського каменя» намагалися перетворити будь який метал на золото. Що це за сім металів?


про публікацію авторської розробки
Додати розробку
