Урок "Хімічні властивості етанової кислоти (оцтової). Застосування оцтової кислоти"
Тема: хімічні властивості етанової кислоти (оцтової). Застосування оцтової кислоти
Цілі уроку: закріпити знання про молекулярну та структурну формули оцтової кислоти, функціональну карбоксильну групу карбонових кислот, повторити фізичні властивості карбонових кислот;
вивчити хімічні властивості оцтової кислоти, її застосування;
розвивати навички складати рівняння реакцій , що характеризують хімічні властивості оцтової кислоти, доводити дослідним шляхом її кислотні властивості ; розуміти суть і типи записаних реакцій.
Очікувані результати: учні повинні вміти записувати формули органічних кислот, характеризувати їх, чітко пояснювати фізичні і хімічні властивості оцтової кислоти, знати способи і методи застосування на практиці.
Обладнання:мультимедійний проектор, комп’ютер, роздатковий матеріал, реактиви і обладнання для проведення л/д : пробірки, штатив, метиловий оранжевий, фенолфталеїн, магній , натрій гідроксид, натрій карбонат, етанова кислота, етанол.
Тип уроку: Вивчення нового матеріалу.
Форми проведення:урок-гра: лекція, бесіда,Мозковий штурм», прийом „ Світлофор”,
„відстрочена відгадка”, лабораторний дослід, гра «Впізнай речовину»
Хід уроку:
І. Організація класу.
Мешканці Гренландії під час зустрічі одне одному говорять: «Гарна погода!», навіть якщо за вікном 40 градусів і дме сирий вітер! Привітаймося по-гренландськи!
Перевірка готовності учнів до уроку. Налаштування на робочий лад.
Прийом «Індикатор настрою». На парті лежать кольорові служки. На екрані пояснення який колір відповідає якому настрою.(слайд 1) Прислухайтеся до своїх відчуттів? Піднімають той колір, який відповідає вашому настрою.
- Добре більша частина учнів налаштована на роботу. Спробуємо провести урок так, щоб до кінця уроку у всіх учнів настрій був ось таким…(вчитель піднімає гірчичну смужку. )
Щоб наш урок вдався плідним, нам потрібно попрацювати організовано, і повинні бути уважні , кмітливі, допитливі.
ІІ. Актуалізація опорних знань.
Для старту нашої роботи пропоную пригадати попередній матеріал.
Прийом „ Світлофор”, коли учні піднімають картки з зеленим кольором, коли „ТАК” і червоним кольором , коли „ НІ”.
- Спирти –це органічні сполуки, які містять гідроксогрупи.
- Одноатомні спирти містять одну гідроксогрупу.
- Гліцерин відноситься до одноатомних спиртів.
- Спільна властивість спиртів –взаємодія з активними металами.
- Всі спирти можна виявити за допомогою свіже виготовленого розчину купрум (ІІ) гідроксиду.
- Етанол можна застосовувати для пом’якшення шкіри.
- Гліцерин можна застосовувати для пом’якшення шкіри.
- Етанол і гліцерин застосовують у парфумерії.
- Метанол відносять до багатоатомних спиртів.
- Метанол –отрута.
Вправа - «Перевірялки»
«Карбонові кислоти»
1. Загальна формула карбонових кислот:
в) СnH2n +2OН
о) CnH2n СOH
п) CnH2nО2
2.Речовина СН3 – (СН2)5 – СООН називається:
д) пентанова кислота
е) гептанова кислота
є) пропанова кислота
3. Яка речовина не належить до карбонових кислот:
л) С4Н 8О2
м) С3Н6О2
н) С3Н7О
4. Яку карбонову кислоту можна отримати зі спирту пропанолу:
с) оцтову кислоту
т) пропанову кислоту
у) пентанову кислоту
5. Скільки ізомерів має оцтова кислота:
а) не має
б) один
в) два
6. Оцтову кислоту можна отримати:
л) гідратацією алкенів
м) гідратацією алкінів
н) окисненням спиртів
Виграшний шлях – слово, яке означає вуглеводень - алкан. Знайдіть його і складіть формулу відповідної карбонової кислоти (відповідь – пентан – пентанова)
ІІІ. Мотивація навчальної діяльності.
Вступне слово вчителя.
Сьогодні на уроці ми будемо не тільки учнями, але й хіміками-криміналістами та слідчими «особової справи». Ми з’ясуємо, чи насправді були причетні солі оцтової кислоти та карбонати до смерті великої цариці Єгипту Клеопатри. І, хоча й пройшло дуже багато часу, саме сьогодні для вас настав той момент, коли хімія, велична наука, допоможе пролити світло на цю історичну подію, яка довгий час була вкрита оманою.
Постановка завдання.
Що ж відбулося в ті далекі часи?
«…Вона вийняла з вуха одну з тих великих перлин і … опустила перлину в вино (оцет, оцтову кислоту). Настало мовчання, приголомшені гості, завмерши, спостерігали, як незрівняна перлина повністю розчиняється в вині (оцтовій кислоті). Ось від неї не залишилося й сліду, і тоді Клеопатра підняла келих, покрутила його, збовтуючи вино, і…випила його до останньої краплинки…» (уривок з роману Г.Р.Хаггарда «Клеопатра»)
…Невдовзі після цього Клеопатру знайшли мертвою в її оселі. Що ж стало причиною смерті великої богині Єгипту?
- Який напій випила Клеопатра?
- Чому перлина розчинилася?
- Що потрібно знати, щоб відповісти на ці питання? (Склад речовин та їх хімічні властивості)
ІV. Вивчення нового матеріалу.
Оголошення теми уроку.
Озвучення мети уроку, та актуальність теми
Якщо ця тема на вашу думку актуальна підніміть праву руку, якщо ні то підніміть ліву руку
Очікуванні результати
Вправа «Огірочки»
На дошці прикріплена банка. У кожного учасника є огірок, на якому треба написати що він очікує від даного уроку. Огірки лежать навколо банки. По завершенні ті сподівання, що справдилися, покладіть до банки.
Хімічні властивості ми будемо вивчати супроводжуючи демонстраціями, а для цього необхідно повторити правила техніки безпеки.
Хімічні властивості оцтової кислоти.
Учні разом з вчителем проводять досліди і записують в зошит.
Дослід №1. Дія оцтової кислоти на індикатори.
- Який індикатор змінює свій колір??
Дослід №2. Взаємодія оцтової кислоти з металами.
- Як відбувається реакція? (Бурхливо)
- Що утворилося в результаті реакції (виділяється газ - водень)
2СН3СООН + Mg = (CH3COO) Mg + H2 ↑
Дослід №3 Взаємодія оцтової кислоти з лугами.
- Що відбувається з розчином лугу при дії на нього індикатора.
- Що відбувається з розчином при додаванні оцтової кислоти
СН3СООН + NaOH = CH3COONa + H2 O
Дослід №4 Взаємодія оцтової кислоти з солями.
- Що утворюється в результаті реакції?.
2CН3СООH + Na2CO3=2CH3COONa + CO2 ↑+2H2O
Дослід №5 Взаємодія оцтової кислоти з спиртом.
- Що утворюється в результаті реакції?.
СН3СООН + НОС2Н5→ СН3СООС2Н5 + Н2О
Клас обєднується в групи.(групи утворюються за місяцями весни) Завдання для кожної групи: пригадати якомога більше випадків застосування оцту в домашніх умовах. Результати роботи учні записують на окремому аркуші паперу. Один представник від групи звітує про виконану роботу.
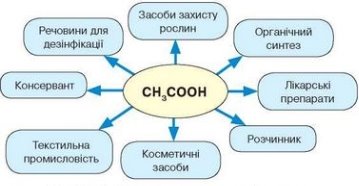
V. Узагальнення та закріплення знань
Гра «П’ятий зайвий».
Серед запропонованих органічних сполук знайти зайвий, який не належить до даного гомологічного ряду, назвати речовини.
Алкани Спирти Карбонові кислоти
С2Н6 С3Н7ОН С2Н5 СООН
С4Н10 СН3ОН С2Н6
СН3СООН С2Н2 С4Н9 СООН
С3Н8 С2Н5ОН СН3 СООН
С5Н12 С4Н9ОН Н СООН
Гра «Куб».
Записати рівняння реакцій між оцтовою кислотою і речовинами, зображеними на боках куба:
1) Mg Ca Fe KOH LiOH Ca(OH)2
2) Zn Ba Al Na2SO4 NaOH KBr
Прийом «Хімічна естафета».
Учитель об’єднує клас у команди (за числом рядів) і видає учням, що сидять за першими партами, своєрідну естафетну паличку (аркуш із завданням). Учні по черзі виконують завдання. Перемагає команда, яка першою правильно виконала всі завдання.
Закінчіть рівняння реакцій і назвіть продукти реакції:
Ca + CH3COOH ;
K2O + CH3COOH ;
Ba(OH)2 + CH3COOH ;
CH3COOH + CaCO3 ;
CH3COOH + CH3OH .
Учитель: Запитання класу.
1. Так чи могла насправді відбутися історія, про яку ми говорили на початку уроку (про Клеопатру)?
2. Який хімічний склад мають перли? (CaCO3)
3. Чи можуть вони розчинятися у розчині оцтової кислоти? (Так)
4. Чи не зашкодив отриманий напій здоров’ю цариці? Чому? (Ні!)
VI. Рефлексія
- Чи справдилися ваші очікування від сьогоднішнього уроку?
- Чи досягли ми мети урока?
- Які нові знання ви отримали сьогодні?
- Що не вдалося засвоїти?
- Хто, на вашу думку, найкраще працював?
- Продовжіть речення: «Інформація, отримана на уроці……»
Аналіз очікування
Якщо ваші очікування виправдались, то покладіть ваш огірок до банки, якщо ж ні то хай залишиться на місці
VIІ. Домашнє завдання
Опрацювати § 27 підручника (початковий і середній рівень)
Вправа 245 (достатній)
Творче завдання: підготувати з допомогою батьків рецепти консервування овочів, де використовується оцтова кислота(оцет).(високий рівень знань)
Дякую всім за співпрацю!


про публікацію авторської розробки
Додати розробку
