Урок "Значення окисно-відновних процесів у житті людини,природі і техніці"
1
Тема:Значення окисно-відновних процесів у житті людини,природі і техніці
Мета: розкрити роль окисно-відновних реакцій в природі, техніці та житті людини;
продовжити відпрацювання навичок визначення ступеня окиснення елементів, окисника і відновника в рівняннях реакції, урівнювання реакції методом електронного балансу;
розвивати пізнавальну активність учнів, хімічну мову, мислення, сприяти розширенню їх світогляду, формувати життєві компетенції, виховувати творче ставлення до практичного використання знань з хімії.
Очікувані результати: учні мають складати електронний баланс для окисно-відновних реакцій; учні мають уміти визначати окисник і відновник за рівняннями хімічних реакцій; учні мають наводити приклади застосування окисно-відновних реакцій у природі та житті людини.
Базові поняття та терміни: ступінь окиснення, окисник, відновник, процеси окиснення і відновлення, окисно-відновні реакції, метод електронного балансу.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва, алгоритмічні приписи про послідовність визначення ступеня окиснення елементів та про складання рівнянь методом електронного балансу, комп’ютер, проектор, папір, олівці.
Тип уроку: закріплення й вдосконалення знань, умінь і навичок.
Хід уроку
- 1. Організаційний момент
1.1. Привітання.
1.2. Перевірка присутності учнів: кількість за списком, кількість присутніх на уроці, відсутніх.
1.3. Перевірка готовності учнів до уроку.
1.4. Налаштування на позитивний настрій. Вправа «Чарівна скринька»
- 2. Етап перевірки домашнього завдання
2.1. Перевірка наявності в учнів виконаних письмових робіт. Обговорення запитань, що виявилися найбільш складними.
2.2. Експрес – контроль
Учні отримують картки із тестами. Тести учні виконують самостійно, а потім взаємоперевірка виконаної роботи.
1. Метали мають такі ступені окиснення:
А. нульовий;
Б. позитивний;
В. негативний.
2. Окисно-відновні реакції, це реакції, в яких:
А. не змінюється ступінь окиснення елементів;
Б. змінюється ступінь окиснення елементів;
В. визначення належності до окисно-відновних реакцій не пов’язано із ступенем окиснення елементів.
3. Відновники – це атоми, молекули або йони, що:
А. приєднують електрони;
Б. віддають електрони;
В. здатні і віддавати і приєднувати електрони.
4. Окисники – це атоми, молекули або йони, що:
А. приєднують електрони;
Б. віддають електрони;
В. здатні і віддавати і приєднувати електрони.
5. Відновлення – це процес :
А. приєднання електронів ;
Б. віддавання електронів;
В. не пов’язаний із переходом електронів.
6. Який процес відбувається в зазначеній схемі 2Н+1 + 2е ¯→ Н02
А. відновлення;
Б. окиснення.
7. При відновленні ступінь окиснення елемента:
А. зменшується;
Б. збільшується ;
В. не змінюється.
8. Елемент з найнижчим ступенем окиснення може бути:
А. тільки відновником;
Б тільки окисником;
В. і відновником і окисником;
9. Елемент з найвищим ступенем окиснення може бути:
А. тільки відновником;
Б тільки окисником;
В. і відновником і окисником;
10. Елемент проміжним ступенем окиснення може бути:
А. тільки відновником;
Б тільки окисником;
В. і відновником і окисником;
11.Укажіть схему, що відповідає перетворенню N0 →N-3:
А. 1S22S22P3 – 3e- →1S22S2;
Б. 1S22S22P3 + 3e- → 1S22S22P6;
В.1S22S22P5 + 1e- → 1S22S22P6;
Г. 1S22S22P3 – 3e- → 1S22S22P6.
12. Вкажіть кількість електронів,відданих або приєднаних атомом в схемі S-2→ S+6 :
А. 2е-;
Б. 6е-;
В. 8е-.
Відповіді:
1. А, Б 2. Б 3. Б 4. А 5. А 6. А 7. А 8. А 9. Б 10. В 11. Б 12. В
- 3. Актуалізація опорних знань та мотивація навчальної діяльності
3.1. Технологія «Мікрофон».
— Наведіть приклади окисно-відновних реакцій. Де в природі відбуваються окисно-відновні реакції?
3.2. Показ практичного значення вивчення нового матеріалу.
Слово вчителя
Навколишній світ — це гігантська «хімічна лабораторія». Наше життя постійно супроводжується хімічними реакціями. Багато природних процесів належить до окисно-відновних реакцій: утворення гірських порід і мінералів, згоряння метеоритів, реакції в атмосфері під час грози, процеси дихання, фотосинтезу, обміну речовин тощо. Не менш важливими є окисно-відновні процеси, що використовуються в промисловості та техніці.
3.3. Повідомлення теми уроку. Розташувати слова відповідно до кольорів веселки.
Червоний – Значення
Оранжевий – окисно-відновних
Жовтий – процесів
Зелений – у житті
Блакитний – людини,
Синій – природі
Фіолетовий – і техніці.
3.4. Очікувані результати. На стікерах записати що ви очікуєте від сьогоднішнього уроку
3.5. Формулювання разом з учнями мети уроку.
3.6. Актуальність теми. За допомогою кружечків червоного, жовтого і земного кольору визначити наскільки актуальна дана тема. Зелений колір – дуже актуальна; жовтий – посередньо; червоний – неактуальна.
- 4. Етап засвоєння нових знань
Об’єднати дітей у три групи: людина, природа, техніка.
Вправа «Розсипаний текст». Скласти текст з речень, відповідно до цього тексту зробити на ватмані опорний конспект.
Перша група: значення окисно-відновних процесів у житті людини.
Окисно-відновні реакції найбільш поширені і відіграють значну роль у природі. Вони є основою життєдіяльності, адже з ними пов’язані найважливіші функції живої системи – це дихання, обмін речовин, фотосинтез у рослин. Під час дихання органічні речовини окиснюються до кінцевих продуктів- вуглекислого газу і води, використовуючи для цього кисень.А під час фотосинтезу вуглекислий газ відновлюється в органічних сполуках, а кисень вивільняється у повітря.
Процеси гниття, бродіння, тління, утворення перегною; утворення мінеральних солей з перегною в ґрунті - це все окисно-відновні реакціії. Дуже велике значення окисно-відновних реакцій в природі полягає в тому, що за допомогою цих реакцій постійно відбувається кругообіг всіх хімічних елементів, які входять до складу живих організмів: Оксигену, Карбону, Нітрогену, Гідрогену.
Процес фотосинтезу:
6C+4O2-2 + 6H2+1O-2 = C60H12+1O6-2 + 6O20
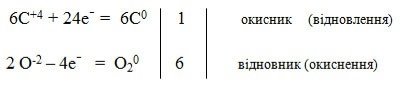
Друга група: значення окисно-відновних реакцій в природі.
Окисно-відновні реакції мають велике значення і в житті людини - це отримання тепла в наших домівках при спалюванні вугілля, дров, газу; добування багатьох органічних речовин; виробництво цілого ряду будівельних матеріалів; виробництво лікарських препаратів, харчових та кормових добавок, вітамінів, гормонів, ферментів; виробництво кисло-молочних продуктів, сирів, пива, спирту, і багатьох інших продуктів.
Природоохоронні заходи, які застосовують для очищення навколишнього середовища, а саме стічних вод і ґрунту від побутового і промислового забруднення ґрунтуються на процесах окиснення та відновлення. Певні види бактерій здатні розкладати, мінералізувати органічні сполуки, які потрапляють у воду та грунт.
Окисно-відновна реакція спалювання вугілля:

Третя група: значення окисно-відновних реакцій в техніці.
Значення окисно-відновних реакцій в техніці дуже велике. Більшість рідкісних, важливих в техніці металів(нікель, вольфрам, молібден, хром, алюміній та інш.) отримують за допомогою окисно-відновних реакцій. Лужні метали такі як натрій, калій, лужноземельні – кальцій, барій отримують шляхом електролізу із їх солей. В основі електролізу лежать теж окисно-відновні реакції.
Виробництво чавуну, сталі, добування деяких неметелів: фосфору, хлору, йоду; добування амоніаку, нітратної та сульфатної кислот ґрунтується також на окисно-відновних процесах.
Дуже негативний процес відбувається в техніці з метелами теж на основі окисно-відновних реакцій – це корозія (руйнування) металів, утворення іржі. Для того, щоб уникнути цього явища застосовують захисні покриття.
Горіння палива в топках теплових електростанцій, в двигунах внутрішнього згорання та багато інших прикладів можна привести окисно-відновних процесів в техніці.
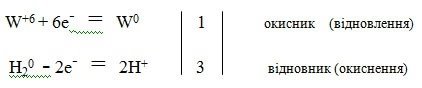
Реакція добування вольфраму:
W+6O3-2 + 3H20 = W0 + 3H2+1O-2
- 5. Узагальнення й систематизація знань
5.1. Окисно-відновні реакції: добро чи зло? (Дискусія)
Зло: псування продуктів; пожежі; вибухи; корозія; забруднення довкілля.
Добро: засвоєння їжі; утворення перегною; добування металів з їх руд.
5.2. Доберіть коефіцієнти у схемах окисно – відновних реакцій методом електронного балансу, вкажіть окисник і відновник, процеси окиснення та відновлення.
1. Na + H2O → NaOH + H2 ;
2. Fe2O3 + H2 → Fe + + H2O;
3. KClO3 → KCl + O2 ;
4. Ag + HNO3 → AgNO3 + NO2 +H2O;
5. PH3 + O2 → P2O5 + H2O;
6. H2S + HNO3 → H2SO4 + NO2 + H2O
5.3. Рефлексія
1. Що нового дізнались на уроці?
2. чи все було зрозуміло?
3. Чи сподобався урок?
- 6. Домашнє завдання.
Опрацювати параграф 21 с. 130
- 7. Підбиття підсумків уроку
Підсумкова бесіда
— Яке завдання стояло перед нами на уроці?
— Який результат нашого уроку?


про публікацію авторської розробки
Додати розробку
