Урок "Карбонатна кислота."
Дата __/___/_____ Взвод ____
Тема: Карбонатна кислота. Солі карбонатної кислоти, їх поширення в природі та застосування.
Мета уроку: вивчити склад та властивості карбонатної кислоти, з’ясувати, які два ряди солей вона утворює; розкрити роль карбонатів у природі та житті людини; розвивати навички самостійної роботи, логічне мислення, уміння робити висновки на основі спостереження; формувати науковий світогляд, колективізм, уміння слухати один одного, дотримуватись толерантності.
Тип уроку: Формування нових знань і вмінь
Форми й методи роботи: групова, фронтальна, індивідуальна робота, опорний конспект, конкурс «Лотерея», гра «Третій зайвий», повідомлення, інтерактивні вправи «Мозковий штурм», «Мозкова атака», «Метод прес», «Коло ідей.
Обладнання та матеріали : періодична система хімічних елементів, таблиця розчинності, зразки карбонатів (крейда, сода), пляшка мінеральної води, яєчна шкаралупа, пробірки, спиртівка, сірники, зразки гідроген карбонатів,
Хід уроку
І. Організація класу. Створення емоційного настрою.
Учитель. Добрий день, друзі!
На початку уроку я хочу прочитати вам уривок з твору Л. Керролла «Аліса в країні чудес»: «За кілька кроків від неї сидів на гілці Чеширський кіт. “Скажіть, будь ласка, куди мені звідси йти?”—“ А куди ти хочеш потрапити?»”— спитав у відповідь кіт. — “Мені все одно…” — сказала Аліса. “Тоді все одно куди йти”, — зауважив кіт».
Що хоче сказати цим кіт Алісі та навіщо я прочитала ці слова на самому початку уроку? Ваша думка. (Відповіді учнів)
Так, правильно, потрібно знати мету своєї роботи. І сьогодні на уроці ми будемо вчитися спостерігати та робити висновки. Ці вмінні потрібні в житті кожній людині. Для нас спостерігати — це не просто помічати, адже спостереження — перший етап людського пізнання.
Тому постарайтеся сьогодні хоча б подумки, а іноді й уголос починати свою відповідь словами: «А от я помітив…»
ІІ. Актуалізація опорних знань
Конкурс «Лотерея».
Консультант від кожної групи тягне жереб — по два завдання під номерами, що підкаже чергу під час відповідей. Від кожної групи виступає один учень і отримує 1 бал. Якщо відповідь неточна, на це запитання може відповідати учень з іншої групи, за що отримає 2 бали.
«Мікрофон»
- Дайте визначення класу кислот з точки зору теорії електролітичної дисоціації.
- Як саме класифікують кислоти?
- Які загальні фізичні властивості кислот вам відомі та як їх пояснити?
- Які кислоти вже відомі?
- Як утворюються кислоти?
- Що таке кислотні оксиди?
- Які оксиди Карбону вам відомі?
- Який ступінь окиснення проявляє Карбон у цих сполуках?
Гра «Третій зайвий»
З кожного горизонтального рядка викреслити формулу, що належить до іншого класу неорганічних сполук.
|
NaOH |
H2CO3 |
Ca(OH)2 |
|
CO2 |
SiO2 |
Na2CO3 |
|
NaHCO3 |
H2SO4 |
HNO3 |
- Які речовини зайві?
- До якого класу сполук вони належать?
Отже, об’єктом нашого дослідження є карбонатна кислота. Записуємо тему уроку у зошитах (є на дошці).
ІІІ. Мотивація навчальної діяльності.
Сьогодні ми продовжуємо вивчати Карбон. Ви вже вивчили прості сполуки, утворені цим елементом, і найпростіші серед складних — оксиди
А зараз ми продовжимо вивчати складніші сполуки на прикладі карбонатної кислоти.
Щоб правильно поводитись і знати застосування цієї кислоти, треба детально її дослідити і вивчити.
«Мозкова атака»
- Що ви знаєте про H2CO3?
- А чи достатньо ваших знань, щоб бути освіченою людиною, правильно використовувати цю сполуку, поводитись із нею? А що б ви ще хотіли знати про H2CO3?
(Можливі пропозиції учнів)
- Як утворюється H2CO3?
- Які властивості має?
- Які солі утворює?
- Як визначити CO32- в розчині?
- Яке значення H2CO3 та її солей?
Нам потрібно визначити проблему над розв’язанням якої ми працюватимемо на уроці. Пригадаємо (схема в інформаційному аркуші).
- Від чого залежать властивості речовин?
- Що ми можемо передбачити, знаючи властивості речовин?
Отже, ми вивчаємо властивості речовин, які залежать від будови і визначають галузі її застосування.
Проблема нашого уроку
Встановлення причинно-наслідкових зв’язків між будовою, властивостями та галузями використання карбонатної кислоти та її солей.
Девізом нашого уроку будуть слова Б. Шоу: «Єдиний шлях, що веде до знання,- це діяльність».
IV. Вивчення нового матеріалу.
Для успішної роботи над проблемою нам потрібно скласти план роботи. Тож нехай запропоновані вами запитання стануть завданням сьогоднішнього уроку.
- Будова молекули. Одержання.
- Хімічні властивості карбонатної кислоти, характерні й для інших кислот.
- Специфічні властивості H2CO3
- Солі карбонатної кислоти. Роль карбонатів у природі.
- Виявлення карбонат — іонів.
- Застосування H2CO3 та її солей.
Оскільки навчальний матеріал не є зовсім новим, адже з деякими кислотами ми вже зустрічалися неодноразово, то вивчення нового матеріалу будемо здійснювати груповим методом.
Сьогодні у нас працює 4 групи. (Учні тягнуть жереб).
Група 1. Будова молекули. Одержання.
Група 2. Хімічні властивості карбонатної кислоти, характерні й для інших кислот.
Група 3. Специфічні властивості H2CO3 .
Група 4. Солі карбонатної кислоти. Роль карбонатів у природі.
Індивідуальні завдання. (Повідомлення учнів)
- Застосування H2CO3
- Застосування карбонатів та гідроген карбонатів.
Учитель. Як утворюється H2CO3 (із яких оксидів)? Слово надається членам першої групи
Знайома незнайомка.
Відкриваючи пляшку мінеральної води або будь — якого газового напою, ми зустрічаємося з нашою «незнайомкою». Це вона — карбонатна кислота.
Отже, карбонатну кислоту утворюють два оксиди — СО2 і Н2О
Висновок. H2CO3 утворена двома оксидами — СО2 і Н2О.
Учитель. Подивіться уважно на схему.
![]() H—O
H—O
С = О
![]() Н—О
Н—О
- Який елемент буде визначати властивості H2CO3 ?
- З якими речовинами буде реагувати?
Про це ми дізнаємося прослухавши членів другої групи
|
|
H2CO3
![]()
H2CO3 + СаО = СаСО3 + Н2О
![]() H2CO3 +NaOH = Na2CO3 + 2H2O
H2CO3 +NaOH = Na2CO3 + 2H2O
![]() H2CO3 +Mg = MgCO3 + H2
H2CO3 +Mg = MgCO3 + H2
![]()
![]()
Висновок. Отже карбонатна кислота буде проявляти властивості, характерні й для інших кислот за рахунок наявності йонів Гідрогену.
Учитель. А чи має H2CO3 свої особливі властивості? Послухаємо членів третьої групи.
H2CO3 — речовина, формулу якої прийнято вважати умовною, тобто такої молекули у вільному стані не існує. Існує лише у водному розчині H2CO3 , міститься в газових напоях, часто виривається із пляшки, розбризкуючись навкруги. Це відбувається тому, що молекули її нестійкі, а в пляшці вони знаходяться під великим тиском. Коли ми відкриваємо кришку, тиск зменшується, H2CO3 розкладається на СО2 і Н2О.
СО2 +Н2О = Н+ + HCO3-
H2CO3 є слабкою кислотою, тому синій лакмусовий папірець набуває рожевого, а не червоного кольору, як у розчинах сильних кислот.
Висновок. Карбонатна кислота нестійка. Є слабкою кислотою, що підтверджує рожеве забарвлення лакмусу, а не червоне, як у розчинах сильних кислот.
Учитель. Зверніть увагу на кількість атомів Гідрогену в молекулі карбонатної кислоти.
- Яка основність карбонатної кислоти?
- Скільки видів солей вона може утворювати?
- Які властивості мають солі?
Слово надається членам четвертої групи
|
С = О
|
Гідрогенкарбонати розчинні Na2CO3, (NH4) CO3, Са(НCO3)2, Mg (НCO3)2,( Na НCO3 — малорозчинний ) містять йони НCO3 |
|
С = О
|
Карбонати нерозчинні СаСО3, MgCO3. Виняток: карбонати — лужні Ме і (NH4) CO3 CO32- |
Перетворення
CO32- + H2CO3 = НCO3-
Перетворення карбонатів у природі.

![]()
![]()


![]()


![]()
![]()
Висновок. Карбонатна кислота утворює два види солей — карбонати і гідроген карбонати. Солі карбонатної кислоти мають властивості, характерні й для інших солей; мають лужну реакцію, тому ними можна користуватися для нейтралізації кислотного середовища; у надлишку карбонатної кислоти карбонати перетворюються на гідроген карбонати.
Учитель. А тепер спираючись на набуті знання про будову та властивості карбонатної кислоти та її солей-карбонатів, спробуйте визначити для чого можна застосовувати ці сполуки.
V. Рефлексія. Ми ознайомилися з головними питаннями, які були розглянуті на уроці. Зробимо загальний висновок, користуючись опорним конспектом.
«Мозковий штурм»
- З яких оксидів утворюється H2CO3?
- Які властивості має?
- З чим реагує?
- Які два ряди солей утворює?
- Що є якісною реакцією на CO32- ?
Загальний висновок: Спільні з іншими кислотами властивості H2CO3 зумовлені наявністю в її складі йонів Н+, а особливі наявністю йонів CO32- . Якісною реакцією на карбонат-іон CO32- , НCO3- є йони Н+.
VI. Закріплення нових знань.
Інтерактивна вправа «Метод прес»
Учні виконують завдання у складі груп. Потім обговорюють результати.
- Як обчистити яйце від шкаралупи, не розбиваючи його? (Обробити розчином оцтової чи хлоридної кислоти)
- Лікар приписав хворому полоскати горло розчином питної соди і попередив, щоб він не розчиняв її у киплячій воді. Чому? Відповідь обґрунтуйте.
- Незнайка знав, що предмети, які горять, можна тушити водою або піском. Знайка порадив як більш ефективний засіб використовувати питну соду. Чи ви погоджуєтесь із ним? Відповідь обґрунтуйте.
- Учень попросив лаборанта принести йому карбонатну кислоту для виконання досліду. Чи зможе лаборант виконати прохання учня? Відповідь обґрунтуйте.
Інтерактивна вправа «Коло ідей»
(Учні виконують на аркушах)
Закінчити рівняння хімічних реакцій:
-
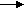 Са + H2CO3
Са + H2CO3
-
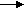 СО2 +Н2О + Ва(ОН)2
СО2 +Н2О + Ва(ОН)2
![]() 3. К2СО3 + НNO3
3. К2СО3 + НNO3
![]() 4. Mg (НCO3)2
4. Mg (НCO3)2
- Підбиття підсумків уроку.
Сьогодні ви закріпили знання про кислоти, ознайомилися з будовою, одержанням, застосуванням карбонатної кислоти та її солей. Ще раз переконалися, що властивості речовин залежать від їх будови і визначають галузі застосування.
Консультанти підбивають підсумки роботи учнів у групах, заповнюють таблицю оцінювання.
Учитель. Усі плідно працювали сьогодні на уроці, тому я вважаю, що епіграф нашого уроку ми повністю підтвердили. Дякую всім за співпрацю.
- Домашнє завдання
- (4-6 бали): вивчити параграф підручника та повторити конспект уроку.
- (7-9 балів): закінчити рівняння хімічних реакцій:
10000с
![]() а) СаСО3
а) СаСО3
t0с
![]() б) Ва(НСО3)2
б) Ва(НСО3)2
![]() в) К2СО3 + Н2SO4
в) К2СО3 + Н2SO4
- (10-11):
- У чайнику багато накипу. А чому накип не утворюється в каструлях? Як позбавитися накипу?
- У стакан з розчином хлоридної кислоти опускаємо яйце, воно тоне, але через певний час спливає на поверхню, а потім знову пірнає. Чому?












|
№ з/п |
Список учнів |
|
Бали |
|
|
За роботу в групі |
Додатково набрані |
Загалом
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
№ з/п |
Список учнів |
|
Бали |
|
|
За роботу в групі |
Додатково набрані |
Загалом
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
№ з/п |
Список учнів |
|
Бали |
|
|
За роботу в групі |
Додатково набрані |
Загалом
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
№ з/п |
Список учнів |
|
Бали |
|
|
За роботу в групі |
Додатково набрані |
Загалом
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
3 |
4 |


про публікацію авторської розробки
Додати розробку
