Урок.Карбонові кислоти
Тема 3. Оксигеновмісні органічні сполуки
Урок 28
Тема уроку.
Карбонові кислоти, їх поширення у природі та класифікація. Карбоксильна характеристична група. Склад, будова молекул насичених одноосновних карбонових кислот, їхня загальна та структурні формули, ізомерія, систематична номенклатура і фізичні властивості. Хімічні властивості насичених одноосновних карбонових кислот. Реакція естерифікації. Одержання етанової кислоти.
Мета:
-
Формування ключових компетентностей:
- Спілкування державною мовою;
- Уміння вчитися впродовж життя;
- Екологічна грамотність і здорове життя;
- Основні компетентності у природничих науках і технологіях;
- Інформаційно-цифрова компетентність;
- Соціальна та громадянська компетентності;
-
Формування предметних компетентностей:
- Дати поняття «карбонові кислоти», їх поширення у природі та класифікацію, уявлення про карбоксильну характеристичну групу; вивчити склад, будову молекул насичених одноосновних карбонових кислот, їхню загальну та структурні формули, ізомерію, систематичну номенклатуру; фізичні та хімічні властивості насичених одноосновних карбонових кислот: взаємодію з індикаторами, металами, лугами, солями, спиртами – реакцією естерифікації, одержання етанової кислоти;
- Розвивати хімічну мову, логічне й екологічне мислення, вміння аналізувати;
- Виховувати здоровий спосіб життя;
- Виховувати інтерес до вивчення хімії.
Обладнання: мультимедійний проектор, комп’ютер, мультимедійна презентація, ЕЗНП «Віртуальна хімічна лабораторія»
Тип уроку: вивчення нового матеріалу.
Форми роботи: лекція, бесіда, складання схеми-шпаргалки, «Відстрочена відгадка», «М’яке опитування», робота з підручником, робота в парах, робота з QR-кодами підручника (відео хімічні властивості) , завдання за допомогою сервісу learningApps.Org
Структура уроку
I. Організаційний етап ……………………………………………………… 1хв
II. Оголошення теми та мети уроку ………………………………………….. 2 хв
III. Актуалізація опорних знань та поглиблення знань……………………… 3 хв
IV. Мотивація навчальної діяльності …………………………………………. 2 хв
V. Вивчення нового матеріалу ……………………………………………… 27 хв
- Знаходження в природі
- Поняття про карбонові кислоти.
- Функціональна група й будова карбонових кислот.
- Типи класифікації карбонових кислот.
- Гомологічний ряд й номенклатура карбонових кислот.
- Фізичні властивості карбонових кислот.
- Електронна будова карбоксильної групи.
- Техніка безпеки.
- Хімічні властивості.
- Одержання оцтової кислоти.
- Застосування.
VІ. Узагальнення й систематизація знань учнів …………………………….. 5 хв
VIІ. Домашнє завдання ………………………………………………………… 2 хв
VІII. Підбиття підсумків уроку, виставлення оцінок ………………………… 3 хв
Хід уроку
|
Формування ключових компетентностей |
Діяльність викладача |
Діяльність учня |
|
Спілкування державною мовою; Уміння вчитися впродовж життя; Основні компетентності у природничих науках і технологіях Екологічна грамотність і здорове життя; Інформаційно-цифрова компетентність Соціальна та громадянська компетентності |
Лекція, бесіда, прийом «Відстрочена відгадка», проблемне питання, «М’яке опитування», робота з підручником, робота в парах, «Снігова куля», «віртуальна лабораторія», завдання за допомогою сервісу learningApps.Org
|
Вивчають основні поняття теми, відповідають на питання, складають конспект, схему, рівняння реакцій, уважно слухають, відповідають на питання, міркують над проблемним питанням, спостерігають за експериментом, працюють у парах
|
І. Організація групи
ІІ. Оголошення теми й мети уроку.
ІІІ. Актуалізація опорних знань та поглиблення знань
Завдання за допомогою сервісу learningApps.Org «Класифікація органічних сполук»
ІV. Мотивація навчальної діяльності
«Відстрочена відгадка»
Хіба ми можемо уявити життя без цієї речовини? Без маринованих огірочків, грибів? Всі ми знаємо запах цієї речовини і не сплутаємо його ні з якою іншою речовиною. Скажіть, будь ласка, з якою речовиною ми ознайомимось сьогодні на уроці? Так, ми ознайомимося з основною складовою частиною столового оцту – з оцтовою кислотою.
V. Вивчення нового матеріалу
1. Знаходження в природі
- Мурашина кислота виробляється мурахами, знаходиться у кропиві і в хвої ялини.
- Масляна кислота – утворюється у разі прогіркання масла, є запахом поту.
- Капронова кислота - входить до складу козячого масла.
- Ізовалеріанова кислота – в коренях валеріани лікарської.
- Стеаринова і пальмітинова кислота – виділені з пальмової олії.
- Щавлева кислота - в щавлі, ревені, кислиці, шпінаті.
- Яблучна кислота – яблука.
- Лимонна кислота - апельсин, грейпфрут, лимон.
- Оцтова кислота – утворюється при прокисанні вина
2. Поняття про карбонові кислоти.
Карбонові кислоти — це органічні речовини, молекули яких містять одну або кілька карбоксильних груп, сполучених з вуглеводневим радикалом або водневим атомом.
3. Функціональна група й будова карбонових кислот.
. 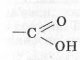 - карбоксильна група. Назву отримала від поєднання двох груп атомів карбонільної і гідроксильної.
- карбоксильна група. Назву отримала від поєднання двох груп атомів карбонільної і гідроксильної.
Загальна формула має вигляд: СnH2n+1COOH або R – COOH
4. Карбонові кислоти класифікують:
а) залежно від кількості карбоксильних груп у молекулі — на одноосновні, двохосновні та багатоосновні;
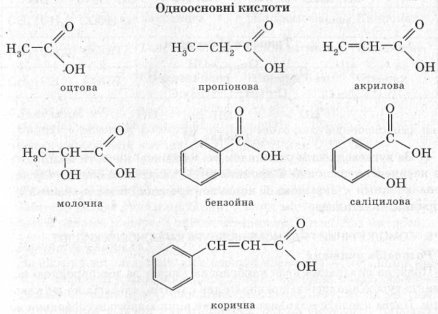
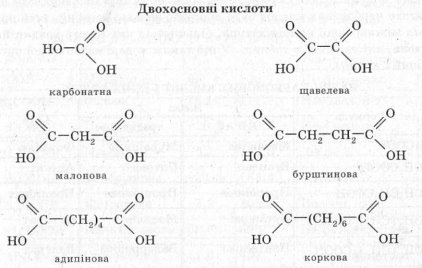
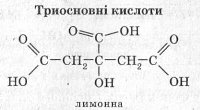
б) залежно від природи радикала — на насичені, ненасичені й ароматичні
- Насичені, наприклад пропіонова кислота
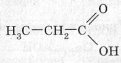
- Ненасичених, наприклад акрилова кислота
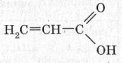
- Ароматичні, наприклад бензойна кислота
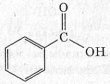
5. Гомологічний ряд й номенклатура карбонових кислот.
Найпростішими представниками є: Мурашина і оцтова кислоти.
Назва кислоти походить від назви відповідного вуглеводню: до назви алкана додають суфікс -ов- і закінчення -а. У зв'язку з тим що багато карбонових кислот було відкрито задовго до прийняття правил міжнародної номенклатури, більшість з них мають традиційні назви.
НАЗВИ КАРБОНОВИХ КИСЛОТ І ЇХНІХ СОЛЕЙ
|
Формула |
Назва |
Сіль |
|
|
IUPAC |
традиційна |
||
|
HCOOH |
Метанова |
Мурашина |
Форміат |
|
CH3COOH |
Етанова |
Оцтова |
Ацетат |
|
CH3CH2COOH |
Пропанова |
Пропіонова |
Пропіоат |
|
CH3 (CH2 )2COOH |
Бутанова |
Масляна |
Бутилат |
|
CH3 (CH2 )3COOH |
Пентанова |
Валеріанова |
Валеріат |
|
CH3 (CH2 )4COOH |
Гексанова |
Капронова |
Капронат |
|
СІ5Н31СООН |
Гексадеканова |
Пальмітинова |
Пальмітат |
|
СІ7Н35СООН |
Октадеканова |
Стеаринова |
Стеарат |
6. Фізичні властивості карбонових кислот.
Робота в парах (виписати з підручника фізичні властивості оцтової кислоти)
Нижчі карбонові кислоти — рідини з гострим запахом, добре розчинні у воді. З підвищенням відносної молекулярної маси розчинність кислот у воді зменшується, а температура кипіння підвищується. Вищі кислоти, починаючи з пеларгонової (нонанової) СН3—(СН2)7—СООН,— тверді речовини, без запаху, нерозчинні у воді.
ФІЗИЧНІ ВЛАСТИВОСТІ КАРБОНОВИХ КИСЛОТ
|
Формула
|
Назва |
t пл. С |
t кип. С |
Розчинність у воді |
|
НСООН |
Мурашина |
8,2 |
100,7 |
Необмежено |
|
СН3СООН |
Оцтова |
16,6 |
117,7 |
Необмежено |
|
С2Н5СООН |
Пропіонова |
-20,8 |
140,8 |
Необмежено |
|
С3Н7СООН |
Масляна |
-5,3 |
163,3 |
Добре |
|
С4Н9СООН |
Валеріанова |
-34,5 |
186,4 |
Погано |
|
С5Н11СООН |
Капронова |
-3,9 |
205,3 |
Погано |
|
СІ5Н31СООН |
Пальмітинова |
52,5 |
390 |
Не розчиняється |
|
СІ7Н35СООН |
Стеаринова |
71,0 |
432 |
Не розчиняється |
Необхідно відзначити такі властивості кислот, як їхня порівняно мала леткість, розчинність у воді одних і нерозчинність інших. У встановленні водневих зв'язків беруть участь атоми Оксигену гідроксильних груп. Унаслідок рухливості π-зв'язку електронна густина на карбонільному атомі Оксигену більша, він переважно бере участь в утворенні водневих зв'язків.
Оскільки в молекулах кислот одночасно присутні й негативно, й позитивно заряджені атоми, можуть утворюватися подвоєні молекули — дімери з двома водневими зв'язками:
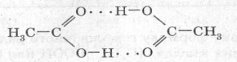
У такому випадку асоціація молекул виявляється більш міцною, ніж за наявності одного водневого зв'язку.
7. Електронна будова карбоксильної групи.
Електронні взаємодії в карбоксильній груді досить складні, спостерігається сполучення неподіленої електронної пари гідроксильного Оксигену з електронами π-зв'язку.
В результаті зсуву електронної густини подвійного зв'язку до Оксигену атом Карбону набуває надлишкового позитивного заряду. З цієї причини електрони гідроксильного атома Оксигену (неподілені електрони й електрони зв'язку С = О) зміщуються до атома Карбону, а в результаті зниження електронної густини на атомі Оксигену до нього зміщуються електрони зв'язку О—Н. Атом Гідрогену у зв'язку з цим легше відщеплюється у вигляді протона, що й зумовлює кислотні властивості речовини. Зсув електронної густини зв'язків у карбоксильній групі можна виразити такою формулою:
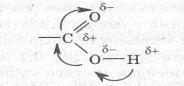
Зсув електронної густини від гідроксильного атома Оксигену до атома Карбону трохи зменшує на ньому позитивний заряд, а отже, і полярність зв'язку С = О , тому варто очікувати зниження реакційної здатності карбонільної групи.
Одноосновні карбонові кислоти.
До одноосновних насичених карбонових кислот належать органічні речовини, в молекулах яких є одна карбоксильна група, зв'язана з радикалом насиченого вуглеводню або з атомом водню.
8. Техніка безпеки ( слайди)
9. Хімічні властивості. (Слайди, відео)
Робота з QR-кодами підручника (відео хімічні властивості)
Ставимо проблемне питання : «Властивості якого класу неорганічних речовин подібні до властивостей оцтової кислоти?»
1. Вплив кислот на індикатори.
Оцтова кислота є слабкою кислотою, тому змінює колір індикаторів
СН3СООН ↔ СН3СОО- + Н+
Лабораторний дослід «Дія кислот на індикатора».
У дві пробірки налити 1—2 мл розчину оцтової кислоти й додати декілька крапель розчинів лакмусу й метилового оранжевого.
2. Взаємодія з металами.
2СН3СООН + Mg → (СН3СОО)2 Mg + H2
Лабораторний дослід «Взаємодія кислот з металами й лугами».
У дві пробірки налити розчини оцтової і хлоридної кислот. В обидві пробірки додати трохи порошку магнію або магнієвих ошурків. Порівняти активність взаємодії цих кислот з магнієм.
3. Взаємодія з оксидами металів.
2СН3СООН + CaO → (СН3СОО)2 Ca + H2O
У пробірку налити розчини оцтової кислот. Додати трохи порошку цинк оксиду.
4. Взаємодія з лугами.
СН3СООН + NaOH → СН3СООNa + H2O
Лабораторний дослід«Взаємодія кислот з лугами».
У пробірку налити розчин лугу й додати декілька крапель фенолфталеїну. Потім по краплях додавати розчин оцтової кислоти до знебарвлення розчину.
5. Взаємодія з солями слабких кислот.
2СН3СООН + CaСO3 → (СН3СОО)2Ca + H2O + СО2
Лабораторний дослід«Взаємодія кислот з солями».
У пробірку налити розчин кислоти. Потім додати шматок крейди.
6. Горіння.
Як і більшість органічних сполук, карбонові кислоти дуже добре горять, причому чим більший вуглеводневий радикал, тим більша ймовірність протікання реакції горіння з виділенням сажі (вільного вуглецю):
СН3СООН + 2О2 → 2H2O + 2СО2
СІ7Н35СООН + 8О2 → 18H2O + 17С
7. Реакція естерифікації.
Карбонові кислоти здатні взаємодіяти зі спиртами з утворенням естерів:
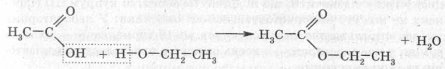
Молекула кислоти віддає гідроксигрупу, а молекула спирту — атом Гідрогену.
Реакція естерифікації відбувається у присутності сульфатної кислоти, яка в цьому випадку відіграє роль каталізатора, й водовіднімаючої речовини. Роль водовіднімаючої речовини в даному випадку полягає в полегшенні протікання реакції і зсуві рівноваги у бік утворення продуктів реакції.
8. Взаємодія з хлором.
Під впливом карбоксильної групи в молекулі карбонової кисло-. ти збільшується рухливість атомів Гідрогену, що стоять при атомі Карбону у вуглеводневому радикалі, який розташований поряд з карбоксильною групою (в α-положенні). Тому ці атоми Гідрогену можуть легко заміщатися (наприклад, галогенами):
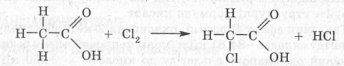
Чим більше атомі гідрогену заміщені на атоми хлору, тим кислота буде проявляти кислотні властивості.
Вплив карбоксильної групи розглядається на прикладі реакції хлорування карбонових кислот. Насичені вуглеводні вступають у взаємодію з галогенами складніше. Вплив вуглеводневого радикала на карбоксильну групу помітний, якщо розглядати зміну сили карбонових кислот зі збільшенням радикала: чим більший радикал, тим менш рухливий атом Гідрогену карбоксильної групи і тим слабшою є кислота. Зі збільшенням вуглеводневого радикала в гомологічному ряду одноосновних насичених кислот сила кислот зменшується. Відповідно, найсильнішою кислотою цього ряду є мурашина кислота.
Складаємо схему-шпаргалку хімічних властивостей оцтової кислоти.
Робимо висновок про подібність властивостей етанової кислоти до властивостей неорганічних кислот.
Оцтова кислота
- дисоціація - з основами
- з металами - із солями
- з основними і амфотерними - зі спиртами
оксидами
10. Одержання кислот.
1. Сучасний синтетичний спосіб одержання оцтової кислоти заснований на окисненні оцтового альдегіду, що виходить при гідратації ацетилену:
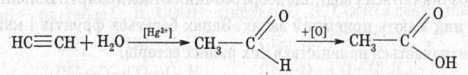
2. Велике значення має спосіб одержання оцтової кислоти, заснований на окисненні бутану:
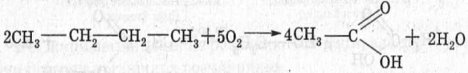
3. Окиснення альдегідів (реакція срібного дзеркала):
СН3СОН + Ag2O → СН3СОOН + 2Ag
11. Застосування.
Застосування мурашиної кислоти.
Оскільки при нагріванні мурашиної кислоти із сульфатною виділяється чадний газ, то її часто використовують у лабораторії для одержання чистого чадного газу.
Мурашина кислота широко використовується в органічному синтезі як протрава при фарбуванні текстилю, у бджільництві проти вароатозу, для одержання пестицидів та ін. У медицині вона застосовується у вигляді 1%-го спиртового розчину (мурашиний спирт) як розтирка при невралгіях, міозитах та інших захворюваннях.
Застосування оцтової кислоти.
Оцтова кислота серед органічних кислот використовується найбільше. У цьому плані її можна порівняти із сульфатною кислотою.
У результаті реакції плюмбум (II) оксиду з оцтовою кислотою утворюється плюмбум (II) ацетат РЬ(СН3СОО)2, розчин якого застосовується в медицині (свинцева примочка).
При взаємодії ферум (III) гідроксиду з кислотою одержують фе-рум (III) ацетат Fе(СН3СОО)з, відомий як протрава при фарбуванні. При нанесенні на тканину він, з одного боку, міцно утримується волокнами, з іншого — добре утримує барвник.
Найчастіше оцтова кислота утворює з важкими металами солі, у складі яких поряд з кислотними залишками містяться гідроксильні групи, наприклад РЬ(СН3СОО)2 РЬ(ОН)2.
Оцтова кислота використовується для одержання естерів, наприклад етилацетату, інших естерів, які завдяки приємному запаху застосовуються як віддушки у парфумерній та харчовій промисловості.
У сільському господарстві та харчовій промисловості оцтова кислота, а також її найближчі гомологи — мурашина і пропіонова — використовуються як консерванти, що дозволяє зберігати високу поживність кормів і запобігати гнилісним процесам.
Оцтова кислота застосовується для одержання барвників, ацетатного волокна, лікарських препаратів, зокрема аспірину (ацетилсаліцилової кислоти).
- Узагальнення й систематизація знань учнів
Прийом «М’яке опитування»
- Як називається функціональна група органічних кислот?
- Як називаються органічні кислоти, що містять карбоксильну групу?
- Який агрегатний стан оцтової кислоти? А який у вищих карбонових кислот, що містять 15 і більше атомів Карбону?
- Чому в разі дії натрієм на оцтову кислоту виділяється газ? Який?
- Який газ виділяється під час дії оцтової кислоти на соду?
- Де застосовують оцтову кислоту?
- Чому болісні укуси мурашок? (Обпалюють мурашиною кислотою)
- Які кислоти є вітамінами? (Аскорбінова)
- Завдання за допомогою сервісу learningApps.Org «Карбонові кислоти»
VIІ. Домашнє завдання.
§ 20,21, вправа 308.
Підготувати міні-проекти на теми:
«Перше застосування оцтової кислоти»
«Застосування оцтової кислоти в харчовій промисловості»
«Як моя родина використовує оцет»
VІІI. Підбиття підсумків уроку, виставлення оцінок
- Завдання за допомогою сервісу learningApps.Org «Оксигеновмісні органічні речовини»
- Які завдання ми ставили на початку заняття?
Учні називають їх.
- Чи справились ми з ними?
- Що корисного ви взяли із цього заняття?
Отже, сьогодні ви застосовували раніше здобуті знання, оволоділи новими
знаннями та практичними навичками. І все це через діяльність, через вашу
працю.
Б.Шоу сказав: «Єдиний шлях, який веде до знань - це праця».
Чи поставленої мети ми з вами досягли?
Отже, Працюйте й будьте щасливі!


про публікацію авторської розробки
Додати розробку
