Презентація до уроку на тему " Оксигеновмісні кислоти"
У презентації наданий матеріал про будову,властивості та значення кислот у життєдіяльності людини.










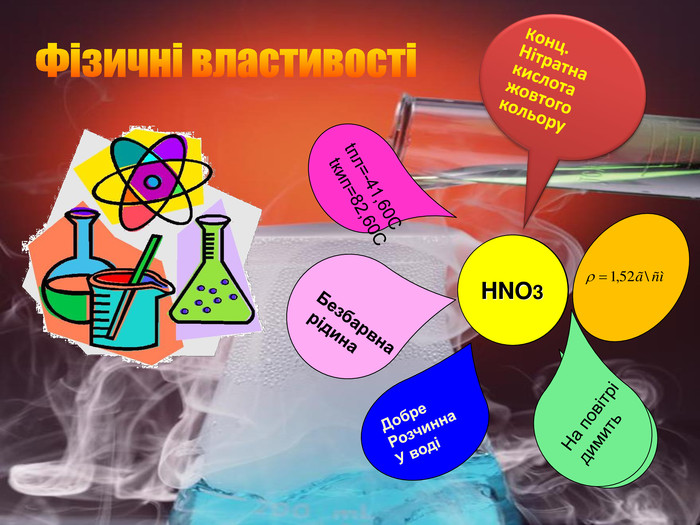



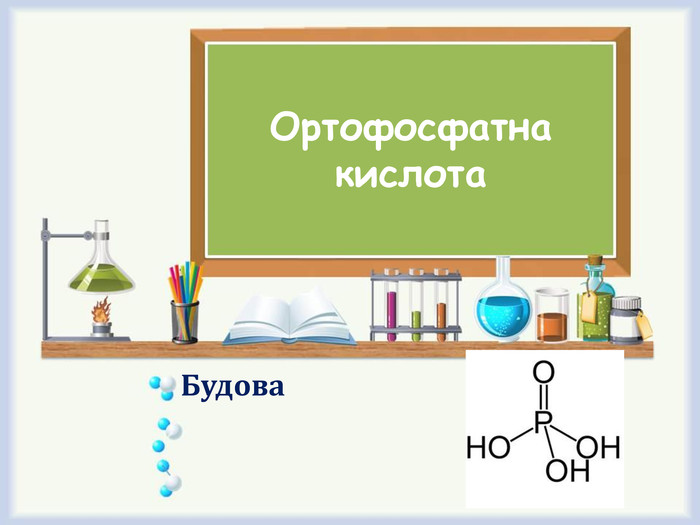










Потрібно знати. Розчинення кислоти у воді супроводжується виділенням великої кількості теплоти. Для того щоб із концентрованої сульфатної кислоти виготовити її розбавлений розчин, кислоту доливають у воду, а не навпаки. Тоді температура рідини зростає повільніше, і вдається запобігти її закипанню й розбризкуванню.
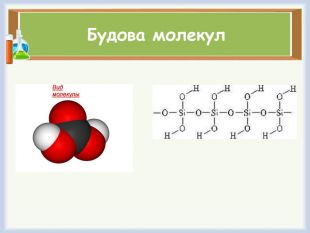
Хімічні властивості1. Взаємодія з металами: А)2 Al + 3 H2 SO4 (розб.) = Al2(SO4)3+ 3 H2↑. Б) з малоактивними металами: Cu + H2 SO4(конц.)→Cu. SO4+ SO2↑+ H2 OВ) з активними металами: Mg + H2 SO4(конц.)→Mg. SO4+ H2 S↑+ H2 O.2. Взаємодія з оксидами металів: H2 SO4 + Mn. O →Мn. SO4+ H2 O 3. Взаємодія з основами:3 H2 SO4 + 2 Fe(OH)3→Fe2(SO4)3 +6 H2 O
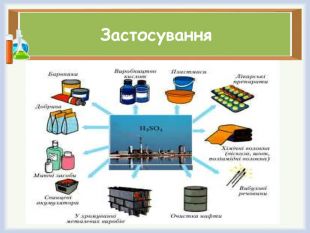
при изготовлении: Хлебопекарных порошков; Плавленых сыров; Колбас; Сахара; Ароматизированных напитков – кока-колы, пепси-колы, спрайта. Для очищения от ржавчины металлических поверхностей. Также она способствует дальнейшему предотвращению образования коррозии; В качестве флюса при пайке; В сельском хозяйстве – для производства минеральных удобрений; В составе фреонов (в промышленных морозильных установках); Для исследований в области молекулярной биологии; В производстве бытовых синтетических чистящих, моющих и смягчающих средств;
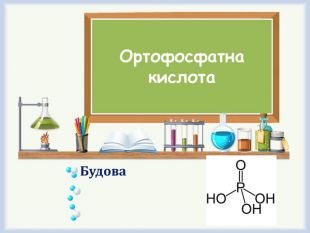
Фізичні властивостіВугільна кислота - слабка двухосновная кислота. У чистому вигляді не виділена. Утворюється в малих кількостях при розчиненні вуглекислого газу у воді, в тому числі і вуглекислого газу з повітря. Сілікатна кислота. При утворенні-це прозора студениста речовина, практично нерозчинна у воді. Такий студень назвається - гель.
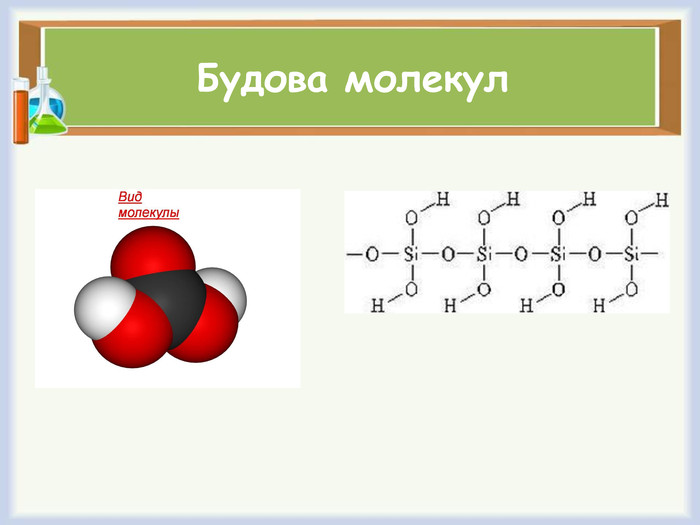
Хімічні властивості Сілікатна кислота - сама слаба серед мінеральних кислот, вона майже не дисоціює у розчинах, не забарвлює індикаторів. 1. При нагріваі вона разкладається на діоксид та воду: H2 Si. O3 => H2 O + Si. O22. Взаємодіє з роєчинами лугів, утворюючи солі-сілікати: H2 Si. O3 + 2 Na. OH => Na2 Si. O3 + 2 H2 O
Добування. EВугільна кислота утворюється при взаємодії вуглекислого газу з водою( мінеральна вода)ДEУгольная кислота образуется при растворении в воде диоксида углерода. Так як діоксид кремнію з водою не взаємодіє, то кремнієву кислоту добувають непрямим шляхом - взаємодією розчинних силікатів лужних металів з кислотами:
Застосування. Вугільна кислота завжди присутня у водних розчинах вуглекислого газу (газована вода). Сілікагель використовується для осушення газів, розділення сумішей. Він може бути і носієм дрібно роздроблених каталізаторів - це вважається одним з найважливіших його якостей. Крім того, і сам силікагель може бути каталізатором.


про публікацію авторської розробки
Додати розробку