Презентація до уроку на тему " Водневі сполуки неметалів"
Про матеріал
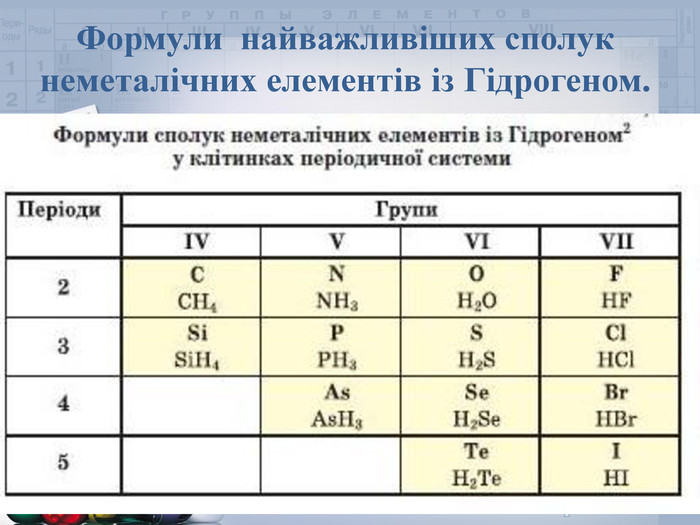
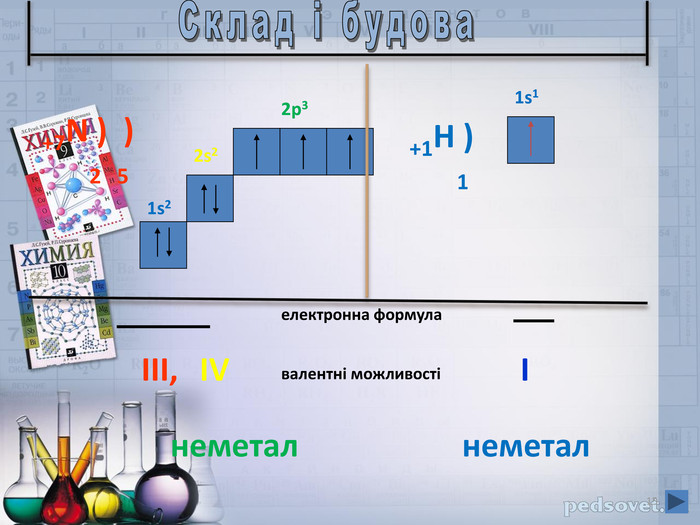
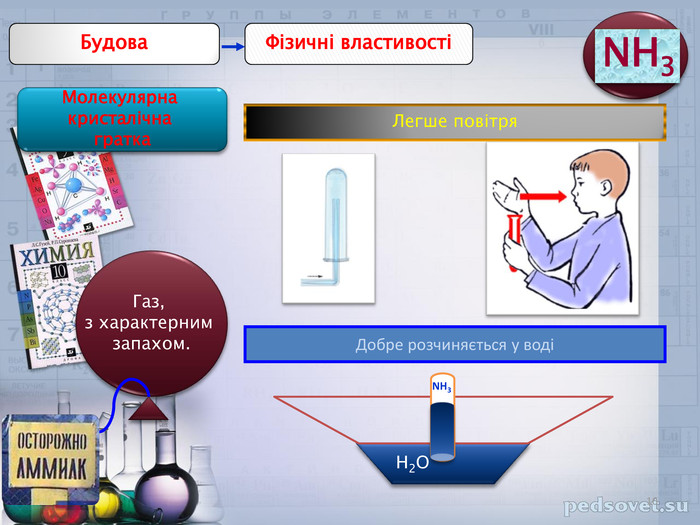
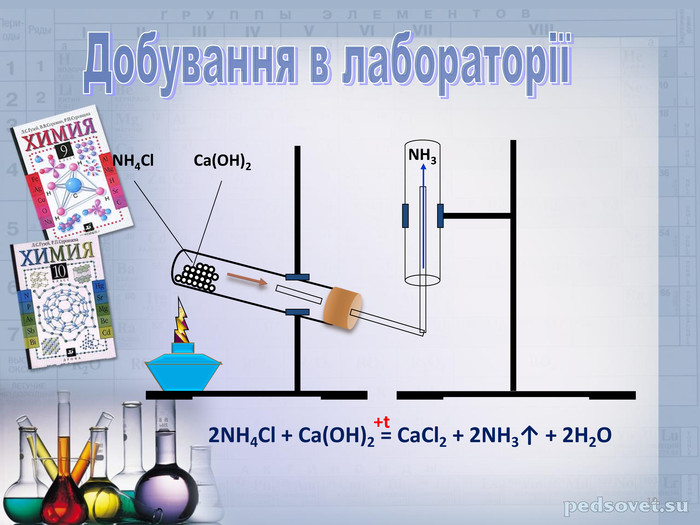
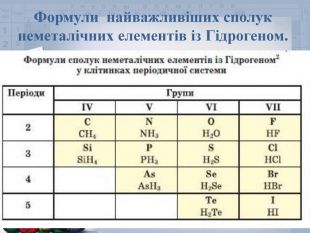
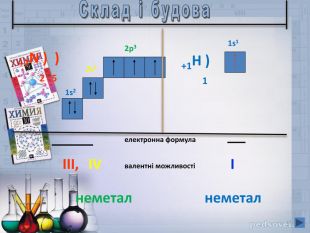
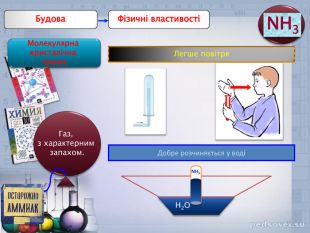
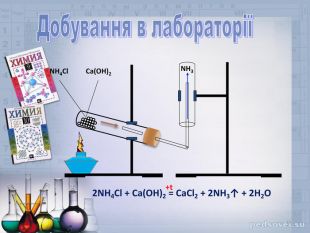
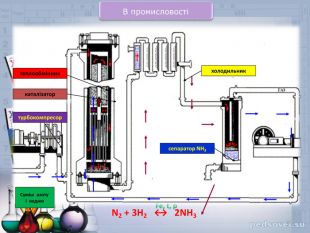
В презентації наданий матеріал про будову ,властивості та застосування в промисловості водневих сполук неметалів. А також про небезпеку, яку становлять де-які оксиди для довкілля.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую!
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку