Урок"Кількісний склад розчину. Масова частка розчиненої речовини."
розробка уроку для сьомого класу, яка допоможе розглянути масову частку розчиненої речовини, навчитись розвязувати задачі, зрозуміти даний матеріал, цікаво розповісти дітям дану тему
7 клас. План конспект уроку на тему:
Кількісний склад розчину. Масова частка розчиненої речовини.
Мацак Світлана Олександрівна, вчитель хімії Обтівської ЗОШ І-ІІІ ступенів, Кролевецький р-н, Сумська обл.
Мета:
Навчальна:
сформувати поняття про масову частку розчиненої речовини в розчині;
навчити обчислювати масу і масову частку розчиненої речовини в розчині.
Розвивальна:
розвивати пізнавальний інтерес до дисципліни;
логічне мислення;
самостійність у процесі розв’язування задач;
увагу;
пам'ять;
уміння виділяти головне;
робити висновки.
Практична:
розвиток в учнів спеціальних умінь;
вироблення навичок безпечного поводження з речовинами у побуті та на виробництві.
навчити учнів виконувати найпростіші операції під час проведення хімічних експериментів.
Тип уроку: засвоєння нових знань.
Методи та
методичні
прийоми: фронтальна бесіда з елементами лекції, експеримент.
Обладнання: підручники, реактиви згідно демонстрації.
Хід уроку:
І. Перевірка раніше вивченого матеріалу.
Питання до класу.
- Що таке розчин? Наведіть приклади розчинів.
- З чого складаються розчини?
- На які групи по відношенню до води поділяються усі речовини?
- Чи можна розділити розчин на компоненти? Яким способом?
ІІ. Мотивація навчально-пізнавальної діяльності учнів, оголошення теми і завдань уроку:
На попередньому уроці ми почали знайомитись з розчинами та знаємо, як їх можна виготовити. Давайте пригадаємо що таке відсотки. Як знайти відсотки від числа і число за його відсотками? Пригадайте як ми з вами знаходили масову частку елемента в сполуці.
Що треба знати для приготування розчину?
Де в побуті ви або ваші рідні готують розчини?
Коли ви подивитесь на свої робочі місця то побачите різні склянки з етикетками на яких є написи: 5% спиртовий розчин йоду, 9% розчин оцтової кислоти, 0,1% назальний спрей, 70% розчин оцтової кислоти, 3% розчин пероксиду водню, 10% розчин амоніаку і т.д.
Як ви гадаєте що означають ці записи на етикетках? І навіщо вони потрібні?
Під час роботи з розчинами важливо знати їхній кількісний склад, зокрема масову частку розчиненої речовини. Цю важливу кількісну характеристику завжди зазначають на етикетках хімічних реактивів, харчових продуктів, лікарських засобів у формі розчинів. Відсотки які написані на етикетках виражають яка кількість речовини там розчинена.
Важливо уважно читати етикетки на споживчих товарах якщо ви подивитесь на склянки на столі то побачите що є дві однакові речовини , але вони мають різні масові частки розчиненої речовини це 9% і 70% розчини оцтової кислоти. Обидві речовини використовуються у кулінарії перша має назву столовий оцет, а друга оцтова есенція. Якщо помилково використати есенцію замість оцту може спричинити важкі хімічні опіки органів травлення. Тому потрібно бути уважними, і читати етикетки.
Сьогодні ми з вами навчимось виконувати розрахунки для приготування розчинів. Для початку запишіть тему нашого уроку: Кількісний склад розчину. Масова частка розчиненої речовини.
ІІІ. Вивчення матеріалу нової теми:
Ця тема дуже тісно пов’язана з математикою. Розв’язування задач цього типу зводиться до обчислень:
- масової частки розчиненої речовини: w (дубль-ве), або ω – (омега). Дана величина виражається у частках одиниці або у відсотках. Давайте пригадаємо що таке відсотки? ![]() 0,01 = 1%
0,01 = 1%
Масова частка розчиненої речовини – це безрозмірна величина, що дорівнює відношенню маси розчиненої речовини до загальної маси розчину:
![]()
де ![]() масова частка розчиненої речовини;
масова частка розчиненої речовини;
m(речовини) – маса речовини;
m(розчину) – маса розчину.
А як знайти масу розчину? З курсу природознавства ви знаєте, що розчин може складатися з декількох компонентів. Наприклад чай, коли ви зранку його готуєте, які компоненти туди входять? (вода, чай і цукор) Отже, чай буде розчином, вода – розчинник, чай і цукор розчиненими речовинами. І сумарно маса розчину буде:
m(розчину) = m(речовини) + m(води),
тобто масову частку можна виразити як
![]() .
.
Масову частку розчиненої речовини ω звичайно виражають у частках від одиниці або у відсотках. Наприклад, масова частка розчиненої речовини – СаСl2 у розчині дорівнює 0,06, або 6%. Це означає, що в розчині Кальцій хлориду масою 100 г міститься хлорид кальцію масою 6 г і вода масою 94 г.
Сьогодні ми з вами навчимось розв’язувати задачі на обчислення маси розчиненої речовини. Для початку давайте розглянемо алгоритм розв’язування задач.
Алгоритм обчислення маси розчиненої речовини,
якщо відома масова частка розчиненої речовини й маса розчину
|
Послідовність дій |
Приклади виконаних дій
|
|
1) Прочитайте текст задачі |
Обчисліть масу солі, необхідну для приготування розчину масою 200 г з масовою часткою солі 0,05. |
|
2) Запишіть скорочено умову задачі |
Дано: m(розч.) = 200 г ω(солі) = 0,05 Знайти: m(соліl) - ? |
|
3) Запишіть формулу для обчислення маси розчиненої речовини, виходячи із формули: ω(солі) = |
m(солі) = ω(солі) · m(розч.) |
|
4) Підставте в отриманий вираз чисельні дані з умови задачі та здійсніть розрахунки |
m(солі) = 0,05 · 200 = 10(г) |
|
7) Запишіть відповідь |
Відповідь: m(солі) = 10г |
ІV. Закріплення матеріалу вивченого на уроці:
Задача 2. У 200 г води розчинили 123,4 г натрій броміду. Визначити масову частку натрій броміду в утвореному розчині.
![]() Дано: 1. обчислюємо масу розчину:
Дано: 1. обчислюємо масу розчину:
m(H2O) = 200 г m(розчину) = m(H2O) + m(NaBr) = 200 + 123,7 = 323,7 г
m(NaBr) = 123,7 г 2. визначаємо масову частку натрій броміду:
![]() ω(NaBr) - ? ω (NaBr) =
ω(NaBr) - ? ω (NaBr) =![]()
Відповідь: масова частка натрій броміду 38,21 %.
Задача 3. Яка маса солі і води необхідні для приготування 500 г розчину з масовою часткою розчиненої речовини 35%
![]() Дано: 1. Яка маса солі потрібна для приготування розчину?
Дано: 1. Яка маса солі потрібна для приготування розчину?
m(розчину) = 500 г 35% = 0,35
ω (солі) = 35% m(солі) = m(розчину) • ω (солі) = 500 • 0,35 = 175 г
![]() m (солі) - ? 2. Знаючи масу солі визначаємо масу води:
m (солі) - ? 2. Знаючи масу солі визначаємо масу води:
m (води) - ? m(H2O) = m(розчину) – m(солі) = 500 – 175 = 325 г
Відповідь: маса води 325 г, маса солі 175 г.
Задача 4. У розчині масова частка натрій хлориду дорівнює 25%. Обчислити масу розчину, що містить 80 г натрій хлориду.
Дано:
![]() m(NaCl) = 80 г 25% = 0,25
m(NaCl) = 80 г 25% = 0,25
![]() ω (NaCl) = 25% m (р-ну NaCl) =
ω (NaCl) = 25% m (р-ну NaCl) =![]()
m (р-ну NaCl) - ? Відповідь: маса розчину 320 г.
Задача 5. Визначити маси розчинів з масовими частками розчинів 10% і 30% необхідних для приготування 300 г розчину з массовою часткою 15%.
![]() Дано:
Дано:
т (р-ну) = 300 г
ω 1 = 10 %
ω2 = 30%
ω3 = 15%
![]() т1 - ? т1 (10%) : т2(30%) = 1:3
т1 - ? т1 (10%) : т2(30%) = 1:3
т2 - ?
300 грамів розчину – 4 частини
т1 (10%) розчину – 3 частини
т1 (10%) =![]()
300 грамів розчину – 4 частини
т2 (30%) розчину – 1 частина
т2 (30%) =![]()
Відповідь: т1 = 225 г, т2 =75 г.
Задача 6. До 300 г 20%-го розчину купрум хлориду додали 200 мл води. Обчислити масову частку солі у новоутвореному розчині.
![]() Дано:
Дано:
m(розчину) = 300 г m(H2O) = 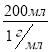 =200 г
=200 г
ω (CuCl2) = 20% m(CuCl2) = m(розчину) • ω (солі) = 300 • 0,2 = 60 г
![]() V (H2O) = 200мл m(розчину) = m(розчину) + m(води) = 300 +200 = 500 г
V (H2O) = 200мл m(розчину) = m(розчину) + m(води) = 300 +200 = 500 г
w (CuCl2) - ? ω (CuCl2)![]()
Відповідь: масова частка солі у новому розчині 12%.
Задача 7. До розчину масою 200 г з масовою часткою 10% додали 20г цієї ж солі. Обчислити масову частку солі у новоутвореному розчині.
![]() Дано:
Дано:
m(розчину) = 200 г m(розчину) = m(розчину) + m(солі) = 200 +20 = 220 г
ω (ВаCl2) = 20% m(ВаCl2) = m(розчину) • ω (солі) = 200 • 0,2 = 40 г
![]() m (ВаCl2) = 20г m(солі) = 40 + 20 = 60 г
m (ВаCl2) = 20г m(солі) = 40 + 20 = 60 г
w (ВаCl2) - ? ω (ВаCl2)![]()
Відповідь: масова частка солі у новому розчині 27,3%.
V. Узагальнення та систематизація знань:
Давайте пригадаємо що таке розчин?
Назвіть мені основні компоненти розчину?
Яку речовину можна назвати універсальним розчинником?
Що таке масова частка?
Якою формулою визначається масова частка?
Задача 8. Для самостійного розв’язування у робочих зошитах.
Обчисліть масу води та масу натрій хлориду, що використали для отримання 300 г розчину з масовою часткою солі 20%.
VІ. Підведення підсумків уроку. Оголошення результатів роботи учнів. Оголошення домашнього завдання:
Опрацювати § 23 с.152 – 155.
Виконати вправи 1-3 с156-157.
Додаткове завдання:
Обчислити масову частку цукру у чаї який споживаєте ви та ваші рідні. Взявши до уваги, що 1 ч.л. цукру – це 2,5 г., 1склянка вміщує 200 мл. води.
1


про публікацію авторської розробки
Додати розробку
