Урок "Метан. Електронна та структурна формули метану. Гомологи метану. Молекулярні і структурні формули. Назви. Фізичні і хімічні властивості"
. Тема: Метан. Електронна та структурна формули метану, поширення у природі. Гомологи метану. Молекулярні і структурні формули. Назви. Фізичні і хімічні властивості.
Мета: повторити молекулярну, електронну і структурну формули метану, з'ясувати знаходження у природі; вивчити гомологічний ряд метану, познайомитися з поняттями „ гомологічний ряд", „ гомолог", „ гомологічна різниця"; навчитися складати електронні і структурні формули гомологів метану, вивчити їх назви, загальну формулу ряду, фізичні властивості; розвивати вміння складати електронні і структурні фор мули , самостійно здобувати знання.
Обладнання: Таблиця „ Будова метану, етилену і ацетилену", кулестержневі
моделі.
Тип уроку: ВНМ(О)
Форми проведення: бліцопитування, бесіда, розповідь вчителя, робота з підручником, міні – практикум.
Хід уроку:
І. Організація класу.
ІІ. Оголошення теми і мети уроку.
ІІІ. АОЗ.
На дошці записані основні поняття теми:
• Насичені вуглеводні
• Гомолог
• Гомологічний ряд
• Гомологічна різниця
• Загальна формула насичених
• Суфікс в назвах
Бліцопитування по питанням:
1. Яка відмінність в складі і валентності у неорганічних і органічних сполук?
2. Яка відмінність у типах зв'язку і типах кристалічних граток у неорганічних і органічних сполук?
3. Які відмінності у властивостях неорганічних і органічних сполук?
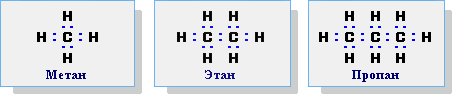
4. Запишіть молекулярну , складіть електронну і структурну формули метану. Вкажіть тип зв'язку.
IV. Мотивація навчальної діяльності.
Електронну і структурну формули метану ми вже навчилися складати, з'ясували, що Карбон в органічних сполуках завжди чотирьохвалентний. На це вказують чотири рисочки, які ми ставимо біля нього ,замінюючи спільні електронні пари. А як скласти електронні і структурні формули речовин подібних до метану? Сьогодні на уроці ми про це і дізнаємось.
V. ВНМ.
1. Даємо визначення насиченим вуглеводням. Знайомимо учнів з гомологічним рядом метану. Записуємо молекулярні формули, даємо їм назви. Звертаємо увагу на суфікс- ан. Виводимо загальну формулу насичених вуглеводнів – Сn H2n + 2 ( пропонуємо це спочатку зробити учням).
2. Вчимо учнів складати електронні і структурні формули гомологів метану.
Наприклад, для етану С2Н6
H H H H
. . . . ׀ ׀
H : С : С : H H ─ C─ C ─ H
. . . . ׀ ׀
H H H H
електронна формула структурна формула
Пояснюємо , що таке скорочена структурна формула Н3С – СН3
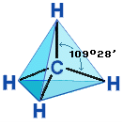
Пояснюємо просторову будову метану ( спрощено)
3. Даємо визначення поняттям „ гомологічний ряд", „ гомолог", „ гомологічна різниця".
VI. Усвідомлення і закріплення знань.
1). Міні – практикум .
Складаємо електронні і структурні формули інших гомологів метану:
пропану, бутану, пентану. Для цього користуємось прикладом в зошиті і підручником. З повних структурних формул виводимо скорочені. Ще раз звертаємо увагу учнів на поняття „ гомологічний ряд", „ гомолог", „гомологічна різниця".
2). Робота з підручником. Учні самостійно виписують поширення у природі і фізичні властивості метану і його гомологів.
VII. Підведення підсумків уроку. Чомучка.
1). Чому гомологи подібні за будовою?
2). Чому загальна формула насичених Сn H2n +2 ?
VIII. Домашнє завдання.
Урок 35. Тема: Метан. Електронна та структурна формули метану, поширення у природі. Гомологи метану. Молекулярні і структурні формули. Назви. Фізичні і хімічні властивості.
Мета: повторити молекулярну, електронну і структурну формули метану, з’ясувати знаходження у природі; вивчити гомологічний ряд метану, познайомитися з поняттями „ гомологічний ряд”, „ гомолог”, „ гомологічна різниця”; навчитися складати електронні і структурні формули гомологів метану, вивчити їх назви, загальну формулу ряду, фізичні властивості; розвивати вміння складати електронні і структурні фор мули , самостійно здобувати знання.
Обладнання: Таблиця „ Будова метану, етилену і ацетилену”, кулестержневі
моделі.
Тип уроку: ВНМ(О)
Форми проведення: бліцопитування, бесіда, розповідь вчителя, робота з підручником, міні – практикум.
Хід уроку:
І. Організація класу.
ІІ. Оголошення теми і мети уроку.
ІІІ. АОЗ.
На дошці записані основні поняття теми:
- Насичені вуглеводні
- Гомолог
- Гомологічний ряд
- Гомологічна різниця
- Загальна формула насичених
- Суфікс в назвах
Бліцопитування по питанням:
- Яка відмінність в складі і валентності у неорганічних і органічних сполук?
- Яка відмінність у типах зв’язку і типах кристалічних граток у неорганічних і органічних сполук?
- Які відмінності у властивостях неорганічних і органічних сполук?
- Запишіть молекулярну , складіть електронну і структурну формули метану. Вкажіть тип зв’язку.
IV. Мотивація навчальної діяльності.
Електронну і структурну формули метану ми вже навчилися складати, з’ясували, що Карбон в органічних сполуках завжди чотирьохвалентний. На це вказують чотири рисочки, які ми ставимо біля нього ,замінюючи спільні електронні пари. А як скласти електронні і структурні формули речовин подібних до метану? Сьогодні на уроці ми про це і дізнаємось.
V. ВНМ.
1. Даємо визначення насиченим вуглеводням. Знайомимо учнів з гомологічним рядом метану. Записуємо молекулярні формули, даємо їм назви. Звертаємо увагу на суфікс- ан. Виводимо загальну формулу насичених вуглеводнів – Сn H2n + 2 ( пропонуємо це спочатку зробити учням).
2. Вчимо учнів складати електронні і структурні формули гомологів метану.
Наприклад, для етану С2Н6
H H H H
. . . . ׀ ׀
H : С : С : H H ─ C─ C ─ H
. . . . ׀ ׀
H H H H
електронна формула структурна формула
Пояснюємо , що таке скорочена структурна формула Н3С – СН3
Пояснюємо просторову будову метану ( спрощено)

3. Даємо визначення поняттям „ гомологічний ряд”, „ гомолог”, „ гомологічна різниця”.
VI. Усвідомлення і закріплення знань.
1). Міні – практикум .
Складаємо електронні і структурні формули інших гомологів метану:
пропану, бутану, пентану. Для цього користуємось прикладом в зошиті і підручником. З повних структурних формул виводимо скорочені. Ще раз звертаємо увагу учнів на поняття „ гомологічний ряд”, „ гомолог”, „гомологічна різниця”.
2). Робота з підручником. Учні самостійно виписують поширення у природі і фізичні властивості метану і його гомологів.
VII. Підведення підсумків уроку. Чомучка.
1). Чому гомологи подібні за будовою?
2). Чому загальна формула насичених Сn H2n +2 ?
VIII. Домашнє завдання.


про публікацію авторської розробки
Додати розробку
