Урок "Методи одержання алканів, етену, етину, бензену. Застосування вуглеводнів"
Автор: Крупа Людмила Миколаївна
(загальноосвітня школа І-ІІІ ступенів №8 Світловодської міської ради)
Урок №15
Тема: Методи одержання алканів, етену, етину, бензену. Застосування вуглеводнів.
Мета: Ознайомити учнів з методами одержання алканів, етену, етину,бензену та галузями застосування вуглеводнів. Показати зв’язок будови, властивостей, застосування. Розвивати вміння писати хімічні рівняння, розв’язувати розрахункові задачі.
Формувати самоосвітню компетентністьучнів, розвивати логічне мислення Виховувати стійкий інтерес до хімії як науки, екологічну свідомість, колективізм .Розвивати в учнів уміння самостійно вивчати та аналізувати фактичний матеріал з теми. Виховувати культуру спілкування, вміння висловлювати свої думки.
Обладнання: картки –завдання, мультимедійна презентація уроку, інтернет- ресурси: https://www.youtube.com/watch?v=2SIlryucnJ8 ;
https://www.youtube.com/watch?v=n7VMP9bh0g4
Хід уроку
І. Організаційний етап
Добрий день! Перш ніж розпочати заняття , давайте з'ясуємо з яким настроєм ви сьогодні прийшли.
У кожного з вас на столі є картки різних кольорів. Подумайте і підніміть картку того кольору , який зараз найбільше імпонує вашому настрою.
Зелений гарний настрій
Помаранчевий поганий настрій
Жовтий нейтральний
Таким чином всі готові до активної взаємодії , тож нас чекає плідна робота.
ІІ. Актуалізація опорних знань
Метод « Хімічна естафета»
Учні відповідають на запитання( завдання висвітлюються на мультимедійній дошці). Вчитель кидає кубик одному з учнів. Учень зачитує перше питання і відповідає на нього, потім перекидає кубик іншому в будь якому напрямку.
- Як називаються вуглеводні, в молекулах яких є лише прості (ординарні) зв’язки?
- Назвіть загальну формулу насичених вуглеводнів.
- Як називаються вуглеводні, в молекулах яких є один подвійний зв’язок?
- Назвіть загальну формулу етиленових вуглеводнів.
- Як називаються вуглеводні, в молекулах яких є один потрійний зв’язок?
- Назвіть загальну формулу ацетиленових вуглеводнів.
- До яких гомологічних рядів належать речовини, формули яких наведено нижче:
А) С2Н4; Б) С5Н12; В) С4Н6; Г) С3Н8; Д) С2Н2; Е) С6Н6.
Назвіть речовини.
- Позначте суфікс, за допомогою якого утворюються назви гомологів метану:
А) –ан; Б). –ен; В). –ін (-ин); Г). –ил (-іл.).
- Позначте суфікс, за допомогою якого утворюються назви гомологів етилену:
А) –ан; Б). –ен; В). –ін (-ин); Г). –ил (-іл.).
- Позначте суфікс, за допомогою якого утворюються назви гомологів ацетилену:
А) –ан; Б). –ен; В). –ін (-ин); Г). –ил (-іл.).
- Як називаються вуглеводні, в молекулах яких є бензенове кільце.
- Назвіть загальну формулу аренів.
ІІ. Мотивація навчальної діяльності
Ми з вами завершуємо вивчати тему «Вуглеводні». На попередніх уроках ми познайомилися з будовою алканів, алкенів, алкінів,аренів їх фізичними і хімічними властивостями. Як добути алкани, етен,етин,бензен? Яке значення мають вуглеводні в нашому житті? В яких галузях ми їх використовуємо? Відповідь на ці запитання ми спробуємо дати на сьогоднішньому уроці
Тому тема нашого уроку: Методи одержання алканів, етену, етину,бензену. Застосування вуглеводнів
На сьогоднішньому уроці ми повинні з’ясувати: які є методи одержання алканів, етену, етину,бензену та з’ясувати галузі застосування вуглеводнів
Девіз уроку:
Зібратися разом- це початок,
Триматися разом- це прогрес,
Працювати разом- це успіх.
Генрі Форд
ІІІ. Вивчення нового матеріалу
Метод: демонстрація, розповідь, учні пишуть рівняння реакції на дошці під керівництвом учителя.
- Одержання алканів
Запропонуйте можливі способи одержання алканів з огляду на хімічні властивості вивчених вуглеводнів.
(Учитель коментує запропоновані учнями способи, пояснює нові.)
- Промислові способи добування алканів засновані на виділенні їх із природних речовин, головним чином із природного газу та нафти.
- Каталітичне гідрування бурого вугілля
![]() С + 2Н2 р,t, кат. СН4
С + 2Н2 р,t, кат. СН4
- Синтез на основі водяного газу (СО і Н2)
![]() СО + 3Н2 Nі СН4 + H2O
СО + 3Н2 Nі СН4 + H2O
- Гідрування алкенів
C2H4 + Н2 → С2Н6
- Гідрування алкінів
СН ≡ СН + 2Н2 → C2H6
За умови достатньої кількості водню етин може одразу сполучатися з максимальною кількістю водню та перетворюватися на етан: У лабораторних умовах алкани добувають такими способами:(додаткова інформація)
- Реакція Вюрца (подовження ланцюга)
СН3Cl + 2Na + ClCH3 → СН3 - CH3 + 2NaCl
С2Н5Br + 2Na + BrC2H5 → С4Н10 + 2NaBr
- Нагріванням натрієвих солей карбонових кислот з лугом
СН3СООNa + NaOH → CH4 + Na2CO3
- Гідроліз алюміній карбіду Al4C3 + 12 H2O → 4Al(OH)3 + 3CH4
2. Добування етену
Які ви знаєте способи одержання етену з огляду на хімічні властивості вивчених вуглеводнів.
 (Учитель коментує запропоновані учнями способи, пояснює нові.)
(Учитель коментує запропоновані учнями способи, пояснює нові.)
- У промисловості із нафти та інших природних джерел
-
Дегідрування етану:
C2H6 → С2Н4 + Н2 -
Гідрування ацетилену:
СН ≡ СН + Н2 → C2H4
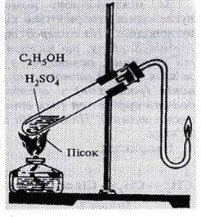
У лабораторії(відеодемонстрація)
- Дегідратація спиртів C2H5ОН (етанол) → C2H4 (етен) + Н2О
 3. Добування етину. Як можна одержати етин з огляду на хімічні властивості вивчених вуглеводнів?
3. Добування етину. Як можна одержати етин з огляду на хімічні властивості вивчених вуглеводнів?
(Учитель коментує запропоновані учнями способи, пояснює нові.)
У промисловості –
1. Крекінг метану 2CH4 → С2Н2 + Н2
2.Дегідрування етану C2H6 → С2Н2 + 2Н2.
3. Дегідрування етену C2H4 → С2Н2 + Н2
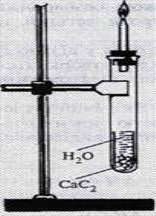
У лабораторїї
5.Карбідний метод- гідроліз кальцій ацетилен іду
( відеодемонстрація) CaC2 + 2H2O → CH≡CH+ Ca (OH) 2.
4.Добування бензену
Якими способами можна одержати арени з огляду на хімічні властивості вивчених вуглеводнів.
(Учитель коментує запропоновані учнями способи, пояснює нові.)
1. Дегідрування н-гексану
C6H14 → С6Н6 + 3Н2
2. Циклічна тримеризація ацетилену та його гомологів над активованим вугіллям за температури 600 °С (М. Д. Зелінський).
3C2H2 → С6Н6
Вчитель: Розглянемо галузі застосування вуглеводнів
Виступи учнів:
Застосування насичених вуглеводнів
![]()
![]()
![]()
|
Як паливо
|
В медицині, побуті
-В медицині для лікувальних теплових процедур
(до С15) в медицині, парфумерії , косметиці
Виготовлення мазей
|
Сировина хімічної промисловості
Н2, С (сажа), С2Н2,
галогенпохідні алканів: СН3Сl –в холодильних установках;
СН2Сl2 – розчинник СНСl3 – розчинник;
ССl4 – розчинник;
|
![]()

![]()



![]()
![]()




![]()
![]()

Застосування бензену та його похідних:
- Отрутохімікати
С6Cl6 - гексахлорбензен – протруюють насіння проти сажки
Пестициди
(отрутохімікати – засоби боротьби із шкідниками)
![]()
![]()
![]()
|
Інсектициди (із комахами) |
Фунгіциди (грибкові хвороби) |
Гербіциди (із бур’янами) |
- Розчинники
- Виготовлення вибухівки
- Добавка до пального
- В органічному синтезі для одержання барвників, полімерів, ліків.
ІV. Закріплення матеріалу
1. Робота в групах
Для цього ми зараз об’єднаємось у 3 групи:
Здійснити перетворення:
1група СН4 → С2Н2 → С2Н6 → СО2
2група СН4 → СН3Cl → C2H6 → C2H5Cl → C4H10 → CO2
3група CaC2 → C2H2 → C2H4 → (- CH2 - CH2 -)n
2.Вправа «Логічний ланцюжок»
Скласти логічний ланцюжок.
- Метан – горить - паливо
- Етен – полімеризується - …...
- Етин – гідратація - …..
- Метан – розклад - ….
- Бензен -- отруйний - ….
- Етин – горить - ….
3. Розв’язати задачу
Визначити молекулярну формулу вуглеводню, густина його за воднем становить 39. Масова частка Карбону в сполуці 92,3%
![]() Дано:
Дано:
DН2 (СхНy) = 39 1) М(СхНy) = DН2∙М(Н2) = 39∙2 = 78г/моль
ω (С) = 92,3% 2) ω (Н) = 100% - 92,3% = 7,7%
![]() 3) Найпростіша формула:
3) Найпростіша формула:
СхНy - ? 92,37 7,7
Х : У = –––– : ––––– = 7,7 : 7,7 = 1:1
12 1
Найпростіша формула: СН
М(СН) = 13г/моль
78:13 = 6
Шукана формула: С6Н6 – бензен
V.Рефлексія.
Діти, щоб дізнатися, чи досягли ми мети уроку, давайте використаємо технологію «Незакінчене речення».
Технологія «Незакінчене речення».
- Завдяки уроку ми дізналися про…
- На цьому уроці ми навчилися…
- На наступних заняттях я хочу…
- Найбільший успіх – це…
- Настрій на уроці був…
VI.Домашнє завдання
Опрацювати відповідний § підручника
Творче завдання: придумати ланцюг перетворень (10 рівнянь) обов’язковою речовиною в якому є метан.
Заключне слово вчителя.
Сьогодні на уроці ви застосовували раніше здобуті знання, оволоділи новими знаннями та практичними навичками. І все це через діяльність, через вашу працю. Працюйте й будьте щасливі!
1


про публікацію авторської розробки
Додати розробку