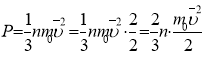Урок на тему: Ідеальний газ. Температура. Основне рівняння МКТ (10 клас)
Тема: Ідеальний газ. Температура. Основне рівняння МКТ.
Мета уроку: формувати уявлення про ідеальний газ, вивчити його параметри; про температурну шкалу Кельвіна, переведення температур у градусах Цельсіях; про основне рівняння МКТ, використовуючи його як модель ідеального газу.
Очікувані результати: а) знаннєвий компонент: учні оперують поняттями і термінами «ідеальний газ», « тиск газу», « температура», «основне рівняння МКТ газу»; б) діяльнісний компонент: учні вміють застосувати рівняння МКТ при розв’язуванні задач, переводити температуру в градусах Цельсія в температуру за шкалою Кельвіна; в) ціннісний компонент: здобувачі розуміють важливість природничої освіти.
Тип уроку: засвоєння нових знань; застосування знань, умінь і навичок.
Наочність і обладнання: портрети Цельсія, Больцмана, Кельвіна; відеофрагмент «ідеальний газ», експериментальне завдання- температурна шкала -https://www.vascak.cz/; механічний еквівалент теплоти - https://www.vascak.cz/.
Хід уроку
І. Організаційний момент
ІІ. Перевірка знань.
1. Калейдоскоп . Установіть відповідність.
2.Задача.
ІІІ. Формулювання теми, мети та задання уроку
Прокоментувати тему та вислів до уроку.
ІV.Мотивація навчальної діяльності
Ідеальний газ є вдалою моделлю фізики, яка дозволяє вивчити реальну поведінку газів при різних умовах. На даному уроці розглянемо докладніше, що таке газ ідеальний, формулою якою описується його стан , а також розраховується як його тиск та енергія; що називають температурною шкалою Кельвіна.
V. Актуалізація опорних знань
Мозковий штурм.
VІ. Вивчення нового матеріалу
1.Історична довідка.
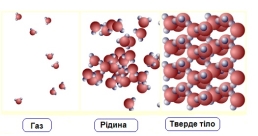
2.Ідеальний газ, властивості ідеального газу.
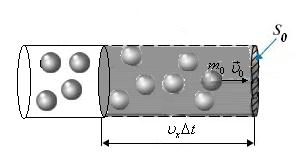
3.Основне рівняння молекулярно-кінетичної теорії ідеального газу.
4. Температура.
VІІ. Первинне осмислення нового матеріалу.
Фронтальна бесіда : запитання для самоперевірки до § 24,25.
VІІІ. Закріплення знань. Розв’язування задач.
ІХ. Підбиття підсумків уроку. Рефлексія.
Х. Домашнє завдання
Фізика : 10-й кл. підручник (рівень стандарту),2018.
Автор: Головко М.В.,Мельник Ю.С., Непорожня Л.В., Сіпій В.В.
Додаток до уроку
Тема: Ідеальний газ. Температура. Основне рівняння МКТ.
Вправа друзі, дає більше,
ніж гарне природне
обдарування.
Перевірка знань.1.Калейдоскоп . Установіть відповідність.
|
Визначення |
Формула |
Одиниця вимірювання |
|
Кількості речовини |
|
моль |
|
Молярна маса речовини |
|
г |
|
Маса заданої кількості речовини
|
|
г/моль |
|
Скільки атомів містить |
мідь кількістю речовини 3 моль ? залізо кількістю речовини 0,5 моль? |
|
Яку кількість речовини становить |
18•1023 молекул брому Вr2 З•1023 атомів Сульфуру |
2.Задача.
Актуалізація опорних знань. Мозковий штурм.
Що включає в себе поняття :
|
Молекула |
|
|
Кількість речовини |
|
|
Маса |
|
Опорний конспект.
1.Історична довідка
|
|
Італійський фізик і хімік. Основні праці присвячені молекулярній фізиці. У 1811 р. відкрив важливий для фізики та хімії закон, згідно з яким при однакових температурах і тисках у рівних об’ємах різних газів міститься однакова кількість молекул. Згідно закону 1 кмоль будь-якого ідеального газу при нормальних умовах займає об’єм 22,4 м3. Виходячи з цього закону запропонував метод визначення атомних мас елементів і молекулярних мас речовин. |
|
|
Про броунівський рух знає нині кожен учень загальноосвітньої школи. Це хаотичний рух мікрочастинок, завислих у рідинах і газах внаслідок поштовхів з боку їх молекул. Вчений, який відкрив це явище, - шотландець Роберт Броун - був не фізиком, а ботаніком. У 1805-му році він привіз з Австралії небачену раніше колекцію - близько чотирьох тисяч видів різних рослин. Розвиток механічної теорії теплоти. Було показано, що при мимовільному переході теплоти від точки з більш високою температурою до точки а більш низькою температурою робота проводиться тільки в разі істотної різниці температур, бо частина теплоти неминуче розсіюється в навколишнє середовище. Цей висновок можна узагальнити і поширити на будь- який вид енергії. |
2.Ідеальний газ.
|
Назва |
Визначення |
|
|
Ідеальний газ |
модель реального газу, у якій молекули можна вважати матеріальними точками які майже не взаємодіють між собою. |
|
|
Властивості ідеального газу |
1.Молекули – матеріальні точки певної маси (займають безмежно малий об’єм в порівнянні з об’ємом посудини); 2.При зіткненні між собою та зі стінками посудини ведуть себе як пружні кульки; 3.Молекули рівномірно розподілені по об’єму. |
|
|
Одноатомний ідеальний газ: |
Н, Не, Хе ,… |
|
|
Двоатомний ідеальний газ:
|
Н2, О2, СО, …
|
|
|
Багатоатомний ідеальний газ:
|
Н2О, СО2,….
|
|
|
Параметри ідеального газу
|
тиск (р), об’єм (V), температура (Т) маса (m) густина (ρ) теплоємність (с) |
Па м3 К ,0С Кг кг/м3
Дж/кг 0С |
|
Стан газу
|
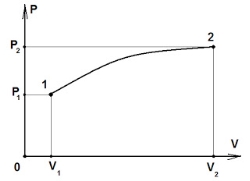
це стан, який характеризується певними термодинамічними параметрами; при підвищенні тиску на газ, зменшується його об’єм; при нагріванні стержня зростають його лінійні розміри. |
|
|
Основне рівняння молекулярно-кінетичної теорії ідеального газу
|
|
|
3. Температура.
|
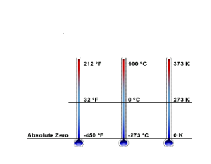
Абсолютний нуль
|
це температура, при якій припиняється поступальний рух молекул і тиск ідеального газу наближається до нуля. Розглянемо залежність тиску ідеального газу від температури |
|
|
Шкала Цельсія |
в цій шкалі є температури від’ємні, нульова і додатні. Температура по шкалі Цельсія позначається t і вимірюється в 0С. |
|
|
Шкала Кельвіна
|
в цій шкалі є температури нуль і додатні. Температура по шкалі Кельвіна називається термодинамічною або абсолютною. Позначається Т і вимірюється в К |
|
|
Переведення температури з однієї шкали в іншу. Дослід Штерна |
Т= t+273 – так переводять 0С в К. t =Т-273 – так переводять К в 0С. |
|
Закріплення знань. Розв’язування задач.
|
І рівень |
1.Температуру, за якої має припинитися тепловий рух молекул, називають: а) 0 °С; б) Абсолютним нулем. в) Абсолютною температурою; г) 0 °F. 2.Чому гази за високої температури можна вважати ідеальними? 3.Чому гази за високої температури можна вважати ідеальними? |
|
ІІ рівень |
Вкажіть рядок, у якому правильно переведено в градуси, Цельсія 298 К. а) 23°С ; б) 21°С; в) 25°С; г) 15°С б)Знайдіть масу молекули води ? |
|
ІІІ рівень |
1. Опишіть рідинний термометр як фізичний прилад за планом характеристики фізичного приладу. 1. Призначення. 2. Будова. 3. Принцип дії. 4. Сфера застосування. 5.Переваги і недоліки |
|
ІІІ рівень |
Який тиск азоту, якщо середня квадратична швидкість його молекул 500 м / с, а його щільність 1,36 кг / м3? |
|
ІV рівень |
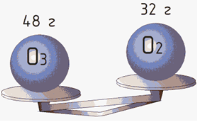
Є дві однакові посудини. В одній із них знаходиться кисень, а в іншій азот. Число молекул кожного газу й середня квадратична їх швидкість однакові. Тиск кисню дорівнює 32 кПа. Чому дорівнює тиск азоту? |
Підсумок
Доповнити визначення
1.Частинки ідеального газу - сферичні тіла…
2. Між частинками відсутні сили…
3. Зіткнення частинок є … пружними.
Рефлексія
Написати коментар до уроку. Чи сподобався урок ? Що саме.
Домашнє завдання. Основне :§24,25
1.Вивчити теоретичний матеріал за конспектом.
2.Вправо до § 24( 4д),§25 (3с,6д)-письмово.
3.Виконати творче завдання (вибрати одне з двох).
4.Охарактеризувати медичний термометр як фізичний прилад.
5.Порівняти термометри для вимірювання температури повітря на вулиці та вимірювання води у ванні .


про публікацію авторської розробки
Додати розробку