Урок на тему"Основи. Властивості і застосування гідроксидів Натрію і Кальцію
Тема : Основи. Властивості і застосування гідроксидів Натрію і Кальцію
Мета: Систематизувати знання про хімічні властивості гідроксидів Натрію і Кальцію , удосконалити навички складання рівнянь реакцій; сформувати вміння порівнювати хімічну активність металів; формувати експериментальні вміння; розвивати в учнів уміння працювати групою, висловлювати свої думки, виховувати почуття толерантності ,
Методи і методичні прийоми: робота в групах, «асоціативний кущ»,вправи «Незакінчене речення», «Гонка за лідером»,виконання практичних дослідів.
Обладнання: роздатковий матеріал, мультимедійний проектор, комп’ютер, реактиви і посуд згідно з з інструкціями до хімічного експерименту.
Тип уроку: узагальнення та систематизації знань
Епіграф уроку: «Єдиний шлях , що веде до знання – це діяльність»
Бернард Шоу
Хід уроку.
І. Організація класу.
Шановні учні, сьогодні на уроці нам доведеться наполегливо працювати над узагальненням вивченого матеріалу,а людина озброєна знаннями на цілий крок ближче до життєвого успіху.
Назвіть,відомі вам, складові успіху ( знання,талант, натхнення, досвід, працьовитість, інтуїція, здібність, систематичність, зосередженість,…).
То ж будьте завжди працьовитими, допитливими, рішучими, організованими, активними, пунктуальними у роботі.
ІІІ.Актуалізація опорних знань
У 8 класі ви дізналися ,що серед кількох найважливіших класі неорганічних речовин є клас основ.
1. Які речовини називають основами ?
2. Яка загальна формула основ?
3. Як класифікують основи?
4. Луги-це
5. Як визначити валентність металу в гідроксиді?
6. Які елементи належать до лужних металів ?
7. Які елементи називають лужно-земельними?
8. Зобразіть на дошці електронні формули Naта Са та дайте характеристику елемента за будовою атома.
9. Охарактеризуйте Na і Cа за положенням в періодичній системі.
ІV. Мотивація навчальної діяльності.
Проблемне завдання
На столі вапно ,мило ,зубна паста ,Крот,цукор,миючий засіб.Подумайте та розділіть ці предмети на дві групи та поясніть свої дії.
Вчитель: Натрій гідроксид та кальцій гідроксид добувають у промисловості у великих обсягах,які щороку становлять у різних країнах десятки мільйонів тонн. Натрій гідроксид є лугом ,найуживанішим у хімічних лабораторіях –наукових ,виробничих ,навчальних. Кальцій гідроксид широко використовується у будівництві,харчовій промисловості,стоматології,хімічній та нафтопереробній галузях. Тому ,предметом вивчення сьогодні ми обрали саме ці гідроксиди.
V. Оголошення теми й мети уроку.
VІ.Вивчення нового матеріалу
План
1.Фізичні властивості гідроксидів кальцію та натрію.
Тривіальна назва натрій гідроксиду-їдкий натр,а кальцій гідроксиду – гашене вапно. Дані гідроксиди ,як і інші основи - тверді речовини. Натрій гідроксид ,який найчастіше використовується у лабораторній практиці,має вигляд гранул або пластівців,а кальцій гідроксид – білий порошок.
Визначте фізичні властивості розчинних основ, склавши речення

Більшість основ не розчиняються у воді.Гідроксиди лужних елементів і Барію є розчинними (за 20 °С у 100 г води розчиняється 100 г натрій гідроксиду), а сполуки Mg(OH)2 і Ca(OH)2-малорозчинними (за 20 °С у 100 г води розчиняється 0,16 г кальцій гідроксиду). Натрій гідроксид-гігроскопічна речовина , її розчинення у воді супроводжується виділенням теплоти.
Луги – сильні електроліти. Розчиняючись у воді,вони дисоціюють на йони з яких складаються.
Написати рівняння дисоціації натрій гідроксиду та кальцій гідроксиду
Водний розчин кальцій гідроксиду називають вапняною водою.
Луги –милкі на дотик ,роз’їдають шкіру і тканини,тому їх називають їдкими. Якщо розчин лугу потрапив на руку ,треба змити його великою кількістю проточної води. Потім ,щоб знешкодити залишки лугу,обробити уражене місце розчином оцтової кислоти і знову промити проточною водою.
Тверді луги та їх водні розчини зберігають у добре закритому посуді, бо вони реагують з вуглекислим газом повітря і перетворюються на карбонати.
Написати рівняння реакції
Луги руйнують скло, порцеляну, вовну, шовк і шкіру. Оскільки луги роз'їдають скло, їх зберігають у поліетиленовій тарі.
При нагріванні основи не плавлятьcя,а розкладаються на відповідні оксиди і воду.Кальцій гідроксид зазнає розкладу за температури 580 градусів.
2.Хімічні властивості гідроксидів натрію та кальцію.
Робота в групах
На початку вивчення розділу «Метали» ви об’єдналися в групи. Пригадаємо
Правила роботи в групі:
- Не перебивати один одного.
- Допомагати.
- Поважати.
- Слухати.
- Бути доброзичливим.
- Кожна думка має право на існування.
- Бути толерантним.
- Бути активним.
Кожна група отримала завдання дослідити, як взаємодіють дані луги з речовинами, використовуючи підручник та додаткову літературу. Крім того,ви маєте набір реактивів для потрібних вам дослідів. Та пам’ятайте ,що розчини лугів роз’їдають шкіру ,тканини,становлять небезпеку для слизових оболонок і особливо очей,спричиняють тяжкі опіки. Працювати з ними потрібно дуже обережно.
Група «Кольорові» досліджувала дію лугів на індикатори
Група «Кислі » з’ясовувала взаємодію лугів з кислотними оксидами
Група «Нейтральні» досліджувала взаємодію лугів з кислотами
Група «Амфотерні» вивчала взаємодію лугів з металами ,оксиди та гідроксиди яких мають амфотерні властивості,а також амфотерними оксидами;
Група «Нерозчинні» досліджувала взаємодію лугів з солями.
Група «Органічні»досліджувала взаємодію лугів з органічними речовинами
Цей етап уроку я назвала «Нудьгувати ніколи», тому що ми знайомимося з презентаціями груп і працюємо разом з ними, занотовуючи у робочий зошит рівняння реакцій та висновки, заповнюючи узагальнюючу схему хімічних властивостей даних гідроксидів.
Група «Кольорові»
Середовище водних розчинів експериментально можна визначити різними способами.Одним із способів є застосування індикаторів, які змінюють своє забарвлення при зміні середовища розчину. Розчини лугів змінюють забарвлення індикаторів.
В якості індикаторів найчастіше на практиці використовують:
• метилоранж,
• лакмус,
• фенолфталеїн,
• універсальний індикатор.
У три пробірки налиємо по 0.5мл розчинів натрій гідроксиду та у три пробірки - кальцій гідроксиду .До кожної пробірки додамо по черзі індикатор. У розчинах лугів фіолетовий лакмус набуває синього забарвлення,безбарвний фенолфталеїн-малинового,оранжевий метилоранж-жовтого,універсальний індикатор-синьо-зеленого. Зміна кольору індикатора спричинена наявністю у розчині лугу гідроксид-аніонів ОН. Цю властивість лугів використовують для розпізнавання їх серед інших речовин.
Група «Кислі»
Зараз ми переглянемо відео взаємодії кислотних оксидів з основою і запишемо рівняння реакції.
https://www.youtube.com/watch?v=9OFZHf8WFy0
![]() CO2+ Ca(OH)2 = CaCO3 + H2O
CO2+ Ca(OH)2 = CaCO3 + H2O
Характерною ознакою даної реакції є утворення білого осаду. Що засвідчує даний дослід? Дослід засвідчує те, що розчинні основи (луги) можуть взаємодіяти з оксидами неметалів, тобто кислотними оксидами, утворюючи сіль і воду.
Зверніть увагу, утворюється сіль тієї кислоти, яка відповідає даному кислотному оксиду. У даному разі кислотному оксиду С02 відповідає кислота Н2С03, ось чому у формулі солі поряд з хімічним символом металу Са стоїть не оксид С02, а кислотний залишок С03 тієї кислоти, яка відповідає цьому оксиду.
Запишіть рівняння реакції між натрій гідроксидом і сульфур (VI) оксидом.
2NaOH + SO3 = Na2SO4 + H2O
6KOH + P2O5 = 2K3PO4 + 3H2O
Група «Нейтральні»
Луги взаємодіють із кислотами ,утворюючи сіль і воду. Реакція між кислотою та основою , внаслідок якої утворюється сіль і вода називається реакцією нейтралізації.
Демонстраційний дослід
У дві пробірки налиємо розчини: в першу — натрій гідроксиду, в другу — кальцій гідроксиду. У кожну пробірку додай по 1—2 краплі фенолфталеїну Спостерігаємо малинове забарвлення розчину у пробірці. Це свідчить ,що дані розчини створюють лужне середовище. Далі до вмісту двох пробірок краплями додаємо розбавленої хлоридної кислоти до повної нейтралізації лугу — натрій гідроксиду та кальцій гідроксиду. Спостерігаємо зміну забарвлення розчину.Утворилася сіль і вода.
Рівняння відповідних реакцій:
NaOH + НСІ = NaCl + Н20
Са(ОН)2 + 2НСl = СаСl2 + 2Н20
KOH + HNO3=KNO3 + H2O
Група «Амфотерні»
Демонстраційний дослід
У дві пробірки помістимо по 1мл натрій гідроксиду та додамо в одну пробірку гранулу алюмінію,в другу-гранулу цинку
Взаємодія лугів з металами ,оксиди та гідроксиди яких мають амфотерні властивості,а також амфотерними оксидами
Алюміній перебуває в ряду активності зліва від водню, а оксид і гідроксид Алюмінію — амфотерні сполуки. Сукупність цих чинників уможливлює взає-модію між металом і лугом:
2Al + 6NaOH = 2Na3AlO3 + 3H2↑.
натрій ортоалюмінат
Кислотний залишок у формулі солі відповідає амфотерному гідроксиду Al(OH)3 як кислоті — H3AlO3. Наведене рівняння описує реакцію алюмінію з твердим лугом при нагріванні або його розплавом, тобто за відсутності води. Якщо з металом взаємодіє луг у водному розчині (мал. 65), то утворюються розчинні алюмінати Na3[Al(OH)6] і Na[Al(OH)4]:
2Al + 6NaOH (надлишок) + 6H2O = 2Na3[Al(OH)6] + 3H2↑;
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑.
Формули цих солей можна вивести, замінюючи кожний атом Оксигену у формулах Na3AlO3 і NaAlO2 на дві гідроксогрупи .
Аналогічно відбуваються реакції з утворенням цинкатів Na2ZnO2, Na2[Zn(OH)4] та інших подібних солей, які походять від амфотерних гідроксидів як кислот.
2NaOH + Zn = H2 + Na2ZnO2 натрій цинкат
Група «Нерозчинні»
Луги взаємодіють з розчинними солями ,якщо утворюється нерозчинна сполука-сіль,основа чи амфотерний гідроксид.
Демонстраційний дослід
У три пробірки помістимо по 1 мл натрій гідроксиду ,до першої додамо декілька крапель Манган(ІІ)хлориду, до другої - купрум(ІІ) сульфату ,до третьої – ферум (ІІ)хлориду. Спостерігаємо утворення осаду
МnCl2+2NaOH=Mn(OH)2+2NaCl
CuSO4+2NaOH=Cu(OH)2+Na2SO4
FeCl2+2NaOH=Fe(OH)2+2NaCl
Група «Органічні»
Феноли – органічні речовини, в молекулах яких гідроксильні групи сполучені з бензольним кільцем.Фенол дуже отруйний .Спричиняє опіки шкіри, органів дихання, ураження травного тракту, нервової системи, особливо чутливі печінка та нирки
Взаємодія з лугами фенолу
С6Н5ОН + NaОН = С6Н5ОNa + H2О
-карбонові кислоти
HCOOH + NaOH =НСООNа+Н2О
-естери
СН3СООС2Н5 + NaОH = СН3СООNa + НО-С2Н5 – необоротна реакція
Унаслідок лужного гідролізу жирів добувають гліцерин і мила - натрієві та калієві солі вищих карбонових кислот
3.Застосування гідроксидів натрію та кальцію.
Презентація
Натрій гідроксид в природі не трапляється. Добувають її з природної сировини — кухонної солі, пропускаючи через водний розчин цієї солі постійний струм. Між водою й сіллю відбувається окисно-відновна реакція, серед продуктів якої є луг.
Отримання гідроксиду кальцію в промисловому масштабі можливо шляхом змішування оксиду кальцію з водою, цей процес називається гасінням.
У лабораторних умовах отримання гідроксиду кальцію можливе шляхом змішування водного розчину хлориду кальцію і гідроксиду натрію. У мінеральній формі гідроксид кальцію міститься в деяких вулканічних, глибинних і метаморфічних породах. Також отримання гідроксид кальцію відбувається при спалюванні вугілля.
Застосування гідроксиду кальцію
Широке застосування гідроксид кальцію отримав у виробництві таких будівельних матеріалів, як білило, штукатурка і гіпсові розчини. Він використовується як недорогого замінника лугу у вигляді суспензій (вапняне молоко), які використовуються на дубильні для видалення волосся зі шкур, а також у виробництві цукру і для побілки стовбурів дерев.
Вапняна вода являє собою насичений водний розчин гідроксиду кальцію білого кольору. Антацидні властивості гідроксиду кальцію використовуються в медицині для лікування кислотних опіків.
Корисною властивістю гідроксиду кальцію є його здатність виступати в ролі флокулянта, що очищає стічні води від зважених і колоїдних частинок. Він також використовується для підвищення рН води, так як в первісному вигляді вода містить кислоти, здатні піддавати сантехнічні труби корозії.
Також гідроксид кальцію широко застосовується в таких галузях, як:
• Дорожнє будівництво - для поліпшення якості земляний ґрунту;
• Виробництво металів - гідроксид кальцію вводять в потік відпрацьованого газу, щоб нейтралізувати кислоти, такі як фториди і хлориди до випуску в атмосферу;
• У нафтопереробної промисловості - для виробництва добавок до масел;
• У хімічній промисловості - для виробництва стеарату кальцію;
• У нафтохімічній промисловості - для виробництва твердих масел різних типів;
• Виробництво антигрибкових і антимікробних консервантів - для зберігання овочів в ангарах.
Гідроксид кальцію використовують як добавки в морську воду для скорочення атмосферного CO 2 та пом'якшення парникового ефекту.
Також гідроксид кальцію використовується як натуральна альтернатива інсектицидів, ефективна в боротьбі з кліщами, блохами, жуками та їх личками.
У будівництві гідроксид кальцію використовується для побілки дерев'яних парканів і обмазуванні крокв, щоб захистити матеріали від гниття і займання, а також для приготування силікатного бетону і вапняного будівельного розчину.
Гідроксид кальцію також бере участь у процесах виготовлення ебоніту, хлорного вапна, бакових сумішей, кремів для депіляції і гальмівних накладок.
Властивість гідроксиду кальцію знижувати питомий опір грунту використовується при влаштуванні вогнищ заземлення для електротехніки.
У стоматології гідроксид кальцію застосовується як дезинфектора для кореневих зубних каналів.
У харчовій промисловості гідроксид кальцію в надлишку використовується як харчова добавка Е526, яку додають при виробництві:
• Цукрової тростини;
• Алкогольних і безалкогольних напоїв;
• Енергетиків;
• Фруктових соків;
• Дитячого харчування;
• Маринованих огірків;
• Харчової солі;
• Кондитерських виробів і солодощів;
• Какао-продуктів;
• Кукурудзяних коржів;
• Борошняних виробів і випічки.
В Іспанії гідроксид кальцію використовують для приготування мамалиги, оскільки вважають, що він сприяє кращому засвоєнню страви.
Корінні племена американських індіанців використовують гідроксид кальцію як інгредієнт для психоделічного тютюну Япу, одержуваного з насіння бобових дерев виду Анаденантера.
В Афганістані гідроксид кальцію використовується у виробництві тютюну Нісвар, що виготовляється з свіжого листя тютюну, індиго, кардамону, ментолу, олії, гідроксиду кальцію і деревної золи. Жителі Афганістану також використовують гідроксид кальцію як фарби для своїх глінобетона будинків. Найбільшими споживачами гідроксиду кальцію в світі вважаються такі країни, як Афганістан, Пакистан, Індія, Швеція та Норвегія.
VІІ. Узагальнення і систематизації знань
1. Здійсніть перетворення
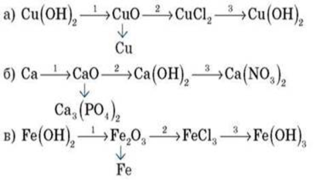
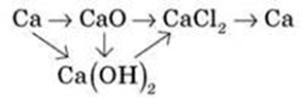
Гонка за лідером
2. Закінчіть рівняння реакції. Завдання виконується на швидкість за рядами.
1 ряд
1. Be(OH)2+HCl=
2. СuSO4+NaOH =
3. Ba(OH)2+H2CO3=
4. LiOH + SO3=
5. NaOH + CO2 =
2 ряд
1. Mg(OH)2+HF=
2. СuSO4+KOH =
3. Ba(OH)2+H2CO3=
4. KOH + SO2=
5. LiOH + CO2 =
3 ряд
1. Mn(OH)2+HI=
2. СuSO3+LiOH =
3. Ca(OH)2+H2SO3=
4. NaOH + SO2=
5. KOH + CO2 =
VIII.Закріплення знань
( розв´язування завдань практичного спрямування)
- Реакція сечі у здорової людини при змішаному харчуванні наближається до нейтральної, при вживанні переважно м´ясної їжі – реакція більш кисла, а рослинної – лужна. Реакція сечі визначає вірогідність утворення каміння. Якщо реакція лужна, є вірогідність утворення фосфатних каменів. Як можна визначити на практиці реакцію сечі? \ за допомогою індикаторів.\
- Свіжі м´ясо чи риба мають слабо нейтральну реакцію. Як можна визначити, чи свіже м´ясо ми придбали? \ теж за допомогою індикаторів, зокрема лакмусового папірця\.
Учитель: у вас на кожній парті на чашку Петрі поміщено шматочки м´яса та риби. Поряд є індикатор\ лакмусовий папір\. Спробуємо перевірити, чи наші продукти свіжі.
- Несвіже м´ясо має слабо лужну реакцію. Чому його вимочують у розчині оцтової кислоти? \для того, щоб відбулася реакція нейтралізації.\ Спробуємо записати подібну реакцію:
NaOH + HCl = NaCl + H2O
- Що треба зробити, якщо грунтизакислилися? \ додати до грунту вапна Са(ОН)2\
H2SO3 +Са(ОН)2 = CaSO3 +2 H2O
5.Коли нас кусають мурашки, вони в маленькі ранки виділяють мурашину кислоту. Як ми можемо її знешкодити? \це місце треба обробити нашатирним спиртом NH4OH, який є лугом.\
6. Перегляд відеофільму про додавання лугів до миючих засобів. Питання до учнів: чому нам бажано одягати гумові рукавички?/ щоб руки не роз´їло лугом/
VІІ. Домашнє завдання
VІІ. Підбиття підсумків уроку


про публікацію авторської розробки
Додати розробку
