Урок на тему: "Закон збереження маси речовини під час хімічних реакцій. Схема хімічної реакції. Хімічні рівняння"
1
Урок хімії в 7 класі
Тема: Закон збереження маси речовин під час хімічних реакцій. Схема хімічної реакції. Хімічні рівняння
Мета: ознайомити учнів із законом збереження маси речовин; сформувати уявлення про роботи Р. Бойля, М.В. Ломоносова й А. Л. Лавуазьє в цій галузі, пояснити значення закону збереження маси в хімії; розкрити сутність хімічних реакцій. Почати формувати навички учні у підборі коефіцієнтів у схемах реакцій. Виховувати пізнавальний інтерес учнів.
Тип уроку: набуття нових знань і навичок.
Основні терміни й поняття: закон збереження маси речовин, схема реакції, коефіцієнти, рівняння реакцій.
Хід уроку
І. Організаційний момент
ІІ. Перевірка домашнього завдання
ІІІ. Мотивація навчальної діяльності, визначення теми, мети й завдань уроку
Учням 7 класу було передано листа.
«Шановні семикласники! Пише вам Незнайко. Спасибі вам за листа, в якому ви мені дуже зрозуміло пояснили різницю між фізичними й хімічними явищами. Мене дуже цікавить питання. Чи будуть змінюватися маси речовин після реакції. Коли я дивлюся на свічку, що горить, я бачу. Що вона зменшується, значить, маса буде зменшуватися. Коли я про це розповів Знайкові, він тільки посміхнувся й порадив мені читати підручник. Але я там відповіді не знайшов. Допоможіть мені розібратися в цьому питанні.
Чекаю від вас листа з роз’ясненням. З повагою Незнайко».
Відеофрагмент



IV. Вивчення нового матеріалу
Досліди Р. Бойля і М. Ломоносова
Знаменитий англійський фізик Бойль, прожарюючи у відкритій реторті різні метали та зважуючи їх до й після нагрівання, з’ясував, що маса металів збільшується. Він зробив висновок, що маса речовин у результаті хімічної реакції змінюється. Бойль стверджував, що існує якась «вогняна матерія», що в разі нагрівання металу з’єднується з останнім, збільшуючи його масу.
Ломоносов, на відміну від Бойля, прожарював метали не на відкритому повітрі, а в запаяних ретортах і зважував їх до й після прожарювання. Згідно з цими дослідами, маса речовин до й після реакції залишалася без змін.
Як ви вважаєте, де істина? Дайте обґрунтовану відповідь.
(Демонстрація досліду, що підтверджує закон збереження маси речовин. Висновок: маси речовин до й після хімічної реакції однакові)



1748 року Ломоносов сформулював результати своїх дослідів у вигляді закону збереження маси: «Усі зміни, що відбуваються в натурі, мають таку суть, що скільки чого в одного тіла віднімається, стільки додається до іншого: так коли де убуде трохи матерії, о збільшиться в іншому місці». На думку Ломоносова, метали, що нагріваються, з’єднуються з корпускулами повітря, при цьому металева зола в посудині стаєважчою, отже, повітря, що міститься в посудині, зменшується у вазі на стільки ж.
1789 року закон збереження маси незалежно від Ломоносова сформулював французький хімік Лавуазьє. Він показав, що метал внаслідок нагрівання перетворюється на окалину в результаті приєднання порції найзвичайнісінького повітря. Окалина важча за метал, з якого вона утворилася, рівно на стільки, скільки важить кількість повітря, що з’єднується з металом.
Закон збереження маси увійшов в історію як закон Ломоносова – Лавуазьє. Його сучасне формулювання таке:
Загальна маса речовин, що вступили в хімічну реакцію, дорівнює загальній масі речовин, одержаних у результаті реакції.
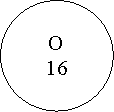
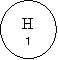
Дамо пояснення цьому закону з точки зору атомно-молекулярного вчення на прикладі реакції розкладу води під дією постійного електричного струму.
Робота зі схемою
Схема розкладання молекул води під дією постійного електричного струму

![]()









m1 = m2
Запитання класу
- Що відбувається з молекулами води під час пропускання через неї постійного електричного струму?
Отже, під час хімічних реакцій молекули вихідних речовин руйнуються до атомів. Молекули нових речовин утворюються з тих же атомів, з яких склалися молекули вихідних речовин. Оскільки кожен атом має певну масу й атоми під час хімічних реакцій зберігаються, то загальні маси речовин до й після реакці теж будуть однаковими.
Наприклад, схема реакції:
![]()
![]()
![]() Н2О → Н2 + О2
Н2О → Н2 + О2
вихідні продукти
речовини реакції
Схема реакції показує, які речовини прореагували та які утворилися після реакції.
Щоб показати, що кількість атомів не змінюється під час реакції, и повинні підібрати коефіцієнти у схемах і перетворити схему на рівняння.
Хімічне рівняння – це умовний запис хімічних реакцій з допомогою хімічних формул і коефіцієнтів.
2H2O → 2H2 + O2
4 ат. Н 4 ат. Н 2 ат. О
2 ат. О
Завдання класу
- Доведіть математично закон збереження маси речовини:
2H2O → 2H2 + O2
4 ат. Н 4 ат. Н 2 ат. О
2 ат. О
2*(2*1+16) = 36;
4*1 + 2*16 = 36;
36 = 36
- Допишіть рівняння реакції утворення йодоводню, використовуючи схематичне зображення реакції:
![]()
H2 + I2 → …
- Допишіть рівняння реакції утворення сірководню, використовуючи схематичне зображення цієї реакції:
![]()
H2 + S → …
Гра «Хто швидше?»
Спочатку виконуємо варіант А, а потім варіант В.
Не забувайте, що коефіцієнти – невеликі цілі числа, що стоять перед формулами речовин і зрівнюють кількість атомів кожного елемента до й після реакції.
|
А |
В |
|
K + S → K2S |
HI → H2 + I2 |
|
Al + N2 → AlN |
HgO → Hg + O2 |
|
N2 + O2 → NO |
HCl → H2 + Cl2 |
|
K + H2 → KH |
Ag2O → Ag + O2 |
|
N2 + H2 → NH3 |
AgCl → Ag + Cl2 |
|
Al + S → Al2S3 |
NH3 → N2 + H2 |
|
H2 + O2 → H2O |
H2O2 → H2O + O2 |
|
Li + O2 → Li2O |
CuO → Cu + O2 |
Бесіда
- Чим відрізняються схеми А від схеми В? (У схемі А утворюються нові складні речовини з простих, у схемі В складні речовини руйнуються й утворюються нові речовини)
- Чи можна за схемами й рівняннями реакцій здогадатися, що за явище відбувається? (Так)
- Яке значення закону збереження маси речовин?
Після обговорення записуємо в зошит висновок
Значення закону збереження маси
- Під час реакцій вихідні речовини руйнуються до атомів, атоми перегруповуються і входять до складу продуктів реакцій, їх кількість залишається незмінною.
- Закон дозволяє складати рівняння реакцій і здійснювати за ними розрахунки.
V. Підбиття підсумків уроку
VІ. Домашнє завдання
Написати листа Незнайкові


про публікацію авторської розробки
Додати розробку
