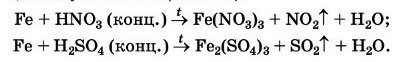Урок на тему : Залізо: фізичні і хімічні властивості.
11 клас Урок № 42 Дата ________
Тема : Залізо: фізичні і хімічні властивості.
Навчально-освітня мета: продовжити формувати вміння із застосування інформації про загальні властивості металів, застосовувати її при вивченні конкретного металічного елемента та його сполук.
Повторити положення Феруму в Періодичній системі та особливості будови як елементу побічної групи. Продовжити формувати уміння характеризувати фізичні і хімічні властивості речовин за допомогою хімічних реакцій.
Формувати життєві , полікультурні та математичні компетентності .
Обладнання: проектор , доступ до Інтернету.
Тип уроку: урок набуття нових знань.
Хід уроку
І. Організаційний момент
ІІ. Актуалізація опорних знань
1.Фронтальна бесіда
- Де розташовані метали в періодичній системі?
- Яку будову мають атоми металічних елементів?
- Як змінюються металічні властивості по групах і періодах періодичної системи?
- Чому в хімічних реакціях метали лише відновники?
- Як металічний зв’язок і будова металічної кристалічної ґратки вплинули на фізичні властивості металів?
- Охарактеризуйте фізичні властивості металів.
- Який принцип покладений в основу електрохімічного ряду напруг?
- Що таке амфотерність..
ІІІ. Вивчення нового навчального матеріалу
1. Пошукова співбесіда (з елементами самоосвіти)
|
1. Характеристика Феруму за положенням у періодичній системі: - розташований у ІV періоді, VІІІ групі, побічній підгрупі. - Будова атома: порядковий номер 26, в атомі міститься 26 протонів, 26 електронів, 30 нейтронів. Електрони розподілені на 4 енергетичних рівнях Електронна формула атома — 1s22s22p63s23p63d64s2. - Ступені окиснення Феруму та тип хімічного зв’язку: проявляє ступінь окиснення +2, +3 електрони проявляє валентність |
Учні на підставі стор 150 |
|
2. Фізичні властивості заліза: — сріблясто-блискучий метал, має високу пластичність, легко намагнічується і розмагнічується. |
|
|
3.Поширення Феруму в природі: після Алюмінію — найпоширеніший. |
стор 148 |
|
4. Найважливішими залізними рудами є Fe3O 4 — магнітний залізняк; FeS2 — пірит. Fe2 O 3 — червоний залізняк; Fe2O3*H 2 О — бурий залізняк; |
Мал.68 стор 149 |
Хімічні властивості заліза
|
І. Пірофорність – здатність до самозаймання на повітрі в подрібненому вигляді. |
|
|
ІІ. Взаємодія з простими речовинами — неметалами - з галогенами при нагріванні( валентність максимальна) - з киснем ( окислюється або згоряє – утворює залізну окалину) https://www.youtube.com/watch?v=8CfN3NQfWK0 - з сіркою https://www.youtube.com/watch?v=_aYk_ligrfU
|
мал. 70-71 стор 151
відео Рівняння самостійно |
|
- На повітрі легко окислюється в присутності вологи:
|
|
|
ІІІ.. Взаємодія зі складними речовинами: 1. Взаємодія з кислотами — розчиняється:
- в хлоридній - розведеній сульфатній кислоті: https://www.youtube.com/watch?v=LD5uopZaRck |
Відео
0,31 сек |
|
2. Реагує з концентрованими кислотами : https://www.youtube.com/watch?v=DoIdaMmmhlQ
Завдання ( по варіантах)до реакцій на стор 152 : Доберіть коефіцієнти методом електронного балансу
|
Відео (рос.)
стор 152 |
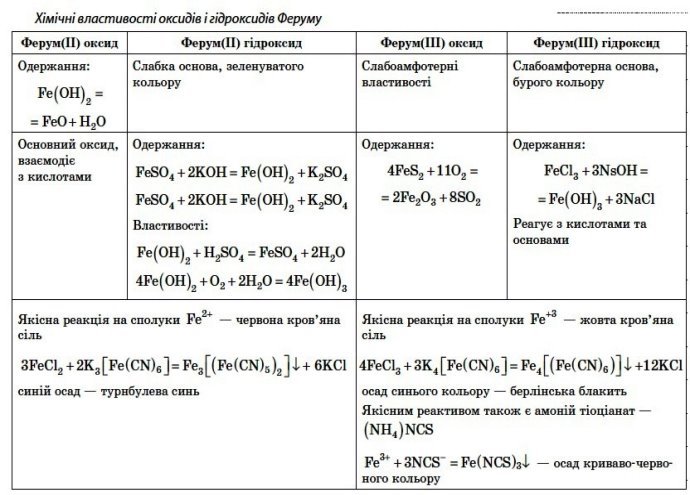
Хімічні властивості сполук Феруму :
( демонстрація таблиці за допомогою проектора з обговоренням)
ІV. Закріплення : ( вправи на вибір , з впровадженням диференційованого підходу у відповідності до рівня навчання учнів в класі ). Одночасна реалізація групової та індивідуальної роботи.
Вправа 195 Допишіть схеми реакцій і складіть хімічні рівняння:
|
б) Fe +AgNO3= Fe(NO3)2+ Ag↓ Fe3O4+ H2= 3FeO + H2O Fe(OH)3+ 3PO4= ePO4+ 3H2O Fe(NO3)3+NaOH = Fe(OH)3↓+NaNO3 |
в) Fe + 2FeCl3= 3FeCl2 Fe2O3+ CaO = Ca(FeO2)2 Fe(OH)2↓= FeO + H2O FeS + 2HBr = FeBr2+ H2S↑ |
Вправа 201 Виведіть формулу оксиду Феруму, в якому масова частка металічного елемента становить 70%.
|
Відомо: w(Fe)=70% Знайти: формулу FexOy-?
|
Розв'язування w(O)=100%-w(Fe)=100%-70%=30% У 100 г такої речовини маса атомів Феруму становить 70 г, атомів Оксигену — 30 г. Розраховуємо співвідношення індексів у формулі вуглеводню (співвідношення кількостей речовини елементів): х : у= n(Fe) m(Fe) m(O) 70 30 n(O) = M(Fe) : M(O) = 56 : 16 = 1,25:1,875 тоді 1,25 = 1, а 1,875/1,25= 1,0:1,5 Для того щоб у співвідношенні були найменші цілі числа, помножимо обидва числа на 2: x : y=(1,0•2):(1,5•2)=2:3, отже, формула оксиду Fe2O3 Відповідь: Fe2O3 |
Вправа 202 Яку масу ферум (ІІІ) нітрату потрібно взяти для добування 8 г ферум (ІІІ) оксиду?
|
Відомо:
m(Fe2O3)=8 г m(Fe(NO3)3)-?
|
Розв'язування Записуємо рівняння реакції: x г 8 г 4Fe(NO3)3=2Fe2O3 + 12NO2 + 3O2↑ 968 г 320 г M (Fe(NO3)3)=242 г/моль, а маса 4 моль тога =968 г M(Fe2O3)=160 г/моль, а маса 2 моль=320 г х=m(Fe(NO3)3)= 8 г • 968 г 320 г = 24,2 г Відповідь: 24,2 г |
Вправа 203 Визначте кількість молекул води у формулі солі FeCl2•nH2O, якщо масова частка води у сполуці становить 36,2%.
|
Відомо: FeCl2•nH2O, w(H2O)=36,2% або 0,362 Знайти: n-?
|
Розв'язування: M(FeCl2)=127 г/моль, M(H2O)=18 г/моль Масова частка води в кристалогідраті обчислюється за формулою w(H2O)= n•M(H2O) (M(FeCl2)+n•M(H2O) Підставимо значення у формулу, отримаємо рівняння, яке розв'язуємо. 0,362=18n : (127+18n), звідси 0,362•(127+18n)=18n 45,974+6,516n=18n 18n-6,516n=45,974 11,484n=45,974 n=4, формула кристалогідрату FeCl2•4H2O Відповідь: n=4 |
Вправа 204 Який об’єм водню виділиться за нормальних умов, якщо до 1,12 г заліза додати 18 г хлоридної кислоти з масовою часткою HCl 10%?
|
Відомо: m(Fe)=1,12 г, m(розчину)=18 г,
w(HCl)=10%, або 0,1
|
Розв'язування 1. m(HCl)=w(HCl)•m(розчину)=0,1•18 г=1,8 г
2. M(HCl)=36,5 г/моль, M(Fe)=56 г/моль n(HCl)=m(HCl):M(HCl)=1,8 г:36,5 г/моль=0,049 моль n(Fe)=m(Fe):M(Fe)=1,12 г:56 г/моль=0,02 моль
3. Запишемо рівняння реакції: Fe + 2HCl = FeCl2 + H2↑ За рівнянням реакції 1 моль 2 моль 0,02 моль 0,04 моль. За умовою кислоти є 0,049 моль= кислоту взято в надлишку, тому розрахунки будемо проводити за даними Fe. За рівнянням реакції n(Fe): n(H2)=1:1, тому n(H2)=n(Fe)=0,02 моль 4. V(H2)=n(H2)•VM = 0,02 моль•22,4 л/моль= 0,448 л Відповідь: 0,448 л |
Вправа 205 У розчин купрум (ІІ) сульфату занурили залізну пластинку масою 28 г. Через деякий час маса пластинки збільшилась до 30 г. Обчисліть масу міді, яка виділилась на пластинці. Зважте на те, що утворюваний метал із пластинки не осипається.
|
Відомо: m1 пластинки(Fe)=28 г, m2 пластинки(Fe,Сu)=30 г Знайти: m(Cu)-?
|
Розв'язування Нехай х г - маса заліза, що утворилося після реакції. Тоді в реакцію вступило залізо масою (28 - х) г, а утворилася мідь масою (30 - х) г, бо залізна пластинка збільшилася за рахунок здатності заліза вступати в реакцію з витісненням міді, що осідає на ній. Запишемо рівняння реакції: (28 - х) г (30 - х) г Fe + CuSO4 = FeSO4 + Cu↓
56 г 64 г M(Cu)=64 г/моль,=64 г (28-х):56=(30-х):64, за властивістю пропорції (28-х)•64=(30-х)•56 1792-64х=1680-56х 64х-56х =1792-1680 8х=112 х=112:8 х=14 г m(Cu)=30 - 14=16 г Відповідь: 16 г міді виділилося на пластинці
|
VІ. Домашнє завдання:
читати параграф №25 ,
вправа письмово №196 або №197 (б) – на вибір


про публікацію авторської розробки
Додати розробку