Урок "Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу."
Лісківський заклад загальної середньої освіти І-ІІІ ступенів
Кілійської міської ради Одеської області
Насичені одноатомні спирти,
їх фізичні та хімічні властивості. Одержання етанолу.![]()
![]()
![]()
План-конспект
уроку хімії
в 10 класі
Підготувала
вчитель хімії
Шульга Ганна Іванівна
Проведено:
13 грудня 2019р.
Ліски - 2020
Формування ключових компетентностей:
- саморозвитку й самоосвіти — створення проблемних ситуацій, уміння знаходити нові рішення;
- інформаційної — розуміння та усвідомлення отриманої інформації, вміння робити висновки та узагальнення, складання опорних схем;
- соціально-трудової — вміння оперувати знаннями, розвивати гнучкість отриманих знань, здійснювати взаємоперевірку;
- комунікативної — вміння працювати в парах.
Формування предметних компетентностей:
- поглибити знання учнів про оксигеновмісні органічні сполуки на прикладі одноатомних насичених спиртів;
- сформувати уміння складати формули спиртів за їхніми назвами;
- поглибити знання учнів про оксигеновмісні органічні сполуки на прикладі одноатомних насичених спиртів;
- розвивати навички і вміння складати структурні формули і назви органічних речовин на прикладі спиртів;
- формувати навички складання назв органічних речовин за структурними формулами та структурних формул – за назвами ;
- ознайомити учнів зі згубним фізіолoгічним впливом спиртів на організм людини .
- розглянути зв’язок між властивостями спиртів і їхнім застосуванням .
- на підставі знань учнів про хімічні властивості спиртів з’ясувати можливість їх застосування в народному господарстві .
Обладнання та реактиви: моделі молекул спиртів, презентація, етанол
Тип уроку: комбінований
Перебіг уроку
І. Організаційний етап (слайд 1)
Привітання. Визначення відсутніх.
Наш урок сьогодні пройде під девізом «Просто знати – це не все. Знання потрібно використовувати» Й. Гете
Роздати листки накопичування балів (додаток)
ІІ. Актуалізація опорних знань. (Виконують на листках)
1. Гра «Встав слово» (завдання на 3,5 балів) (слайд №2)
- Органічні речовини, до складу яких входить одна або кілька гідроксильних груп, називають спиртами.
- Спирти належать до оксигеновмісних органічних сполук.
- Функціональна група спиртів — це гідроксильна група.
- Спирти — це похідні насичених вуглеводнів, у молекулах яких один або кілька атомів заміщені гідроксильними групами.
- До складу насичених одноатомних спиртів входить вуглеводневий радикал і одна гідроксильна група.
- Спирти, в молекулі яких міститься лише одна гідроксильна група називають одноатомними спиртами.
- Назви спиртів походять від відповідних вуглеводнів з додаванням суфікса -ол.
2. «Впізнай мене» (завдання на 1 бал) (слайд 3). З переліку речовин вибрати формули спиртів:
С3Н7Сl, С2Н5OH, СН3СОOH, С2Н6, С2Н4, С3Н5(OH)3, С4Н7Br3, С2Н5OС2Н5.
3. «Моя структурна формула» (завдання на 1,5 балів) (слайд 4).
Зобразити структурні формули молекул спиртів із такими назвами:
а) 2-метилпентан-3-ол; б) 2,3-диметилгексан-2-ол
ІІІ. Мотивація навчальної діяльності (слайд 5).
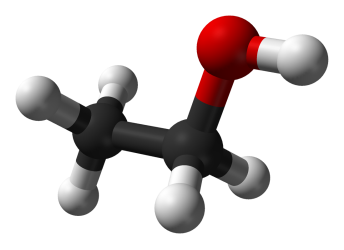
Перед вами модель молекули метанолу. Скільки тут атомів Карбону? (1) Що зображено червоним кольором? (Атом Оксигену) Атоми Карбону можуть утворювати ланцюги. Продовжимо карбоновий ланцюг на один атом, на два… (робота з моделями молекул алканів)
Утворюються нові молекули. Вони всі схожі з метанолом за будовою, а тому й властивостями. А чим вони відмінні?
Сьогодні ми пригадаємо будову молекул однотомних спиртів; поповнимо свої знання про хімічні властивості спиртів; дізнаємося про способи добування спиртів. (Слайд №6) Тема уроку: «Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу.»
ІV. Вивчення нового матеріалу.
- Гомологічний ряд насичених одноатомних спиртів. (слайд №7)
Гомологічний ряд насичених одноатомних спиртів започатковують метанол СН3ОН і етанол С2Н5ОН. Розглянемо таблицю 1.
Діти згадують, як складаються назви алканів, потім по черзі називають спирти.
|
Кількість атомів Карбону |
Корінь назви |
Насичені вуглеводні СnH2n+2 суфікс-ан
|
Насичені одноатомні спирти СnH2n+1ОН суфікс-ол |
|
1 |
мет |
СН4 метан |
СН3ОН метанол |
|
2 |
ет |
С2Н6 етан |
С2Н5 ОН етанол |
|
3 |
проп |
С3Н8 пропан |
С3Н7 ОН пропанол |
|
4 |
бут |
С4Н10 бутан |
С4Н9ОН бутанол |
|
5 |
пент |
С5Н12 пентан |
С5Н11ОН пентанол |
|
6 |
гекс |
С6Н14 гексан |
С6Н13ОН гексанол |
|
7 |
гепт |
С7Н16 гептан |
С7Н15ОН гептанол |
|
8 |
окт |
С8Н18 октан |
С8Н17 ОН октанол |
|
9 |
нон |
С9 Н20 нонан |
С9 Н19ОН нонанол |
|
10 |
дек |
С10Н22 декан |
С10Н21ОН деканол |
- Будова молекул. Робота з підручником (Хімія (рівень стандарту): підруч. для 10 кл. закладів загальної середньої освіти/ П.П.Попель, Л.С. Крикля. – Київ: ВЦ «Академія», 2018.). Опрацювати с.83-84 самостійно.
- Фізичні властивості спиртів. (слайд №8)
На прикладі етанолу охарактеризувати наступні властивості: (з елементами демонстрації – позначено *)
1) агрегатний стан*;
2) колір*;
3) запах*;
4) розчинність у воді*;
5) густина*. (0,7893 г/см3)
Перегляд відео «Фізичні властивості спиртів»
6) розчинник.
7) температура кипіння; (+780 С)
8) температура плавлення; (-114,10 С)
9) теплопровідність;
10) електропровідність;
4. Хімічні властивості спиртів (слайд № 9)
1. Горіння спиртів
При підпалюванні спирт горить світлим полум’ям із виділенням великої кількості теплоти.
Повне згоряння ( достатня кількість кисню ) (демонстрація з етанолом):
С2 Н5 ОН + 3О2 →2СО2 + 3Н2 О
Неповне згоряння з виділенням чадного газу ( недостатність кисню ) :
С4 Н9ОН + 4О2 → 4СО + 5Н2 О
Неповне згоряння з виділенням сажі ( недостатність кисню ) :
С6 Н13 ОН + 3О2 → 6С + 7Н2 О
2. Реакція окиснення(слайд № 10)(Перегляд відео «Якісна реакція на спирти» )
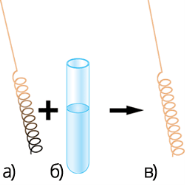 Якщо в спирт занурити розжарену мідну спіраль, покриту чорним нальотом купрум (ΙΙ) оксиду, то спіраль стане блискучою, з’явиться специфічний запах альдегіду. Цю реакцію використовують для якісного визначення спиртів.
Якщо в спирт занурити розжарену мідну спіраль, покриту чорним нальотом купрум (ΙΙ) оксиду, то спіраль стане блискучою, з’явиться специфічний запах альдегіду. Цю реакцію використовують для якісного визначення спиртів.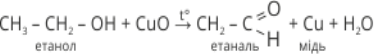
Якісна реакція на спирт.
а) розжарена мідна спіраль; б) спирт; в) відновлена спіраль.
3. Взаємодія спирту з лужними металами (слайд № 11) (Перегляд відео «Взаємодія спиртів з металічним натрієм» )
При дії на спирти лужних металів відбувається заміщення Гідрогену гідроксильної групи на атом металу. При цьому утворюються алкоголяти. Алкоголяти, утворені метиловим спиртом, називають метилатами, етиловим спиртом –етилатами:
2C2H5OH (етанол) + 2Na → 2C2H5ONa (натрій етилат) + H2.
Спирти, подібно до води, бурхливо взаємодіють з металічним натрієм. Наступні спирти (пропіловий, аміловий) реагують слабше, а вищі реагують лише при нагріванні. З лугами спирти за звичайних умов алкоголятів не утворюють.
4. Взаємодія спирту із галогеноводнями (слайд №12)
У присутності водовіднімаючого засобу, такого як концентрована сульфатна кислота, спирти реагують із галогеноводневими кислотами з утворенням галогенопохідних насичених вуглеводнів. На відміну від попередньої реакції, при взаємодії спиртів з галогеноводнями в процесі бере участь ОН–група повністю:
C2H5OH (етанол) + HCl → C2H5Cl (хлоретан) + H2O.
5. Дегідратація спиртів (слайд №12)
У присутності водовіднімаючогозасобу (концентрована сульфатна кислота, цинк хлориду) й підвищеної температури від молекул спиртів відщеплюється вода. Процес дегідратації може відбуватися двома різними шляхами, залежно від умов:
а) Внутрішньомолекулярна дегідратація. Якщо дегідратація відбувається при нагріванні спирту (до 140°С) з достатньою кількістю концентрованої сульфатної кислоти, то відбувається утворення ненасиченого вуглеводню:
C2H5OH (етанол) ![]() CH2 = CH2 (етилен) + H2O;
CH2 = CH2 (етилен) + H2O;
б) Міжмолекулярна дегідратація. Якщо дегідратація відбувається за вищої температури при надлишку спирту, молекула води відщеплюється від двох молекул спирту.
2C2H5OH (етанол) ![]() C2H5 – O – C2H5 (діетиловий етер) + H2O
C2H5 – O – C2H5 (діетиловий етер) + H2O
Загальна формула етерів R-O-R
У промисловості діетиловий етер одержують, пропускаючи пари спирту над алюміній оксидом при 250°С.
Етери – органічні речовини, молекули яких складаються з вуглеводневих радикалів, сполучених через атом Оксигену. Загальна формула етерів R–O–R. Радикали можуть бути однаковими (при взаємодії молекул одного спирту) або різними (при взаємодії молекул різних спиртів):
CH3OH (метанол) +C2H5OH (етанол) ![]()
CH3 – O – C2H5 (метил етиловий етер) + H2O.
6. Взаємодія спиртів з органічними кислотами (слайд №12)
Спирти реагують з органічними кислотами з утворенням естерів:
CH3 – COOH (оцтова кислота) + HO – C2H5 (етиловий спирт) →
CH3 – COO – C2H5 (оцтово–етиловий естер) + H2O.
Загальна формула еcтерів R-COO-R
- Одержання етанолу.Робота з підручником. Опрацювати с.87-88 самостійно.
- Застосування спиртів в народному господарстві (слайд № 13, 14) (випереджальне завдання, додаток 1)
- Дія спиртів на організм людини (слайд №15) (випереджальне завдання, додаток 2), після якого перегляд відео «Тест на алкоголь».
V .Узагальнення й закріплення знань. (Слайд № 16)
Тестування з теми: (Оцінюється в 4 бали)
- Вкажіть характеристичну (функціональну) насичених одноатомних спиртів
а) - ОН; б) - СНО; в) - СООН
- Вкажіть загальну формулу одноатомних спиртів
а) Сn Н2n+2; б) Сn Н2n+1COOH; в) Сn Н2n+1OH
- Вкажіть формулу етилового спирту
а) Сn Н2n+1СНО; б) С2 Н5 ОН; в) С Н3 ОН; г) С3 Н7 ОН
- Вкажіть формулу спирту, який є сильною отрутою
а) С2 Н5 ОН; б) С Н3 ОН; в) С3 Н7 ОН; г) С4 Н9ОН
- Вкажіть назву характеристичної групи в молекулах спиртів
а) карбоксильна; б) карбонільна; в) гідроксильна
- Систематичні назви спиртів утворюють від назв відповідних алканів з додаванням суфікса
а) - аль; б) - ол; в) - овий
- Атоми карбону в молекулі спирту нумерують з тієї сторони, де ближче
а) розгалуження; б) байдуже з якої сторони; в) зліва направо; г) функціональна група
- Мурашиний , або метиловий спирт в невеликій його кількості
а) викликає сліпоту; б) викликає смерть; в) є сильною отрутою
VІ. Підведення підсумків уроку.
Підрахування та виставлення балів
VІІ. Домашнє завдання. (слайд №17)
1). § 14, с. 83-90 читати, завдання №100, 103 на с. 90 – письмово.
2). Готувати навчальні проекти:
11. Екологічна безпечність застосування і одержання фенолу.
12. Виявлення фенолу в екстракті зеленого чаю або гуаші.
Додаток 1
ЗАСТОСУВАННЯ СПИРТІВ У НАРОДНОМУ ГОСПОДАРСТВІ
Серед всіх спиртів найбільше значення мають метанол та етанол
ЕТАНОЛ
Алкогольні напої
Вони містять етиловий спирт. До них відносяться спирт, горілка, лікеро-горілчані вироби, ром, скроні, коньяки, виноградні і плодово-ягідні вина.
Спирт для харчової промисловості
Технологія: 1) одержання солоду; 2) приготовлений і зброджування солодкого затору; 3) перегонка зрілої бражки; 4) ректифікація зрілого спирту.
Харчова промисловість
Розчинник для харчових ароматизаторів. Застосовується як консервант для хлібобулочних виробів, а також у кондитерській промисловості.
Виробництво таких речовин: вибухових речовин; парфумів; нітроцелюлози та напівфабрикатів-спиртованих соків; морсів; настоїв; пектину; оцту спиртового; лікарських засобів; виноградних, плодових та інших виноматеріалов і сусла; синтетичного каучука; барвників; есенцій; фотоплівок; пороху; пластмаси.
Паливо
Для ракетних двигунів, двигунів внутрішнього згоряння в чистому вигляді; застосовується для вироблення високоякісного палива та компоненту бензинів - етил-трет-бутилового ефіру, більш незалежного від викопної органіки.
Хімічна промисловість
Служить сировиною для одержання багатьох хімічних речовин, таких, як ацетальдегід, діетиловий ефір, тетраетилсвинець, оцтова кислота, хлороформ, етилацетат, етилен та ін.; широко застосовується як розчинник; є компонентом антифризу і склоомивачів; у побутовій хімії етанол застосовується в чистячих і миючих засобах; є розчинником для репелентів.
Медицина: як антисептик; як знезаражувач; обробка операційного поля або в деяких методиках обробки рук хірурга; розчинник для лікарських засобів, для приготування настоянок, екстрактів з рослинної сировини та ін.; консервант настоянок і екстрактів; піногасник при подачі кисню, штучної вентиляції легень; в зігріваючому компресі; для фізичного охолодження при лихоманці (для розтирання); антидот при отруєнні етиленгліколем і метиловим спиртом; можливе застосування як компонента парентерального харчування (у вигляді 5% розчину) в ослаблених хворих з урахуванням високої енергетичної цінності речовини; компонент загальної анестезії в ситуації дефіциту медикаментозних засобів
Парфумерія та косметика
Є універсальним розчинником різних речовин і основним компонентом духів, одеколонів, аерозолів і т. п.
МЕТАНОЛ
Органічна хімія
— Як розчинник
Газова промисловість
— для боротьби з утворенням гідратів (з-за низької температури замерзання і хорошою розчинності).
Органічний синтез
— для випуску формальдегіду і формаліну, оцтової кислоти, ряду ефірів, ізопрену та ін..
Найбільша його кількість іде на виробництво формальдегіду, який використовується для виробництва фенолформальдегідних смол.
Лакофарбова промисловість
— Значні кількості CH3OH використовують у лакофарбовій промисловості для виготовлення розчинників при виробництві лаків.
Паливо
— метанол використовується для заправки гончих мотоциклів та автомобілів.
— Метил-трет-бутиловий ефір (C5H12O) застосовується як добавка до моторних палив, що підвищує октанове число бензинів (антідетонатор).
Парфумерія
— в якості денатуруючих добавкок до етанолу при виробництві парфумів
Висновок
— На прикладі етилового та метилового спиртів ми побачили ,що спирти у сучасному світі використовуються дуже широко. Багато предметів побуту виготовлені за добавок спиртів. Тому, щоб знати з чого виготовлені речі, що нас оточують, ми повинні уважно вивчати хімію.
Додаток 2
ЗГУБНИЙ ВПЛИВ МЕТАНОЛУ Й ЕТАНОЛУ НА ОРГАНІЗМ ЛЮДИНИ .
Метанол і етанол – два набільш розповсюджених спирти . Вони практично не відрізняються за запахом , тому досить часто трапляються випадки вживання метанолу . На відміну від етанолу метанол є сильнішою отрутою , і навіть невеликі його кількості призводять до сліпоти ( ушкодження очного нерва ) і смертельних наслідків . Етанол є антидотом ( протиотрутою ) для метанолу . При отруєнні метанолом , крім промивання шлунка , необхідно прийняти етанол .
Непомірне вживання алкогольних напоїв призводить до виникнення алкоголізму – фізичної та психологічної залежності людини від винного спирту ( етанолу ) . За своїм хімічним механізмом алкоголізм являє собою окремий випадок наркотичної залежності , тобто порушення тих чи інших ланок обміну речовин У малих дозах етанол постійно присутній в організмі , але в цьому немає нічого страшного , тому що ферментативні системи підтримують рівновагу між етанолом і продуктом його окиснення – сильною отрутою ацетальдегідом СН3СОН , що знешкоджується печінкою . Уживання великої кількості алкоголю призводить до того що в організмі утворюється надлишок ацетальдегіду . Таке навантаження на печінку дуже часто служить причиною серйозних захворювань .
Додаток 3
Дата _______________
П.І, учня ___________________________
Лист накопичування балів
|
|
|
|
Зобразити структурні формули молекул спиртів із такими назвами: а) 2-метилпентан-3-ол; б) 2,3-диметилгексан-2-ол |
|
1) 5) 2) 6) 3) 7) 4) 8) |
|
|
|
|
Загальний бал |
|
Додаток 4
Листок контролю для вчителя
|
№ |
П.І.Б. |
«Встав слово» |
«Впізнай мене» |
«Моя структурна формула» |
Тестування |
Робота на уроці |
Загальний бал |
|
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
9 |
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
11 |
|
|
|
|
|
|
|
|
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- https://naurok.com.ua/test/oksigenovmisni-organichni-rechovini-26072.html
- https://sites.google.com/view/allhemi/медіатека/відеоексперименти-з-органічної-хімії
- https://www.bestreferat.ru/referat-388159.html
- Хімія (рівень стандарту): підруч. для 10 кл. закладів загальної середньої освіти/ П.П.Попель, Л.С. Крикля. – Київ: ВЦ «Академія», 2018.
1


про публікацію авторської розробки
Додати розробку
