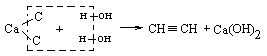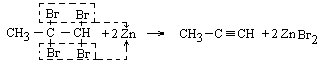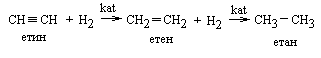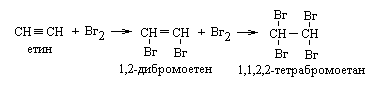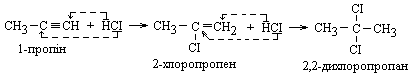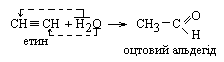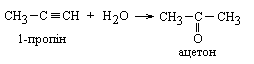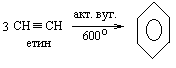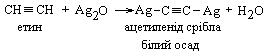Урок "Ненасичені вуглеводні - Алкіни (ацетиленові вуглеводні)"
ознайомитись з ненасиченими вуглеводнями (алкінами), загальною формулою, вивчити гомологічний ряд алкінів, ізомерію, номенклатуру (мінародну та раціональну), будову; вивчити хімічні властивості алкінів, методи їх одержання.
Загальна формула, гомологічний ряд ацетиленових вуглеводнів.
Алкінами, або ацетиленовими вуглеводнями називають сполуки, які містять один або більше потрійних
зв’язків – С С - .
Алкіни з одним потрійним зв’язком утворюють гомологічний ряд загальної формули CnH2n-2, родоначальником якого є етин (ацетилен) СН СН - С2Н2.
Гомологічний ряд алкінів
|
Формула |
Назва |
Загальна формула |
|
С2Н2 - гази С3Н4 С4Н6 С5Н8 - рідини С6Н10 С7Н12 С8Н14 С9Н16 С10Н18 від С17 – тверді речовини |
Етин Пропін Бутин Пентин Гексин Гептин Октин Нонин Децин |
CnH2n-2 |
|
Назва відповідного алкану із зміною закінчення –ан на –ин (- ін ) |
||
Характеристика зв’язків:
- Потрійний зв’язок між 2-ма атомами Карбону, прості зв’язки між іншими атомами Карбону, та прості зв’язки між Карбоном і Гідрогеном.
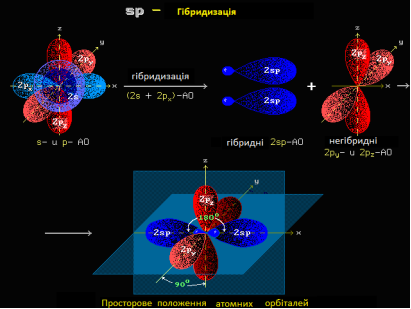
- Тип гібридизації атомних орбіта лей - sp (валентний кут – 180оС).
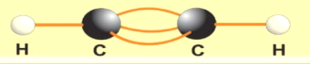
Етин, його склад, електронна, просторова будова. Sp-гібридизація атома Карбону.
Потрійний Карбон-карбоновий зв’язок.
![]() Головним фактором, що характеризує суть алкінів, являється
Головним фактором, що характеризує суть алкінів, являється
потрійний Карбон-Карбоновий зв’язок. В утворенні потрійного
зв’язку приймають участь три пари спільних електронів
(шести електронний зв’язок).
Атоми Карбону, що утворюють потрійний зв’язок, знаходяться в стані sp – гібридизації. У цьому випадку „змішується” одна s – орбіталь та одна р-орбіталь. Утворені 2 гібридні орбіта лі розміщуються під кутом 180оС (тобто лежать на одній прямій), а дві не гібридизовані р-орбіталі розміщуються перпендикулярно до цієї прямої і одна до одної (не гібридизовані р-орбіталі зберігають форму гантелі) утворюючи два - зв’язки. /Чотири р-хмари від двох атомів Карбону дещо перекриваються між собою, утворюючи спільну циліндричну електронну хмару. Такою будовою потрійного зв’язку молекул ацетиленових пояснюється той факт, що вони важче вступають у реакції приєднання, ніж алкени./
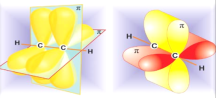
Сполучаючись два атоми Карбону в стані sp – гібридизації утворюють один сігма зв’язок (лінійне перекриття) і
два - зв’язки (бокове перекриття).
![]()
Сучасна та раціональна номенклатура алкінів. Ізомерія
За номенклатурою IUPAC алкіни називають, замінюючи в алканах закінчення –ан на –ин (-ін). Головний карбоновий ланцюг повинен включати потрійний зв’язок, навіть якщо він не найдовший. Нумерацію ланцюга починають з того кінця, ближче до якого знаходиться потрійний С С зв’язок.
Алгоритм:
- Вибирають найдовший карбоновий ланцюг, який містить потрійний зв'язок.
- Нумерацію починають з того кінця, до якого найближче розташований потрійний зв'язок (згідно із
принципом найменших локантів):
а) якщо в молекулі алкіну потрійний зв'язок рівновіддалений від обох кінців карбонового ланцюга, то
нумерацію починають з того кінця, до якого ближче розташований алкільний замісник.
б) якщо в молекулі алкіну подвійний зв'язок рівновіддалений від обох кінців карбонового ланцюга, то при
виборі нумерації користуються алфавітним порядком (етил → метил → пропіл).
- Назву сполуки становлять:
а) замісники, перераховані за абеткою, як і у випадку з алканами;
б) ближчий до початку локант потрійного зв’язку + назва алкіну, яка відповідає головному карбоновому ланцюгу.
Приклад:
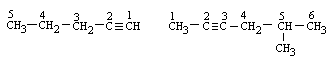
1-пентин 5-метил-2-гексин
Раціональна номенклатура
Алкіни розглядаються як похідні ацетилену, у якому атоми Гідрогену частково або повністю заміщені на алкільні замісники ( R).
АЛГОРИТМ : назва залишків R + ацетилен
Кількість однакових залишків вказують грецькими чисельними. Порядок переліку замісників навколо “ацетиленового” Карбону здійснюється за зростанням їх молекулярної маси, або складності. За ацетилен приймають атоми Карбону між якими міститься потрійний зв`язок.
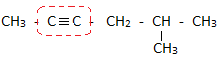
метилізобутилацетилен
Ізомерія алкінів пов’язана з положенням потрійного зв’язку та будовою карбонового ланцюга.
Структурна:
- Ізомерія карбонового ланцюга
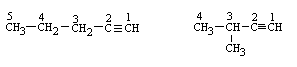
1-пентин 3-метил-1-бутин
- Положення потрійного зв’язку
![]()
1-пентин 2-пентин
Міжкласова:
Приклад:
![]()
1-бутин 1,3-бутадієн
Методи одержання алкінів
|
1 Карбідний метод: Шляхом випалу вапняку та його спікання з вугіллям (коксом) при 20000С, утворюється карбід кальцію СаС2 , який гідролізують до ацетилену:
|
|
2 Піроліз метану Метан піддають дії високої температури за короткий проміжок часу ( ≈1 сек. контакту) і потім швидко охолоджують з метою уникнути подальшого розщеплення ацетилену на вуглець і водень :
|
|
3 Дегалогенування тетрагалогенопохідних алканів
|
|
4 Дегідрогалогенування. При підвищених температурах у присутності спиртових розчинів лугів утворюються алкіни як з віцинальних, так і гемінальних дигалогеналканів : КОН (спиртовий) КОН СН2 – СН – СН3 ————————► СН2 = С – СН3 ———► НС ≡ С – СН3 │ │ -НСІ │ -НСІ СІ СІ СІ Віцинальний КОН (спиртовий) КОН СН3 – СН2 – СНСІ2 ——————► СН3 - СН = СНСІ ———► СН3 - С ≡ СН (по правилу Зайцева) Гемінальний -НСІ -НСІ
|
|
5 Алкілювання . Атоми Гідрогену в алкінах заміщуються атомами металів з утворенням ацетиленідів, які при дії алкілгалогенідів перетворюються у алкіни :
Na-С≡С-Na + 2 Cl-CH3
СН3 – СН2 - С≡С-Na + Cl-CH3
|
Фізичні та хімічні властивості
По фізичним властивостям алкіни нагадують олефіни і парафіни. Нищі алкіни С2-С4 являють собою гази, С5-С16 – рідини, вищі – тверді речовини. Температури кипіння і густини алкінів дещо вищі, чим у відповідних алкенів. Розчинність нищих алкінів у воді дещо вище, чим алкенів і алканів, однак вона все ж таки дуже мала.
Хімічні властивості ацетиленових вуглеводнів обумовлені природою потрійного зв’язку, особливостями карбонових атомів в стані sp – гібридизації. Типовими реакціями для алкінів являються реакції приєднання.
|
1 Гідрування Приєднання водню до СС – зв’язку проходить у присутності каталізаторів.
|
|
2 Галогенування Приєднання хлору, брому до алкінів відбувається, як правило, з меншою швидкістю порівняно з алкенами, у дві стадії, які відрізняються між собою швидкістю. Хлорування частіше проводять у розчинниках з метою уникнути вибуху, оскільки ацетилен згоряє, тобто окислюється, в атмосфері хлору.
|
|
3 Гідрогалогенування Приєднання галогеноводнів, як і галогенів, проходить у дві стадії. Так, взаємодія хлороводню з несиметричними алкінами здійснюється за правилом Марковникова значно повільніше, ніж з алкенами.
|
|
4 Гідратація – реакція Кучерова Ацетилен при гідратації утворює оцтовий альдегід, решта алкінів – кетони. Реакцію проводять у присутності 10-%-розчину H2SO4 і 5-%-го сульфату меркурію (ІІ).
|
|
5 Полімеризація Циклічна тримеризація ацетилену з утворенням бензину вперше здійснена Бертло при довготривалому нагріванні (500оС) ацетилену у фарфоровій посудині. Пізніше Зелінський вдосконалив даний метод: Реакція Зелінського:
|
|
6 Лінійна димеризація:
2СН ≡ СН
|
|
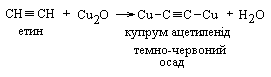
7 Реакції заміщення. Якісною реакцією на атом Гідрогену при потрійному зв’язку являється утворення ацетилен іду срібла, а також ацетилен іду одновалентної міді. При пропусканні етину а також вуглеводнів типу R – С СН через аміачні розчини нітрату срібла чи хлориду міді (І) утворюються характерні осади.
Це якісні реакції на потрійний зв’язок
|
|
8 Полімеризація. Реакція полімеризації ацетилену відбувається в присутності металоорганічних каталізаторів :
n НС≡СН полієн
|
|
9 Ізомеризація алкінів. У присутності лужних металів потрійний зв`язок в алкінах переміщується на кінець молекули. І навпаки, при дії спиртових розчинів лугу відбувається переміщення потрійного зв`язку до середини молекули :
СН3–С≡С–СН3 2-бутин 1-бутин
СН3–СН2-С≡СН 1-бутин 2-бутин
|
Фізичні властивості та застосування алкенів та алкінів
Олефіни (алкени) по фізичним властивостям близькі відповідним алканам. Перші три члени ряду С2-С4 представляють собою гази, від С5 до С17 – рідини, С18 і вище – тверді речовини. Всі алкени мають густину меншу одиниці, володіють характерним запахом, у воді погано розчинні.
У незначній кількості етен (етилен) міститься в багатьох тканинах рослин, але найбільше його в плодах, де він утворюється в результаті ферментативного розпаду деяких карбонових кислот і амінокислот під дією різних ферментів. Етен сприяє дозріванню плодів і викликає обпадання листя. Найбільш активно він виробляється в період дозрівання: так, 1 кг зелених яблук виділяє близько 130 мл цього газу, у той час як 1 кг стиглих плодів – 110 мл, а перестиглих – всього 10 мл. Механізм фізіологічної дії етену ще до кінця не вивчений, але припускається, що він бере участь в активації деяких ферментів рослин.
Якщо ввести в атмосферу овочесховища невелику кількість етену, плоди будуть дозрівати швидше. І навпаки, щоб зберегти стиглі плоди протягом тривалого часу, треба частіше провітрювати овочесховища, видаляючи не тільки тепло, яке виділяють овочі й фрукти при збереженні, але й етен, який утворюється.
З етену доьувають ряд цінних продуктів. Це насамперед поліетилен, який використовується для виробництва пластмаси. З етилену добувають етиловий спирт, що має застосування у виробництві цінних органічних продуктів. Продукт приєднання хлору до етену – 1,2 – дихлоретан є розчинником і засобом знищення шкідників сільськогосподарських культур. А продукт приєднання хлороводню – хлор етан є анестезійною речовиною.
По фізичним властивостям алкіни нагадують олефіни і парафіни. Нищі алкіни С2-С4 являють собою гази, С5-С16 – рідини, вищі – тверді речовини. Температури кипіння і густини алкінів дещо вищі, чим у відповідних алкенів. Розчинність нищих алкінів у воді дещо вище, чим алкенів і алканів, однак вона все ж таки дуже мала.
Завдяки високій теплотворній здатності етин (ацетилен) використовується для газового різання і зварювання металів. Ацетиленово-кисневе полум’я має температуру 2800оС і легко плавить сталь. З етину добувають вихідні речовини для виготовлення пластмас і синтетичних каучуків, він є сировиною для синтезу оцтової кислоти (СН3СООН).


про публікацію авторської розробки
Додати розробку