Урок "Повітря, його склад. Оксиген. Поширеність Оксигену в природі. Кисень, склад його молекули, поширеність у природі. Фізичні властивості кисню."
В данійрозробці подано про склад повітря, уявлення про повітря як суміш газів. Закріпити знання учнів про елементи неметали та прості речовини на прикладі Оксигену й кисню; поняття про Оксиген – хімічний елемент і кисень – проста речовина; ознайомити учнів з поширенням кисню в природі, його фізіологічною дією;
Конспект уроку
Хімія 7 клас
Тема: Повітря, його склад. Оксиген. Поширеність Оксигену в природі. Кисень, склад його молекули, поширеність у природі. Фізичні властивості кисню.
Мета:
навчальна: вивчити склад повітря, сформувати уявлення про повітря як суміш газів, розкрити взаємозв'язок хімії, людини, природи, повторити класифікацію речовин; закріпити знання учнів про елементи метали і неметали та прості речовини на прикладі Оксигену й кисню; дати поняття про Оксиген – хімічний елемент і кисень – просту речовину; ознайомити учнів з поширенням кисню в природі, його фізіологічною дією;
розвивальна: розвивати вміння учнів самостійно здобувати знання , використовувати раніше набуті знання в новій навчальній ситуації;
виховна: виховувати творчу, допитливу особистість, виховувати думку, що знання хімії - основа запоруки їхнього здоров'я, екологічно чистої природи.
Обладнання: Періодична система хімічних елементів Д.І.Менделєєва; роздатковий матеріал.
Тип уроку: вивчення нового матеріалу.
Методи навчання: словесні, наочні, практичні.
Хід уроку
І. Організаційний момент
Привітання вчителя. Емоційне налаштування учнів на урок
ІІ. Актуалізація опорних знань .
Метод «Мікрофон»
1.)Речовини поділяються на … (прості та складні);
2.) Прості речовини -… ( речовини, які складаються з атомів одного хімічного елемента)
3.) Складні речовини - ... (речовини, які складаються з атомів двох і більше хімічних елементів)
4.) З даного переліку речовин назвіть, які речовини є простими, а які складними:
|
О2 |
K3N |
ZnO |
Al |
S8 |
P4 |
FeSO4 |
N2 |
|
SO2 |
Fe |
O3 |
MgCl2 |
CuO |
NH3 |
Cu |
CaCO3 |
ІIІ. Мотивація навчальної діяльності
У попередніх класах ви дізнались про повітря. З деякими його властивостями ознайомилися на уроках природознавства та географії. Тепер ми продовжуємо вивчати повітря у взаємозв’язку відомих вам знань про нього та нового навчального матеріалу, що стосується саме хімії.
Відомий вчений Й. Я. Берцеліус зазначав: «Кисень – це речовина, навколо якої обертається земна хімія». Отже, вперед за новими знаннями.
IV. Вивчення нового матеріалу.
1.ПОВІТРЯ
1.1. ЧИМ Є ПОВІТРЯ З ПОГЛЯДУ ХІМІКА?
Розпочнемо зі складу повітря, щоб одержати відповідь на запитання, чистою речовиною чи сумішшю речовин воно є. Вчені встановили, що близько 4/5 об’ємного складу повітря становить газоподібна речовина азот N2, що не має кольору і запаху. На другому місці перебуває кисень О2 – теж газоподібна речовина без запаху й кольору. Третіми за об’ємним вмістом у складі повітря є інертні гази, серед яких переважає аргон Аr, а на четвертому місці – вуглекислий газ СО2. Тож відповідь однозначна – повітря є природною сумішшю газоподібних речовин. У ньому також міститься водяна пара Н2О та деякі інші речовини, зокрема ті, що утворюють частинки пилу.
Друге запитання хімічного змісту — до простих чи складних речовин належать компоненти повітря? Погляньте на якісний склад наведених у тексті параграфа формул компонентів повітря і ви побачите серед них три формули простих речовин і дві формули складних. Отже, повітря — це природна газоподібна суміш простих і складних речовин.
Повітря — це природна однорідна суміш газоподібних неорганічних речовин азоту, кисню, інертних газів, вуглекислого газу, парів води та в невеликій кількості деяких інших речовин.
1.2. КІЛЬКІСНИЙ СКЛАД ПОВІТРЯ.
З’ясувавши якісний склад повітря, розглянемо кількісний, скориставшись діаграмою.
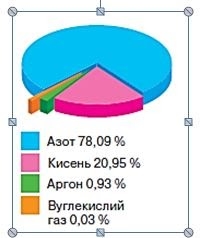
Зверніть увагу, що на два компоненти — азот та кисень — припадає 99 % складу повітря. І наведені дані у тексті параграфа, і діаграма доводять, що основна складова повітря — азот. Його розглядають як важливу для живої природи речовину. Це тому, що всі білкові молекули у своєму складі містять Нітроген. Близько 1/5 складу повітря припадає на кисень. Вуглекислого газу на перший погляд у повітрі дуже мало — менше, ніж неактивних інертних газів. Але, якщо зважати на великий об’єм повітряної оболонки Землі, стає зрозумілим що його цілком достатньо для фотосинтезу.
1.3. ВЛАСТИВОСТІ ПОВІТРЯ.
Розглянемо фізичні властивості повітря. Повітря не має кольору й запаху, тому для нас воно невидиме. Та в існуванні його навколо нас легко переконатися. Візьміть аркуш паперу й зробіть ним кілька помахів на відстані 10–15 см від свого обличчя. Ви одразу ж відчуєте рух спрямованого на нього повітря.
Як і все, що існує на Землі, повітря має певну масу. Пересвідчитись у цьому можна за допомогою такого досліду. На кінцях імпровізованих терезів урівноважено дві пусті повітряні кульки (мал.. а)
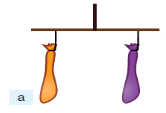
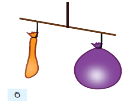
Дослід, який доводить що повітря має масу
Після цього одну з кульок наповнили повітрям, щільно зав’язали ниткою та знову прив’язали до терезів. Рівновага порушилась, шалька з кулькою, наповненою повітрям, опустилася нижче (мал. б). Встановлено, що за нормальних умов (температурі 0 °С і тиску 101,33 кПа, або 1 атм.) маса повітря об’ємом 1 л дорівнює 1,29 г, тоді як маса 1 л води — 1000 г
Відносна молекулярна маса повітря: Мr(повітря)=29.
Для того, щоб перевести газоподібне повітря у рідкий агрегатний стан, необхідна температура –192,0 °С. Як і всі гази та рідини, воно не має власної форми, а тому повністю заповнює простір, який йому доступний. Тобто повітря — всюдисуща суміш газів. Ми говоримо «пуста чашка», «пуста ваза», «пуста пляшка», не замислюючись над тим, що насправді вони «повні», а точніше наповнені повітрям. В цьому переконує занурення пустої пляшки у посудину з водою. Набагато важча за повітря вода витісняє його з пляшки й ми бачимо, як бульбашки повітря виходять з неї. За здатністю розчинятися у воді повітря на лежить до погано розчинних сумішей. Так, в 1 л води розчиняється 0,02918 л повітря. Але навіть такої невеликої кількості повітря достатньо для дихання риб, багатьох інших мешканців водойм. З підвищенням температури здатність повітря розчинятись у воді зменшується. Можна спостерігати, як з холодної води у прозорій вазі з квітами за кімнатної температури виділяються дрібні пухирці повітря й осідають на внутрішній поверхні посудини та рослинах.
У повітрі добре поширюється звук. Якби астронавти, що побували на Місяці, спробували звично поговорити між собою, у них би нічого не вийшло. Це тому, що на Місяці звук не поширюється через відсутність у супутника Землі повітряної оболонки.
Проте тепло у повітрі поширюється погано. Ось чому у вікнах вставляють подвійні, а в сучасних — навіть потрійні шибки. Розташоване між ними повітря допомагає зберігати тепло у приміщеннях. Невипадково на зиму у птахів густішає пір’я, а у звірів шерсть. Між їхніми ворсинками теж затримується повітря й зменшує тепловіддачу тіла.
Повітря піддається стисненню, тобто воно пружне. У цьому переконує дослід. Якщо наповнену повітрям кульку стиснути з боків, у місці стиснення з’явиться заглиблення. Як тільки припинити стиснення, кулька завдяки пружності повітря набуде попередньої форми.
2. ОКСИГЕН – ХІМІЧНИЙ ЕЛЕМЕНТ.
2.1. ХАРАКТЕРИСТИКА ХІМІЧНОГО ЕЛЕМЕНТА ОКСИГЕНУ
Давайте охарактеризуйте положення Оксигену в періодичній системі. Визначимо символ елемента, порядковий номер, його відносну атомну масу, валентність, кількість електронів, заряд ядра.
Оксиген – неметалічний елемент 2-го періоду VI групи головної підгрупи:
• символ елемента – О
• порядковий номер елемента – 8
• відносна атомна маса елемента – 16
• Оксиген має постійне значення валентності, яке дорівнює ІІ
• значення порядкового номера елемента вказує на те, що атом Оксигену містить 8 електронів
• заряд атома становить +8.
22. ПОШИРЕНІСТЬ ОКСИГЕНУ В ПРИРОДІ
Елемент Оксиген займає 3-є місце після Гідрогену і Гелію за поширеністю у Всесвіті. Він – найпоширеніший елемент на Землі.За загальними підрахунками оболонки Землі (літосфера, гідросфера, атмосфера) в сумі майже наполовину складаються з Оксигену.
Оксиген — найпоширеніший на Землі елемент: вміст його в земній корі становить 47 % за масою (здебільшого у формі оксидів: найпоширенішими оксидами на Землі є гідроген оксид або вода Н2О, силіцій (ІV) оксид SiO2 (основна складова частина піску та граніту), алюміній оксид Аl2O3 (входить до складу глини), ферум (ІII) оксид Fe2O3, (міститься у залізних рудах) та інші. У повітрі (тропосфері) кисню (O2) — 20,93 % за об'ємом, або 23 % за масою, у гідросфері - 85.7% маси (до складу води входить 88,8 % за масою Оксигену, в морській воді — 85,7 %. за масою).
3. КИСЕНЬ
3.1. ІСТОРІЯ ВІДКРИТТЯ КИСНЮ
Тривалий час у хімії існувала думка про повітря як про елемент.
Важливим компонентом повітря є кисень.
Першим відкрив кисень китайський вчений Мао Хао у VІІІ столітті, який за 1000 років до А. Лавуазьє встановив, що в склад повітря входить газ, підтримуючий горіння і дихання!

Карл Вільгельм Шеєле (1742-1786). Шведський хімік. У 1772 році встановив, що повітря складається з кисню та азоту.

Джозеф Прістлі (1733-1804) – англійський вчений.
У 1774 р. розкладом оксиду ртуті (ІІ) отримав кисень і вивчив його властивості.

Антуан Лавуазьє (1743-1794) – французький хімік. У 1774 р. експериментально довів склад повітря. Дослідив кисень і дав йому назву oxygen. Заперечив теорію флогістона.
Шведський учений Карл Шеєле, учень аптекаря, у вільний від роботи час займався хімічними дослідами з вивчення флогістону – пальної сутності речовини. Він спалював у закритій колбі фосфор, який миттєво згоряв, перетворюючись на «суху фосфорну кислоту» (Р2О5). Потім занурював колбу в посудину з водою, і вона на 1/5 заповнювалася водою. Знову і знову вчений повторював дослід, спалюючи різні речовини, й одержував одне й те саме – зникала 1/5 частина повітря. Шеєле припустив, що повітря в колбі вже інше. Щоб перевірити свою гіпотезу, він досліджував повітря, що залишилося в колбі. Повітря виявилося мертвим: у ньому нічого не хотіло горіти, свічки стухали, немов їх задмухувала «невидимка», розжарене вугілля остигало, палаюча скіпка миттєво гасла. Висновок був тільки один: повітря – неоднорідна речовина, одна частина якого підтримує дихання і горіння.
Після численних дослідів з розкладу селітри (КNO3, NaNО3.) Шеєле одержав «вогненне повітря», в якому скіпка, що ледь жевріла, загорялася яскравим полум'ям.
«Вогненне повітря» було відкрите майже одночасно трьома вченими: К. Шеєле, Дж. Прістлі, А. Лавуазьє.
Англієць Джозеф Прістлі сонячним промінням нагрівав у пробірці меркурій(ІІ) оксид і одержував велику кількість газу, в якому свічка яскраво горіла.
Першість у відкритті кисню належить Дж. Прістлі. Але з усіх трьох тільки Лавуазьє правильно оцінив істинне значення кисню в природі. Він уперше заявив, що ніякого флогістону не існує. Ця заява викликала бурю в ученому світі. Хіміки так звикли бачити всюди незримий флогістон, що ніяк не могли розстатися з ним. Але проти очевидного встояти важко, і наприкінці XVIII століття флогістон було остаточно вигнано з хімічної науки.
3.2. ФІЗИЧНІ ВЛАСТИВОСТІ КИСНЮ
Найважливіша проста речовина Оксигену – кисень. Цей газ необхідний для дихання; він також підтримує горіння.
Формула кисню вам відома – О2. Ця речовина містить молекули, які складаються із двох атомів Окигену.
Фізичні властивості: - Газ без кольору, запаху і смаку.
- Важчий за повітря.
- Малорозчинний у воді.
- Під час охолодження до -183°С перетворюється на блакитну рідину, при температурі -219°С твердне.
У живій природі за участі кисню здійснюється дихання – один з найважливіших життєвих процесів.
V. Узагальнення та систематизація знань.
1) Прийом «Вірю – не вірю»
1. Оксиген - неметалевий елемент (Так).
2. Хімічний елемент Оксиген утворює одне просте речовину (Ні).
3. Хімічний елемент Оксиген утворює три простих речовини (Так).
4. Оксиген найпоширеніший елемент на Землі (Так).
5. Молекула кисня складається з трьох атомів кисню (Ні).
6. Молекула кисня складається з двох атомів Оксигену (Так).
7. Кисень відкрили Д.Прістлі і А.Лавуазьє (Так).
8. У атмосфері Землі кисень був завжди (Ні).
9. Ціанобактерії є головною «фабрикою» по виробництву кисню (Так).
10. Повітря - це природна суміш газів (Так).
2.)Доповніть речення, вставивши слова «Оксиген», «кисень».
1.Найбільший вміст ____________ в гірських породах і мінералах.
2.У воді розчинений __________________.
3.В акваріумі риби дихають _______________, розчиненим у воді.
4.До складу молекули води входить .
Хвилинка – цікавинка:
- Рідкий кисень , як і залізо притягується до магніту.
- Організм дорослого чоловіка щодоби споживає приблизно 900 г кисню, а жінки – 600 г
VІ. Підсумок уроку.
VII. Домашнє завдання.
Опрацювати §19, 20
Підготувати повідомлення:
- «Значення кисню в житті людини».


про публікацію авторської розробки
Додати розробку
