Урок "Сульфатна кислота"
Сульфатна кислота
(сірчана кислота, дигідрогенсульфат, купоросна олія)
«Навряд знайдеться інша,
штучно добута речовина,
яка б так часто застосовувалась у техніці, як сульфатна кислота.
Там, де технічна діяльність розвинена,
там використовується і багато сульфатної кислоти».
Д.І. Менделєєв
Мета: формування загально-учбових умінь і навичок.
Освітні задачі: вивчити будову і властивості сульфатної кислоти;
розвинути уміння по складанню окислювально-відновного балансу рівнянь реакцій, підготувати здобувачів освіти до успішної здачі ЗНО.
Виховні задачі: формування умінь по складанню конспекту.
Пізнавальні задачі: розвивати інтерес до предмета, уміння висловлювати свої думки, логічно міркувати, дотримуватися техніки безпеки при зустрічі з кислотою в побуті.
Хід уроку:
Протягом уроку з’ясуємо причинно-наслідкові зв’язки наступної схеми:
- Склад речовини:
Встановити склад речовини за допомогою наступного завдання:
Завдання 1:
Визначити формулу речовини , якщо до складу входить 2,04% Гідрогену, 32,65% Сульфуру та Оксиген.
- Будова речовини:
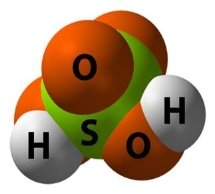
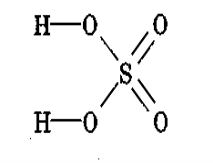
Завдання 2:
У якому рядку записано формули леткої сполуки з Гідрогеном, вищого оксиду і його гідрату, утворених хімічним елементом з протонним числом 16:
- HE, E2O7, HEO4
- HE3, E2O5, H3EO4
- H2E, EO3, H2EO4
- EH4, EO2, H2EO3
Завдання 3:
На зовнішньому енергетичному рівні атома хімічного елемента, що перебуває в основному стані, число неспарених електронів удвічі менше за число спарених. Назва цього елемента –
- Силіцій
- Фосфор
- Сульфур
- Хлор
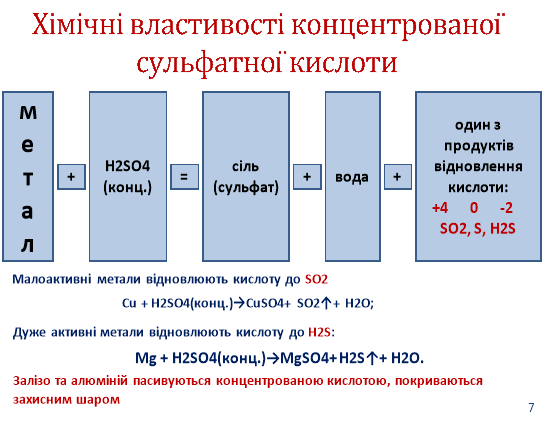
 3. Властивості:
3. Властивості:
Фізичні властивості:
- безбарвна оліїста рідина
- важка, майже удвічі важча за воду
(ρ = 1,83 г/см3)
- змішується з водою у будь-яких співвідношеннях
- при кімнатній температурі вона нелетка й тому не має запаху
- температура плавлення +10,3 °С
- температура кипіння +279,6 °С.
Потрібно знати:
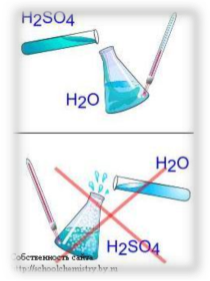
Для того щоб із концентрованої сульфатної кислоти виготовити її розбавлений розчин, кислоту доливають у воду, а не навпаки. Якщо вливати воду в кислоту, то частина води, не встигнувши змішатися з кислотою, одразу нагрівається до кипіння. Це викликає розбризкування кислоти і може спричинити опіки. У разі потрапляння кислоти на шкіру необхідно швидко змити її великою кількістю води, після чого нейтралізувати розчином соди і знову змити водою.
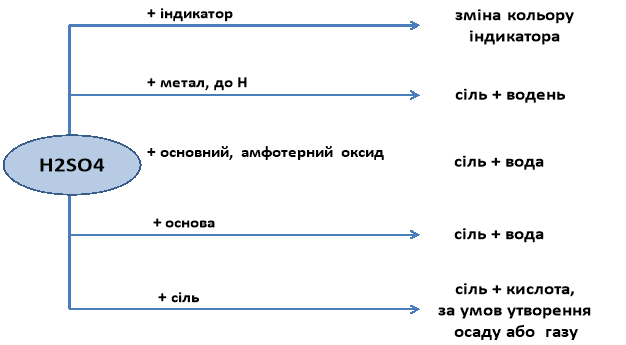 Хімічні властивості розбавленої сульфатної кислоти:
Хімічні властивості розбавленої сульфатної кислоти:
Завдання 4:
Сульфатна кислота реагує з:
- киснем
- цинком
- натрій карбонатом
- карбон (IV) оксидом
Варіанти відповіді:
- 1,3
- 1,4
- 2,3
- 2,4
Завдання 5:
Укажіть формулу речовини, із якою реагує алюміній, якщо внаслідок цього утворюється алюміній сульфат:
- S
- H2SO3
- H2SO4 (розб.)
- H2S
Завдання 6:
Взаємодією яких речовин можна добути магній сульфат?
- MgO i H2SO4
- MgCO3 i H2SO4
- Mg(OH)2 i Na2S
- Mg i Na2SO4
- MgCl2 i SO2
- Mg(OH)2 i H2SO4
|
А |
Б |
В |
Г |
|
3,4,6 |
2,3,5 |
1,4,5 |
1,2,6 |
Завдання 7:
Необоротна реакція відбувається у водному розчині між:
- калій хлоридом і купрум(ІІ) нітратом.
- натрій сульфатом і калій гідроксидом.
- барій хлоридом і сульфатною кислотою.
- натрій нітратом і ферум (ІІІ) хлоридом.
Завдання 8:
Скільки електронів беруть участь в процесі відновлення Cульфуру за схемою SO42- → H2S?
- 2
- 4
- 6
- 8
Завдання 9:
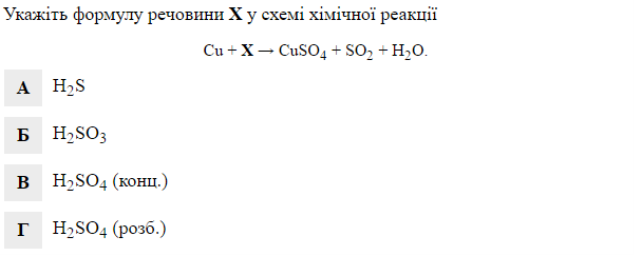
Завдання 10:
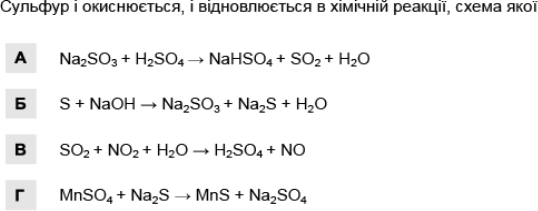
Завдання 11:

- Застосування:
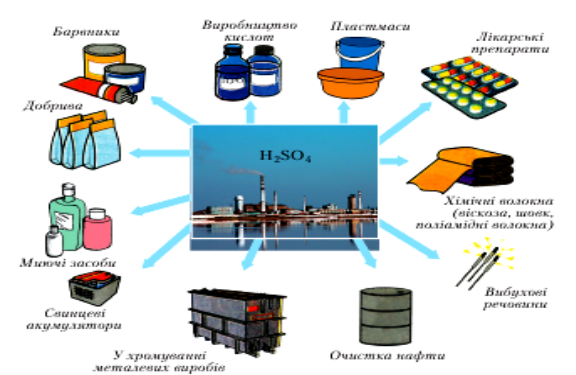
Увага, ЗНО!
- Сірчана кислота H2SO4
- Олеум розчин SO3 в H2SO4
- Гіпс CaSO4*2H2O
- Алебастр CaSO4*1/2H2O
- Сірководень H2S
- Сірчистий газ SO2
- Пірит FeS2
- Мідний купорос CuSO4*5H2O
- Залізний купорос FeSO4*7H2O
 Завдання 12:
Завдання 12:
Завдання 13:
Масова частка в кристалогідраті натрій сульфіту становить 50%. Укажіть число молекул води у формулі цього кристалогідрату.
-
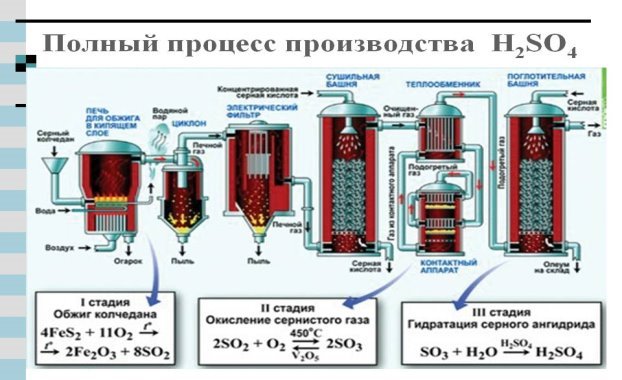
Добування:
Удосконаленням технології виробництва сульфатної кислоти займався український хімік Іван Євграфович Ададуров (1879-1938)
Завдання 14:
Яку масу (г) води необхідно змішати з олеумом масою 400г, масова частка сульфур (VI) оксиду в якому 20%, щоб утворився розчин з масовою часткою сульфатної кислоти 40%?
Завдання 15:
На суміш масою 10г, що складається із заліза та міді, подіяли надлишком розбавленої сульфатної кислоти, унаслідок чого виділився газ об’ємом 2.8л (н.у.). Обчисліть масову частку (%) заліза у суміші.
Домашнє завдання:
Протягом уроку були використані для розв’язування приклади минулорічних тестів ЗНО, домашнім завданням може бути самостійним складанням 10 тестів з різними формами: з вибором однієї правильної відповіді, на встановлення відповідності («логічні пари»), відкритої форми з короткою відповіддю.


про публікацію авторської розробки
Додати розробку
