Урок. Узагальнення знань з теми «Кількість речовини. Розрахунки за хімічними формулами»
Урок
Тема: Узагальнення знань з теми «Кількість речовини. Розрахунки за хімічними формулами»
Мета: узагальнити та систематизувати знання учнів з теми; закріпити вміння розв’язувати задачі за хімічними формулами з використанням понять «кількість речовини», «молярна маса», «молярний об’єм», «відносна густина газу»; розвивати пізнавальний інтерес до предмета через розв’язування задач із нестандартним змістом.
Тип уроку: узагальнення та систематизації знань.
Форма уроку: семінарське заняття.
Основні поняття і терміни: кількість речовини, моль, молярна маса, молярний об’єм, відносна густина газу.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, дидактичний матеріал до уроку.
Хід уроку
І. Організаційний момент
Психологічна настанова («До успіху»)
Усміхніться один одному, подумки побажайте успіхів на цілий день. Для того, щоб впоратися з завданнями на уроці, будьте старанними і уважними. Дороговказом на уроці нехай будуть слова Арістотеля: «Розум полягає не лише у знанні, але й у вмінні використовувати знання на справі».
ІІ. Мотивація навчальної діяльності
Ми закінчуємо вивчати тему «Кількість речовини. Розрахунки за хімічними формулами», отже, сьогодні на році узагальнимо набуті знання, закріпимо вміння розв’язувати задачі за хімічними формулами з використанням понять «кількість речовини», «молярна маса», «молярний об’єм» та «відносна густина газу», вчитимемося працювати в парах, застосовувати засвоєний теоретичний матеріал на практиці. Урок проведемо у формі семінарського заняття.
Учні записують тему уроку в робочі зошити.
ІІІ. Узагальнення і систематизація знань
Структура семінару
1. Коригувальна частина (10 хвилин).
2. Навчальна частина (20 хвилин).
3. Контрольна частина (15 хвилин).
1. Коригувальна частина
1. Інтерактивна вправа «Запитаю в товариша»
Учні ставлять один одному заздалегідь підготовлені запинання з вивченої теми.
2. Виконання тестових завдань
1. Позначте символ кількості речовини:
А n; Б Мr; В ω; Г Аr.
2. Позначте одиницю вимірювання кількості речовини:
А а. о. м.; Б г/моль; В моль; Г л/моль.
3. Позначте назву величини, символ якої відсутній у формулі ![]()
А густина; Б стала Авогадро;
В об’єм; Г маса.
4. Позначте одиницю вимірювання сталої Авогадро:
А моль; Б атоми; В молекули; Г моль–1.
5. Позначте число атомів Гідрогену в молекулі водню кількістю речовини 1 моль:
А 6,02 1023; Б 3,01 1023;
В 12,04 1023 Г 9,03 1023.
6. Позначте одиницю вимірювання молярної маси:
А а.о.м.; Б г/моль; В моль; Г л/моль.
7. Вкажіть молярну масу метану (СН4):
А 32 г/моль; Б 28 г/моль; В 16 г/моль; Г 12 г/моль.
8. Вкажіть пропущену величину: молярний об’єм газу – це об’єм …. будь-якого газу за н. у.
А 12 г; Б 1 кг; В 1 моль; Г 12 моль.
9. Молярний об’єм газу за н. у. дорівнює:
А 22,4 л/моль; Б 22,4 м3/моль;
В 2,24 л/моль; Г 0,224 л/моль.
10. Який об’єм займає за н. у. 3 моль водню:
А 6,72 л; Б 67,2 л; В 7 л; Г 0,7 л?
11. Позначте одиницю вимірювання відносної густини газу:
А л; Б г/л; В безрозмірна величина; Г л/моль.
12. Що означає запис ![]()
А густина водню; Б відносна густина за повітрям;
В молярний об’єм водню; Г відносна густина за воднем?
Учні здійснюють взаємоперевірку тестових завдань.
Відповіді: 1 А, 2 В, 3 Б, 4 Г, 5 В, 6 Г, 7 В, 8 В, 9 А, 10 Б, 11 В, 12 Г.
2. Навчальна частина
Розв’язування задач
Уміння розв’язувати задачі – це мистецтво, що набувається практикою. (Де. Пойа)
1. Заповнити таблицю (усно):
|
В-т |
Формула речовини |
М, г/моль |
n, моль |
N (структ. од.) |
m, г |
V, л |
|
|
|
1 |
CO2 |
|
|
|
4,4 |
|
|
|
|
2 |
H2S |
|
2 |
|
|
|
|
|
|
3 |
N2 |
|
|
6,02 1023 |
|
|
|
|
|
4 |
CH4 |
|
|
|
|
11,2 |
|
|
|
5 |
O2 |
|
3 |
|
|
|
|
|
2. Обчислити величини за поданою схемою (робота в парах):
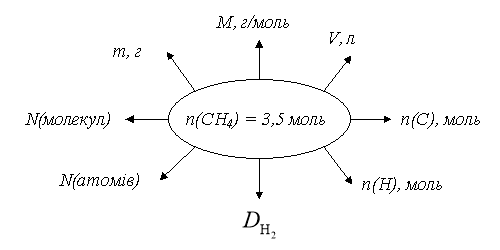
3. (Робота біля дошки) На уроці біології Сашко вивчав будову легень і дихальну систему. У підручнику він прочитав, що доросла людина кожного разу видихає 0,56 л вуглекислого газу. Мишко порахував, що кількість речовини цього газу становить 0,25 моль, а з кожним видихом з наших легень вилітає 1,505 1023 молекул вуглекислого газу. Чи правильні зробив обчислення Мишко?
|
Дано:
V(СО2) = 0,56 л н. у. |
Розв’язання:
N = n NА, N(СО2) = 0,025 6,02 ∙1023 = = 0,1505 ∙1023 = 1,505 ∙1022 молекул. |
|
n(СО2) – ? N(СО2) – ? Vm = 22,4 л/моль NА = 6,02 ∙1023 моль-1 |
4. Відоме прислів’я говорить: «Людину пізнаєш, коли з’їси з нею пуд солі».
Відомо, що добова потреба людини в натрій хлориді складає 0,215 моль. Скільки часу людям потрібно прожити разом, щоб дізнатись один про одного (1 пуд дорівнює 16,38 кг).
|
Дано:
n(NaCl) = 0,215 моль 1 пуд = 16,38 кг = 16380 г |
Розв’язання: m = n M; m(NaCl) = n M = 0,215 58,5 = 12,5775 г; m(NaCl) = 12,5775 2 = 25,155 г (солі для двох); Кількість днів 16380 : 25,155 = 651,163. Людям потрібно прожити разом 651,163 дні. |
|
Скільки часу людям потрібно прожити разом? М(NaCl) = 58,5 г/моль |
Рубрика «Цікаво знати»
Повідомлення учня.
В Італії, в укосі однієї з гір вулканічної місцевості, є печера, яка відома всьому світові під назвою «Собача печера».
Люди відвідують її без будь-якого ризику для свого життя. Собака ж та інші низькорослі тварини в печері не можуть дихати і гинуть, якщо їх не випустити на свіже повітря.
Вулканічний ґрунт місцевості, де знаходиться печера, постійно виділяє вуглекислий газ, який внаслідок своєї ваги збирається внизу печери, утворюючи шар висотою 80-100 см. Отже, людина почуває себе в печері нормально, а собаки гинуть.
Нерідко вуглекислий газ збирається у криницях, тому перш ніж спускатися у неї, треба перевірити, чи можна там дихати людині. Для цього в криницю опускають запалений каганець. Якщо каганець погасне, в криницю спускатися не можна.
Здатність вуглекислого газу скупчуватися внизу посудини добре демонструє ще й такий дослід «Вуглекислий газ «крокує» сходинками».
Демонстрація досліду
Поміщаємо у циліндр (або стакан) маленьку драбинку, зроблену з жерсті або іншого матеріалу. На кожній сходинці драбинки закріплюємо свічку. Запалюємо свічки і заповнюємо посудину вуглекислим газом з апарата Кіппа. Свічки гаснуть одна за одною, починаючи з нижньої.
Давайте дізнаємося, у скільки разів вуглекислий газ важчий за повітря, виконавши завдання.
5. Обчислити відносну густину вуглекислого газу за повітрям.
|
Дано:
СO2
|
Розв’язання:
M(СO2) = 44 г/моль;
|
|
|
Контрольна частина семінару
Індивідуальна робота
Учні отримують картки з різнорівневими завданнями. За виконання завдань І рівня складності учень може отримати 6 балів, ІІ рівня – 9 балів, ІІІ рівня – 12 балів.
І рівень (на 6 балів)
1. Обчисліть число молекул азоту кількістю речовини 1,5 моль:
А 3,01 1023; Б 9,03 1023;
В 12,04 1023 Г 6,02 1023.
2. Знайти масу 0,1 моль метану (СН4):
А 16 г; Б 160 г; В 32 г; Г 1,6 г.
3. Вкажіть формулу газу, важчого за кисень:
А СН4; Б СО2; В Не; Г N2.
ІІ рівень (на 9 балів)
1. Молочна кислота С3Н5О3 утворюється під час скисання молока, квашенні капусти. Визначте, якій кількості речовини відповідає 9 г цієї кислоти.
2. Яку масу хлоридної кислоти потрібно взяти, щоб у ній було стільки ж молекул, скільки їх міститься в ортофосфатній кислоті (Н3РО4) кількістю речовини 0,2 моль?
3. У якого з газів: вуглекислого (СО2) чи чадного (СО) – відносна густина за повітрям більша?
ІІІ рівень (на 12 балів)
1. Тополя за літо поглинає 44 кг вуглекислого газу СО2, липа – 16 кг СО2. Обчисліть, скільки молекул СО2 поглинають тополя і липа.
2. Чи можна стверджувати, що число атомів Оксигену у карбонатній кислоті Н2СO3 масою 4,3 г таке саме, як у воді масою 5 г? Чому?
3. Деякий газ А легший за повітря в 1,7 рази. Важчий чи легший він за метан?
ІV. Підбиття підсумків уроку
Рефлексія
Чи досягли ми поставленої мети на початку уроку?
Які труднощі виникали у вас під час уроку?
Що найбільше сподобалося?
V. Домашнє завдання
Навчання – це робота, що починається у школі, а закінчується вдома.
Повторити §19-22, виконати завдання 168, с. 120.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
1. Попель П. П. Хімія: Підручник для 8 класу загальноосвітних навчальних заклдів / П. П. Попель, Л. С. Крикля. – К.: ВЦ «Академія», 2016. – 240 с.
2. Буринська Н. М. Викладання хімії у 8-9 класах загальноосвітних навчальних закладів: Методичний посібник для вчителів / Н. М. Буринська, Л. П. Величко. – К.: Ірпінь: Перун, 2002. – 240 с.
3. Буйдіна О.О. Хімія 8 клас: Навчальний посібник / О. О. Буйдіна, Л. О. Севастьян, Н. В. Тупиця, О. О. Комашко. – Полтава: – ПОІППО, 2008. – 120 с.
4. Миронюк О. М. Кількість речовини. Розрахунки за хімічними формулами. 8 клас / О. М. Миронюк // Хімія. – 2011. – №11-12. – С. 31-37.
5. Шиян Н. І. Олімпіадні задачі з хімії: Навчально-методичний посібник / Н. І. Шиян, О. О. Буйдіна, Т. О. Кравченко. – Полтава: – ПОІППО, 2007. – 68 с.
Інтернет-ресурси
https://www.loquis.com/en/loquis


про публікацію авторської розробки
Додати розробку

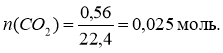
-

Тимчишин Іванна
14.02.2023 в 16:11
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Тірновська Оксана
08.02.2023 в 21:23
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Корнієнко Ліана Олександрівна
18.01.2023 в 23:02
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Kiriyenko Olena
21.01.2022 в 19:50
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 1 відгук