Урок з хімії на тему"Ізотопи.Нуклід"
:сформувати поняття про ізотопи та нукліди;ознайомити учнів з природою радіоактивного випромінювання,його шкідливим впливом на здоров'я людини;виховувати культуру наукового мовлення
Тип уроку:комбінований
Хід уроку
1.Організаційний момент
2.Перевірка д.з
3.Актуалізація опрних знань учнів
4.Вивчення нового матеріалу
Якщо нукліди належать одному й тому самомухімічному елементу і мають однакову кількість протонів, але різняться за кількістю нейтронів, то вони називаються ізотопними нуклідами, або просто ізотопами (від гр. ізос — однаковий і топос — місце).
Ізотопи— це нукліди одного хімічного елемента, які мають однакове протонне число (заряд ядра).
Позначення нуклідів Оксигену:
Оксиген-16, Оксиген-17, Оксиген-18 або 16О, 17О,18О
Назви і символи ізотопів збігаються з назвами і символами відповідного хімічного елемента. Виняток становлять лише ізотопи найлегшого з елементів — Гідрогену. Вони мають нуклонні числа 1, 2, 3 і власні назви та символи (табл. 13).
Тема уроку:Ізотопи.Нуклід
Мета уроку:сформувати поняття про ізотопи та нукліди;ознайомити учнів з природою радіоактивного випромінювання,його шкідливим впливом на здоров’я людини;виховувати культуру наукового мовлення
Тип уроку:комбінований
Хід уроку
1.Організаційний момент
2.Перевірка д.з
3.Актуалізація опрних знань учнів
4.Вивчення нового матеріалу
Якщо нукліди належать одному й тому самому хімічному елементу і мають однакову кількість протонів, але різняться за кількістю нейтронів, то вони називаються ізотопними нуклідами, або просто ізотопами (від гр. ізос — однаковий і топос — місце).
Ізотопи — це нукліди одного хімічного елемента, які мають однакове протонне число (заряд ядра).
Позначення нуклідів Оксигену:
Оксиген-16, Оксиген-17, Оксиген-18 або 16О, 17О,18О
Зверни увагу, термін «ізотопи» вживається лише у множині (застаріле «ізотоп» і є нуклід). Наприклад, природний Оксиген, крім нуклідів 16О, містить ще атоми з нуклонними числами 17 і 18. Це означає, що в природному Оксигені є різні види атомів, які в ядрі містять однакову кількість протонів (по 8), але різну кількість нейтронів (відповідно 8, 9, 10). Саме тому вони й різняться між собою атомною масою. Зазначені нукліди 16О, 17О,18О і є ізотопами Оксигену.
Назви і символи ізотопів збігаються з назвами і символами відповідного хімічного елемента. Виняток становлять лише ізотопи найлегшого з елементів — Гідрогену. Вони мають нуклонні числа 1, 2, 3 і власні назви та символи (табл. 13).
Таблиця 13. Ізотопи Гідрогену й Карбону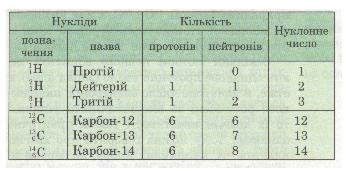
Відкриття ізотопів дало змогу поглибити знання про хімічний елемент як вид атомів, що характеризується однаковим протонним числом (зарядом ядра).
Звичайно в природі більшість хімічних елементів існує у вигляді ізотопів. Тому відносна атомна маса таких елементів визначається величинами відносних атомних мас кожного з нуклідів з урахуванням їх масової частки в природі. Наприклад, елемент Оксиген являє собою суміш ізотопів — нуклідів 16О 99,757 %, 17О 0,039 % і 18О 0,204 %. Аби знайти відносну атомну масу Оксигену, треба:
![]()
Заокруглюємо знайдене середнє значення, виходить Аr(0) = 16.
Відносна атомна маса елемента в періодичній системі — це середнє значення атомних мас його ізотопів з урахуванням їх масових часток у природному елементі
Саме тому, що майже всі елементи — це суміші нуклідів, їх відносні атомні маси не цілочислові, а дробові.
Але ти можеш заперечити, чому ж тоді відносна атомна маса таких елементів як Натрій, Алюміній, Фосфор, Флуор, які не мають ізотопів, не є цілочисловою, а лише наближається до неї? Це пояснюється тим, що Карбон, який береться за точку відліку атомних мас інших елементів, сам складається з двох природних ізотопів 12С і 13С, а для визначення відносної атомної маси береться один із природних ізотопів, саме 12С, або Карбон-12.
Оскільки ізотопи певного елемента мають однакове протонне число (заряд ядра), а отже, й однакове число електронів, які однаково розміщені за енергетичними рівнями, то їх хімічні властивості також практично однакові. Тому можна говорити про хімічні властивості, наприклад Хлору, не беручи до уваги його ізотопний склад.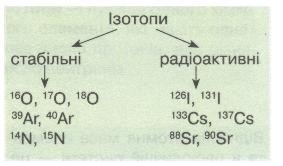
Ізотопи (окремі нукліди) поділяють на стабільні і радіоактивні (радіонукліди). Стабільні нукліди мають усі «парні» елементи і більшість «непарних» з протонним числом (зарядом ядра) < 83. Нукліди всіх елементів, розміщених у періодичній системі після Вісмуту, радіоактивні.
5.Узагальнення вивченого матеріалу
6.Підбиття підсумків уроку
7.Домашнє завдання


про публікацію авторської розробки
Додати розробку
