Урок з хімії у 7 класі на тему: «Оксиди. Окиснення. Горіння. Умови виникнення й припинення горіння»
Розробка уроку з хімії у 7 класі на тему: «Оксиди.
Окиснення. Горіння. Умови виникнення й припинення горіння»
ПЛАН
Конспект уроку на тему: «Оксиди. Окиснення. Горіння. Умови виникнення й припинення горіння»
Мета: розширити уявлення про оксиди як продукти горіння, процес горіння, мимовільне окиснення;
пояснити умови виникнення та припинення горіння, механізм дії засобів пожежогасіння, заходи протипожежної безпеки в побуті й на виробництві; розвивати вміння складати рівняння хімічних реакцій взаємодії кисню з простими речовинами;
поглибити знання про склад складних речовин на прикладі оксидів; удосконалювати навички складання бінарних сполук, розвивати і прищеплювати пізнавальний інтерес;
виховувати любов до природи; формувати екологічну свідомість, мислення.
Тип уроку: поглиблення і засвоєння знань.
Форми роботи: групова та індивідуальна форми роботи, бесіда.
Обладнання: періодична система хімічних елементів, опорна схема «Кисень», презентація учнів, вогнегасник.
Девіз: просто знати – це не все.
Знання потрібно використовувати.
Й.Гете
ХІД УРОКУ
- Організаційний момент.
Учитель. Добрий день! Я вітаю вас ще з одним чудовим днем. Ви, звичайно, можете заперечити, тому поясню: я хочу щоб цей день став чудовим завдяки нашій спільній продуктивній роботі, нашій співпраці.
- Актуалізація опорних знань.
Клас поділяється на групи, кожна група одержує завдання за вивченим матеріалом.
Група 1
- Розкажіть про поширення Оксигену в природі.
-
Допишіть рівняння реакцій і розставте коефіцієнти: а)
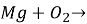
б) ![]()
Група 2
- Розкажіть про будову молекули кисню, його фізичні властивості.
-
Допишіть рівняння реакцій і розставте коефіцієнти: а)
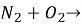
б) ![]()
Група 3
- Розкажіть про хімічні властивості кисню.
-
Допишіть рівняння реакцій і розставте коефіцієнти: а)
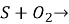
б) ![]()
Група 4
- Розкажіть про лабораторні способи одержання кисню.
-
Допишіть рівняння реакцій і розставте коефіцієнти: а)
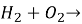
б) ![]()
Група 5
- Розкажіть про застосування кисню.
-
Допишіть рівняння реакцій і розставте коефіцієнти: а)
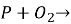
б) ![]()
Один представник кожної групи усно відповідає на теоретичне запитання, другий записує рівняння реакції у вигляді стовпчика: реакції сполучення, реакції розкладу.
- Підбиття підсумків роботи група, оцінювання.
- Мотивація навчальної діяльності.
Учитель. Ми з'ясували позитивне і негативне значення для природи кисню як простої речовини. Однією з важливих властивостей кисню є його реакція окиснення речовин. Сьогодні ми розглянемо горіння і повільне окиснення речовин, умови виникнення і припинення горіння. Повторимо та дізнаємось, від чого може виникнути пожежа і як її уникнути.
- Оголошення теми та мети уроку.
- Вивчення нового матеріалу.
- Горіння
Як називаються речовини, що утворюються під час окиснення речовин?
Для того щоб відповісти на це питання, давайте заслухає повідомлення учнів.
Повідомлення 1
Горіння - це процес приєднання кисню з виділенням тепла і світла. Під час горіння речовин утворюється складні речовини – оксиди. Ще в сиву давнину стародавні люди навчалися добувати вогонь і користуватися ним. Його можна вважати другом людини, тому що він нас і зігріває, і годує. Але з вогнем треба поводитися обережно, щоб якусь необачно мить він не перетворився на ворога.
Повідомлення 2
Повільне окиснення - це процес приєднання кисню лише з виділенням тепла, який може тривати досить довго; внаслідок окиснення утворюється оксиди. Цей процес може перейти в горіння.
Повільно окиснюватися може сіно або зерно, яке не досить добре висушене і складений у скирти або зерно зсипане у великі купи. Якщо просунути всередину руку то відчуваємо тепло. Таке сіно або зерно з часом стає прілим і непридатне для використання.
Заповнення таблиці учнями
|
Окиснення |
|
|
швидке |
повільне |
|
горіння |
повільне окиснення |
|
полум’я |
|
|
теплота |
теплота |
|
світло |
|
|
Наприклад |
|
|
горіння багаття |
повільне окиснення гною |
|
горіння палива |
повільне окиснення їжі |
Тління
Багаття може не затухати одразу, а поступово тліти.
Самозаймання
На заводах, автобазах забороняється збирати докупи промаслене ганчір'я, щоб не виникла пожежа.
-
А чи можуть горіти складні речовини? Так, наприклад, папір, тканина, бензин, природний газ. Природний газ містить складну речовину метан
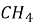 . Під час горіння утворюються два оксиди:
. Під час горіння утворюються два оксиди:
![]()
Висновок. Кожен елемент. що виходить до складу складної речовини, утворює оксид.
- В якому випадку горіння відбувається швидше: у чистому кисні чи на повітрі? (У чистому кисні)
- А без доступу повітря горіння неможливе взагалі.
- Папір добре горить. А чому наші зошити не загораються зараз?
(Для кожної речовини існує температура, за якої вона загоряється, наприклад, для дерева ця температура становить близько 270 °С, для вуглецю - 350 °С, для білого фосфору - близько 40 °С, для азоту - близько 2500 °С). Така температура називається температурою загоряння.
Використання реакції горіння




Яскраве полум’я Як рушійна сила Для різання і зварювання Під час випавлення сталі
у феєрверках і салютах космічної і військової техніки метаів
Умови виникнення і припинення горіння (презентація учня)
Висновок. Горіння можливий тільки за наявності трьох факторів:
а) є горюча речовина;
 б) до неї є вільний доступ кисню;
б) до неї є вільний доступ кисню;
в) досягнута температура займання.
Як зупинити процес горіння? (Перекрити доступ кисню. Остудити речовину до температури, нижчої за температуру згоряння)
Які засоби гасіння пожеж ви знаєте? (Вогнегасник, пісок, вода та ін.)
Для гасіння пожежі використовують вогнегасники. Під час їх роботи виділяється карбон (IV) оксид (![]() ), який змішується із спеціальною рідиною, утворюючи піну. Піна перешкоджає доступу кисню, повітря і горіння припиняється.
), який змішується із спеціальною рідиною, утворюючи піну. Піна перешкоджає доступу кисню, повітря і горіння припиняється.
На існування трьох факторів горіння засновані методи пожежогасіння: у разі усунення одного з факторів горіння стає неможливим, і пожежа загасає.
Повідомлення 4
Деякі речовини можуть повільно окиснюються під впливом температури повітря нижче за температуру самозаймання. Наприклад, залізо ржавіє, срібло вкривається срібним нальотом, мідь нальотом оливкового кольору. Такий процес називається мимовільним окисненням. Щоб позбутися цього небажаного явища треба використовувати інгібітори – уповільнювачі хімічних процесів, або вкривати поверхню метану захисним шаром якоїсь речовини (лаки, фарби, емаль або менш активним металом (![]() ). Наприклад, залізні ворота фарбують золотом, нікелем, хромом, цинком (про них кажуть «позолочені», «нікельовані», «оцинковані», «хромовані»).
). Наприклад, залізні ворота фарбують золотом, нікелем, хромом, цинком (про них кажуть «позолочені», «нікельовані», «оцинковані», «хромовані»).
- Закріплення вивченого матеріалу
Завдання 1. Складіть рівняння горіння запропонованих нижче речовин і розставте коефіцієнти:
![]()
![]()
Завдання 2. Об'єднайте наведені нижче процеси за характером їх окиснення і вкажіть, які характерні ознаки покладено в основу класифікації цих процесів: а) окиснення сірки; б) окиснення фосфору; в) іржавіння заліза; г) утворення залізної окалини; д) окислення під час дихання; е) окислення гною.
Завдання 3. Які висновки можна зробити на основі таких дослідів: а) холодний гас, налитий у залізний тигель не загоряється від запаленої скіпки; б) попередньо нагрітий гас спалахує від запаленої скіпки відразу; в) гас. що горів у тиглі після занурення тигля у воду поступово починає гаснути; г) вата, змочена бензином. спалаху від запаленої на відстані скіпки.
Актуальний мікрофон
Учитель 1. Який газ виділяється під час горіння речовин?
- Які наслідки накопичення цього газу в атмосфері?
- Підсумки уроку.
Виставлення оцінок та їх мотивація.
Сьогодні ми дізналися що реакцію горіння можна керувати. У кожної речовини є температура загорання. Наприклад, для бензину, фосфору або Р вона низька, ці речовини називаються легкозаймистими й повинні зберігатися у відповідних умовах відповідно до правил техніки безпеки.
- Домашнє завдання.
Прочитати §19, виконати вправу №9 с.14. Повторити фізичні та хімічні властивості кисню.
Творче завдання. Підготувати повідомлення про кругообіг Оксигену у природі, використання кисню та його біологічну роль.
Література
- Березан О. Збірник задач з хімії. – Тернопіль: підручник і посібник, 2015
- Григорович О.В. Хімія, підручник для 7 класу. – Харків: Ранок, 2015
- Попель П.П., Криклл Л.С. Хімія, підручник для 7 класу – К.; Академія, 2007
![]()
![]()
![]()
![]()
![]()


про публікацію авторської розробки
Додати розробку
