Урок "Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2 і 3 періодів"
УРОК 2
План – конспект уроку хімії 11 клас
ТЕМА УРОКУ: Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2 і 3 періодів.
МЕТА УРОКУ: повторити поняття валентність та ступінь окиснення; розглянути збуджені стани атомів Сульфуру, Фосфору та ін., принцип збудження атомів, валентні стани елементів; визначити можливі ступені окиснення неметалічних елементів 2 і 3 періодів; вчитися визначати ступені окиснення бінарних сполук і сполук з більшою кількістю хімічних елементів; розвивати хімічну мову, пам'ять, увагу, логічне та аналітичне мислення; виховувати культуру поведінки, культуру мовлення, охайність.
ТИП УРОКУ: засвоєння знань, умінь і навичок.
МЕТОДИ: розповідь, бесіда, «Асоціативний кущ», практичні, «Знайди помилку».
ХІД УРОКУ
І. Організаційний етап
ІІ. Актуалізація опорних знань
- Яка структура періодичної системи?
- Яку інформацію ми можемо отримати про хімічний елемент з періодичної системи?
- Сформулюйте принцип «мінімальної енергії».
III. Перевірка домашнього завдання
Завдання №1 с. 12: Складіть електронну й графічну електронну формули атомів хімічних елементів з порядковими номерами 4 і 13. У якого з атомів усі електрони спарені?
Завдання №2 с.12: Установіть відповідність між електронною будовою зовнішнього енергетичного рівня атома й хімічним елементом.
|
Частина електронної формули |
Хімічний елемент |
|
1 …3s23р5 Хлор |
А Оксиген |
|
2 …2s22р4 Оксиген |
Б Неон |
|
3 …3s2 Магній |
В Хлор |
|
4 …3s23р6 Аргон |
Г Магній |
|
|
Д Аргон |
Завдання №5 с. 12: Укажіть електронну формулу атома елемента II групи 3-го періоду.
А 1s22s2 В 1s22s22p63s2
Б 1s22s22p1 Г 1s22s22p63s23p3
ІV. Вивчення нового матеріалу
Збуджений стан атома
При збудженні атомів електрони набувають більшої енергії, відбувається перехід електронів з нижчих енергетичних підрівнів на вищі. Так, в атома Сульфуру є вільні d-орбіталі, тому можливий перехід одного зі спарених електронів з 3p-орбіталі (рх) на вакантну 3d-орбіталь (перший збуджений стан – S*):
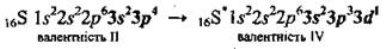
А при подальшому збудженні — перехід одного з 3s-електронів на іншу вакантну d-орбіталь (другий збуджений стан – S**):
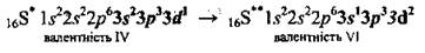
Електронна будова деяких атомів великих періодів має певні особливості. Так, у Калію 19-й електрон розміщується не на 3d-підрівні, а на 4s-підрівні, що виявляється енергетично більш вигідним: 19К...3s23p63d04s1. В атома Кальцію 4s-підрівень завершується: 4s2. Оскільки енергія 3d-електронів нижча за енергію 4р-елекгронів, заповнення 3d-підрівня починається тільки зі Скандію: 21Sс...3s23p63d14s2. У наступних за Скандієм елементів — Титану (Ті), Ванадію (V), Хрому (Сr), Мангану (Мn), Феруму (Fe), Кобальту (Co), Ніколу (Nі), Купруму (Cu), Цинку (Zn) – відбувається заповнення лише 3d-орбіталей.
Елементи з порядковими номерами від 21 до 36 називають перехідними. До них також належать інші елементи (відповідних груп) 5, 6 і 7-го періодів, у яких відбувається заповнення d-або f-орбіталей другого або третього зовні електронного шару.
Як тільки 3d-підрівень завершується і на третьому енергетичному рівні розмістяться 18 електронів (на трьох підрівнях: s, p та d)1, починає формуватися 4р-орбіталь до завершення четвертого періоду Криптоном Кr. Аналогічно відбувається заповнення підрівнів електронами в атомах інших великих періодів.
Зауважимо, що атоми Купруму [Ar]3d104s1, Аргентуму [Kr]4d105s1, Ауруму [Xe]4f145d106s1, а також Хрому [Ar]3d54s1 і Молібдену [Kr]4d65s1 мають у зовнішньому енергетичному рівні по одному s-електрону. Це пояснюється особливою стійкістю електронних структур, у яких на d-орбіталях розміщується 5 або 10 електронів (d5 і d10). Унаслідок цього один з двох спарених електроні», зовнішнього s-шару «провалюється» на d-підрівень попереднього енергетичного рівня. Таке явище називають провалом електрона.
Валентні можливості атомів хімічних елементів
Будова зовнішніх енергетичних рівнів атомів хімічних елементів і визначає в основному властивості їх атомів. Тому ці рівні називають валентними. Електрони цих рівнів, а іноді і предзовнішнього рівнів можуть брати участь в утворенні хімічних зв’язків. Такі електрони також називають валентними.
Валентність атома хімічного елемента визначається в першу чергу числом неспарених електронів, які беруть участь в утворенні хімічного зв’язку.
Валентні електрони атомів елементів головних підгруп розташовані на s- і р-орбіталях зовнішнього електронного шару. У елементів побічних підгруп, крім лантаноїдів і актиноїдів, валентні електрони розташовані на s-орбіталі зовнішнього і d-орбіталях предзовнішнього шарів.
Для того щоб правильно оцінити валентні можливості атомів хімічних елементів, потрібно розглянути розподіл електронів в них на енергетичних рівнях і підрівнях і визначити число неспарених електронів відповідно до принципу Паулі і правилом Хунда для збудженому (основного, або стаціонарного) стану атома і для порушеної (то є отримав додаткову енергію, в результаті чого відбувається розпарювання електронів зовнішнього шару і перехід їх на вільні орбіталі). Атом в збудженому стані позначають відповідним символом елемента із зірочкою.
Валентні можливості атомів хімічних елементів
У збудженому стані атом фосфору має по три неспарених електрона на р-підрівні. При переході атома в збуджений стан один з пари електронів d-підрівні може переходити на вільну орбіталь d-підрівні. Валентність фосфору при цьому змінюється з трьох (в основному стані) до п’яти (в збудженому стані).
Роз’єднання спарених електронів вимагає витрат енергії, так як спаровування електронів супроводжується зниженням потенційної енергії атомів. Разом з тим витрата енергії на перехід атома в збуджений стан компенсується енергією, що виділяється при утворенні хімічних зв’язків неспареними електронами.
Так, атом карбону в стаціонарному стані має два неспарених електрона. Отже, з їх участю можуть утворитися дві загальні електронні пари, які утворюють два ковалентні зв’язки. Однак вам добре відомо, що в багатьох неорганічних і у всіх органічних сполуках присутні атоми чотирьохвалентного кабону. Очевидно, що його атоми утворили чотири ковалентні зв’язки в цих з’єднаннях, перебуваючи в збудженому стані.
Валентні можливості атомів хімічних елементів
Витрати енергії на збудження атомів вуглецю з надлишком компенсуються енергією, що виділяється при утворенні двох додаткових ковалентних зв’язків. Так, для переходу атомів вуглецю зі стаціонарного стану 2s22р2 в збуджений – 2s12р3 потрібно затратити близько 400 кДж / моль енергії. Але при утворенні С-Н-зв’язку в граничних вуглеводнях виділяється 360 кДж / моль. Отже, при утворенні двох молей С-Н-зв’язків виділиться 720 кДж, що перевищує енергію переходуу атомів вуглецю в збуджений стан на 320 кДж / моль.
Висновок: Валентні можливості атомів хімічних елементів визначаються: 1) числом неспарених електронів (одноелектронних орбіталей); 2) наявністю вільних орбіталей; 3) наявністю неподілених пар електронів.
Валентні можливості атомів елементів (їхня спроможність утворювати хімічні зв’язки) визначаються передусім числом неспарених електронів. Розглянемо це на прикладі атомів таких елементів, як Бор, Силіцій і Фосфор. Для цього зобразимо схеми зовнішніх електронних структур їхніх атомів:
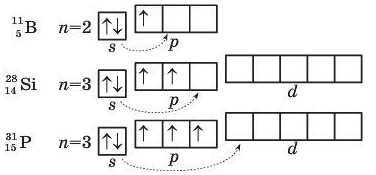
Аналіз цих структур показує, що в атомі Бору на зовнішньому енергетичному рівні є один неспарений р-електрон: він визначає валентність атома Бору, що дорівнює одиниці. Проте стійких сполук цього елемента з валентністю І поки що не одержано. Але за певної затрати енергії ззовні, наприклад у разі нагрівання, спарені електрони 2p-підрівня можуть розпаровуватися. Атом переходить у збуджений стан, у результаті якого всі три електрони зовнішнього рівня стають неспареними. За рахунок трьох неспарених електронів атома Бору в збудженому стані утворюються сполуки B2O3, BCl3 тощо.
У збуджений стан, як видно зі схем, можна перевести й атоми елементів третього періоду (за винятком атомів Натрію та інертного елемента Аргону). І тоді, наприклад, атом Силіцію буде виявляти валентність, яка дорівнює IV, а атом Фосфору — V.
Не всі елементи спроможні підвищувати валентність у вказаний спосіб. Так, наприклад, в атомів Нітрогену, Оксигену й Флуору немає вільних орбіталей, усі їхні 2s- і 2р-орбіталі зайняті електронами, а d-підрівень в атомів другого періоду відсутній.
Визначення можливих ступенів окиснення елементів
Ступінь окиснення — це умовний заряд на атомі в молекулі або кристалі, який би виник на ньому, коли б усі полярні зв’язки, утворені ним, мали іонний характер.
На відміну від валентності, ступінь окиснення може бути позитивним, негативним або дорівнювати нулю.
Ступені окиснення, які елементи можуть проявляти в різних сполуках, у більшості випадків можна визначити за будовою зовнішнього електронного рівня або за місцем елемента в Періодичній системі.
Атоми неметалічних елементів можуть виявляти як позитивні, так і негативні ступені окиснення, залежно від того, з атомом якого елемента вони утворюють зв’язок. Якщо елемент більш електронегативний, то він проявляє негативний ступінь окиснення, а якщо менш електронегативний — позитивний.
Абсолютне значення ступеня окиснення неметалічних елементів можна визначити за будовою зовнішнього електронного шару. Атом здатний прийняти стільки електронів, щоб на його зовнішньому рівні розташувалося вісім електронів: неметалічні елементи VII групи приймають один електрон і виявляють ступінь окиснення -1, VI групи — два електрони й виявляють ступінь окиснення -2 тощо.
Неметалічні елементи здатні віддавати різне число електронів: щонайбільше стільки, скільки розташовано на зовнішньому енергетичному рівні. Інакше кажучи, максимальний ступінь окиснення неметалічних елементів дорівнює номеру групи. Завдяки промотуванню електронів на зовнішньому рівні атомів число неспарених електронів, які атом може віддавати в хімічних реакціях, буває різним, тому неметалічні елементи здатні виявляти різні проміжні значення ступеня окиснення.
Можливі ступені окиснення s- і р-елементів
|
Група ПС |
1 |
II |
III |
IV |
V |
VI |
VII |
|
Вищий ступінь окиснення |
+1 |
+2 |
+3 |
+4 |
+5 |
+6 |
+7 |
|
Проміжний ступінь окиснення |
|
|
|
+2, 0 |
+3, 0 |
+4, +2, 0 |
+5, +3, +1, 0 |
|
Нижчий ступінь окиснення |
0 |
0 |
0 |
-4 |
-3 |
-2 |
-1 |
Визначення ступенів окиснення в сполуках
Будь-яка молекула електронейтральна, тому сума ступенів окиснення атомів усіх елементів повинна дорівнювати нулю. Визначимо ступінь окиснення в сульфур(ІV) оксиді SO2 та у фосфор(V) сульфіді P2S5.
Сульфур(ІV) оксид SO2 утворений атомами двох елементів. З них електронегативність більша в Оксигену, тому атоми Оксигену будуть мати негативний ступінь окиснення. Для Оксигену він дорівнює -2. У цьому разі Сульфур виявляє позитивний ступінь окиснення. У різних сполуках Сульфур може виявляти різні ступені окиснення, тому в цьому разі його необхідно обчислити. У молекулі SO2 два атоми Оксигену зі ступенем окиснення -2, тому спільний заряд атомів Оксигену дорівнює -4. Для того, щоб молекула була електронейтральною, атом Сульфуру має повністю нейтралізувати заряд обох атомів Оксигену, тому ступінь окиснення Сульфуру дорівнює +4.
У молекулі фосфор(V) сульфіду P2S5 більш електронегативним елементом є Сульфур, тобто він виявляє негативний ступінь окиснення, а Фосфор — позитивний. Для Сульфуру негативний ступінь окиснення становить тільки -2. Разом п’ять атомів Сульфуру несуть негативний заряд, що дорівнює -10. Тому два атоми Фосфору мають нейтралізувати цей заряд зі спільним зарядом +10. Оскільки атомів Фосфору в молекулі два, то кожний повинен мати ступінь окиснення +5.
Складніше обчислювати ступінь окиснення не в бінарних сполуках — солях, основах та кислотах. Але для цього також слід скористатися принципом електронейтральності, а ще пам’ятати про те, що в більшості сполук ступінь окиснення Оксигену становить -2, Гідрогену +1.
Розгляньмо це на прикладі калій сульфату K2SO4. Ступінь окиснення Калію в сполуках може бути тільки +1, а Оксигену -2.
Із принципу електронейтральності обчислюємо ступінь окиснення Сульфуру:
2(+1) + 1(х) + 4(-2) = 0, звідки х = +6.
При визначенні ступенів окиснення елементів у сполуках слід дотримуватися таких правил:
1. Ступінь окиснення елемента в простій речовині дорівнює нулю.
2. Флуор – найбільш електронегативний хімічний елемент, тому ступінь окиснення Флуору у всіх сполуках дорівнює -1.
3. Оксиген – найбільш електронегативний елемент після Флуору, тому ступінь окиснення Оксигену у всіх сполуках, окрім фторидів, негативний: у більшості випадків він дорівнює -2, а в пероксидах - -1.
4. Ступінь окиснення Гідрогену в більшості сполук дорівнює +1, а в сполуках з металічними елементами (гідридах) - -1.
5. Ступінь окиснення металів у сполуках завжди позитивний.
6. Більш електронегативний елемент завжди має негативний ступінь окиснення.
7. Сума ступенів окиснення всіх атомів у молекулі дорівнює нулю.
V. Узагальнення та систематизація знань
1. Якими трьома факторами визначаються валентні можливості атомів хімічних елементів?
2. Чому максимальна валентність атомів елементів другого періоду не може бути більше чотирьох?
3. Згадайте, чим відрізняються поняття валентності та ступені окислення. Що між ними спільного?
4. Вкажіть валентність і ступінь окиснення атомів нітрогену в йоні амонію NH4+.
5. Визначте валентність і ступінь окиснення атомів вуглецю в речовинах з формулами С2Н6, С2Н4, С2Н2.
6. Визначте валентність і ступінь окиснення атомів в речовинах з формулами N2, NF3, Н2О2, ОF2, О2F2.
7. Визначте валентні можливості атомів сірки і хлору в основному і збудженому станах.
VІ. Домашнє завдання
Опрацювати §2, завдання № 2, 3, 4 с.20.
-
Ґрунтовно підготована розробка
-
-


про публікацію авторської розробки
Додати розробку
