Уроки хімії для 7 класу з теми "Кисень" у особистісно-орієнтованій системі навчання
Носульська Світлана Петрівна
вчитель хімії
Озаринецької середньої
загальноосвітньої школи І - ІІІ ступенів
Могилів - Подільського району
Вінницької області


Авторський творчий доробок:
уроки хімії для 7 класу
по темі «Кисень»
Передмова
Новий Державний стандарт базової та повної загальної середньої освіти вимагає більш ретельного, різнопланового, багатогранного підходу до навчання сучасного учня, що спонукає учителя до оволодіння інноваційними технологіями навчання, які дають нові можливості підвищувати ефективність навчальної діяльності. Виклад матеріалу і сам навчальний процес повинні набувати нового, профорієнтаційного змісту та сприяти формуванню предметних компетентностей, посиленню позитивної мотивації навчання, розвитку інтелектуальних і творчих здібностей учнів.
Як показує досвід , ефективність уроку залежить від професійності вчителя і методичного рівня викладання предмету. Тому у своїй роботі я намагаюся дотримуватися основних вимог щодо планування та проведення особистісно орієнтованого уроку. А саме:
- дотримання принципів науковості, доступності, взаємозв’язку з життям і відповідності віковим особливостям учнів;
- правильна постановка мети і мотивація навчання;
- вибір структури уроку і використання різноманітних методів, форм і засобів навчання;
- використання новітніх технологій навчання;
- створення ситуацій, що сприяють розвиткові пізнавальних здібностей учнів, та стимулюють до самостійного здобуття знань;
- об’єктивність оцінювання знань, умінь і навичок учнів;
- формування вмінь самооцінки власних знань та знань інших;
- вміння аналізувати, співставляти, порівнювати, узагальнювати, систематизувати вивчене;
- виховання діалогічного спілкування при роботі в парах, малих та великих групах тощо;
Усі ці вимоги намагалася реалізувати, розробляючи систему уроків хімії в 7 класі з теми «Кисень». Наведені матеріали за змістом і структурою повністю відповідають навчальній програмі курсу хімії для учнів 7 класу за новим Державним стандартом базової і повної загальної освіти. На вивчення хімії в 7 класі виділено 1,5 години на тиждень. Тема «Кисень» вивчається протягом 13 годин. До розробки уроків з даної теми увійшли уроки як традиційні, так і нестандартні. Наприклад, «урок-подорож», «урок-проект», «урок-знайомство», інтегрований урок та уроки розвитку практичних вмінь і навичок.
Щоб зробити уроки більш різноманітними і цікавими велика увага приділялася особистісно- орієнтованим вправам і завданням, елементам творчого навчання, вправам для розвитку логічного мислення, інтерактивним вправам, завданням, рольовим іграм. У ході пояснення нового матеріалу намагалася опиратися на життєвий досвід учнів, прикладів з життя, цікаву інформацію, доступну та зрозумілу дітям такого віку. Максимально використовувала міжпредметні зв’язки та матеріал вивчений в курсі «Природознавство».
Велика увага у змісті уроків відводиться хімічному експерименту, демонстрації та самостійній роботі учнів, позакласним і домашнім спостереженням, віртуальному експерименту.
Істотно вплинула на процес отримання знань інформатизація, тому інформаційно-комунікаційні технології дозволяють збільшити швидкість сприйняття, розуміння та засвоєння великої кількості знань. Тому при проведенні уроків постійно використовую матеріали, що містяться на сайті interaktiv. ranok. com. ua. Програма «Інтерактивне навчання». Перевірку знань учнів здійснюю за допомогою тестових завдань різних типів. Швидко це зробити допомагає програма «My test X», оскільки вчителю потрібно лише ввести тести та виставити систему оцінювання.
Для кожного уроку складена план-схема, що містить чітко сплановані етапи уроку, форми і методи діяльності вчителя, кінцевий результат.
Розробка містить орієнтовне календарно-тематичне планування уроків з теми «Кисень».
|
№ п.п |
Дата |
Зміст навчального матеріалу |
Кількість годин |
Демонстрації |
|
1 |
|
Повітря, його склад. |
1 |
|
|
2 |
|
Оксиген. Поширеність Оксигену і кисню в природі. Кисень, склад його молекули, фізичні властивості кисню.
|
1 |
|
|
3 |
|
Закон збереження маси речовини під час хімічних реакцій. |
1 |
Демонстрація. Дослід, що ілюструє закон збереження маси речовини. |
|
4 |
|
Схема хімічної реакції. Хімічні рівняння. |
1 |
|
|
5 |
|
Написання хімічних рівнянь. Коефіцієнти у хімічних рівняннях. |
1 |
|
|
6 |
|
Добування кисню в лабораторії та промисловості. Реакції розкладу. Поняття про каталізатор. |
1 |
Демонстрація. Добування кисню з гідроген пероксиду. |
|
7 |
|
Способи збирання кисню. Доведення його наявності. |
1 |
Демонстрація: 1.Добування кисню з гідроген пероксиду. 2.Збирання кисню витісненням повітря та витісненням води. 3.Доведення наявності кисню |
|
8 |
|
Інструктаж з БЖД. Практична робота № 4 «Добування кисню з гідроген пероксиду, збирання, доведення його наявності» |
1 |
Практична робота №4. |
|
9 |
|
Хімічні властивості кисню: взаємодія з простими речовинами (вуглець, водень, сірка, магній, залізо, мідь) Реакція сполучення. Поняття про оксиди. |
1 |
Демонстрація. Спалювання простих речовин у повітрі та кисні. |
|
10 |
|
Хімічні властивості кисню: взаємодія кисню зі складними речовинами (повне окиснення метану, гідроген сульфіду, глюкози) |
1 |
Демонстрація. Спалювання складних речовин у кисні. |
|
11 |
|
Окиснення. Горіння. Умови виникнення і припинення горіння. Маркування небезпечних речовин. |
1 |
Демонстрація. 1.Протипожежні засоби. 2.Маркування небезпечних речовин. |
|
12 |
|
Колообіг Оксигену у природі. Озон. Проблема чистого повітря. |
1 |
Навчальні проекти №6.Проблема забруднення повітря та шляхи її розв’язання. №7. Дослідження зміни концентрації вуглекислого газу у класній кімнаті під час занять. |
|
13 |
|
Застосування кисню та його біологічна роль. |
1 |
|
|
14 |
|
Узагальнення та систематизація знань, умінь та навичок учнів з теми «Кисень» |
1 |
|
У темі «Кисень» розглядаються властивості простих і складних речовин на прикладі кисню. Хімічні процеси добування кисню є підставою для ознайомлення із законом збереження маси речовин під час хімічних реакцій та хімічними рівняннями. На основі хімічних властивостей кисню вводиться поняття про реакцію сполучення та оксиди металічних і неметалічних елементів.
Урок №1.
Тема уроку: Повітря, його склад.
Мета уроку:
дидактична - ознайомити учнів з якісним та кількісним складом повітря, роботами Лавуазьє про встановлення складу повітря, сформувати уявлення про повітря як суміш газів; з’ясувати значення повітря для збереження життя на Землі;
розвиваюча – розвивати творчу активність, логічне мислення, вміння аналізувати та порівнювати, узагальнювати і робити висновки, розвивати увагу.
виховна – виховувати акуратність і старанність у навчанні, стимулювати формування інтересу до теми уроку, сприяти естетичному вихованню, культурі поведінки.
Тип уроку: засвоєння нових знань.
Форма уроку: урок-ознайомлення.
Основні поняття: повітря, якісний склад, кількісний склад.
Обладнання: прилади для демонстрації наявності повітря, таблиці, схеми, мультимедійна презентація.
План – схема уроку
|
Етап уроку |
Час (хв) |
Форми і методи діяльності вчителя |
Результат |
|
І.Етап орієнтації про місце уроку в курсі, розділі, темі.
|
8 |
Елементи творчого навчання, використання віршованих рядків. Дослідницький - використання демонстрацій.
|
Створення сприятливого психоемоційного клімату. Мотивація навчальної діяльності учнів. Розвиток в школярів пізнавального інтересу. |
|
ІІ.Етап цілепокладання.
|
4 |
Створення асоціативного куща. |
Визначення разом з учнями завдань уроку. |
|
ІІІ.Етап моделювання.
|
4 |
Особистісно орієнтована вправа «Мої очікування». |
Мотивація навчальної діяльності учнів. Розвиток в школярів пізнавального інтересу. |
|
ІV.Етап організації виконання запланованої діяльності.
|
20 |
Розповідь вчителя. Евристична бесіда на основі міжпредметних зв’язків. Робота з підручником. Проблемне навчання. Випереджаюче навчання. Пояснення вчителя за схемою. Створення опорної схеми. |
Ефективне сприйняття і засвоєння нового матеріалу. Зміна форм і методів діяльності, підтримування уваги і активності учнів. Розвиток уяви, пам’яті, критичного мислення. |
|
V.Контрольно-оцінювальний етап.
|
9 |
Вправа «Незакінчене речення» Обмін враженнями від уроку – вправа «Мої очікування». Використання віршованих рядків. |
Закріплення взаємозв’язків у вивченому, формування критичного мислення. Зняття емоційної напруги. |
Хід уроку
І. Етап орієнтації про місце уроку в курсі, розділі, темі.
Створення позитивного настрою
Учитель
Щоб урок пройшов не марно
Треба сісти рівно, гарно,
Щоб знання міцні здобути,
Всім уважними і трудолюбивими треба бути…
Хімічна розминка. Експрес – опитування.
- Що таке явища?
- Які типи явищ ви знаєте?
- Які ознаки хімічних реакцій?
- Що таке проста речовина?
- Наведіть приклади простих речовин.
- Що таке складна речовина?
- Наведіть приклади складних речовин.
- Що таке суміші?
- Як можна відрізнити суміш від чистої речовини?
Учитель. Діти, я знаю, що ви любите цікаві досліди. Тому сьогодні я продемонструю вам декілька з них. Будьте уважні, той хто першим зможе пояснити побачене дізнається тему нашого сьогоднішнього уроку і відповідно отримає додаткові бали.
Демонстрація 1. Для досліду знадобиться порожня склянка і кристалізатор, заповнений водою. Показуємо учням, що склянка порожня, перевертаємо її догори дном і опускаємо у воду. Вода не піднімається у склянку, так як там вже щось є.
- Що це? (Повітря)
Демонстрація 2. В скляну пляшку з широким горлом ставимо клаптик паперу і підпалюємо, коли папір догорить, швидко кладемо круто зварене яйце на горлечко пляшки. Яйце просочитися вниз.
- Хто заманив яйце у пляшку? (Повітря)
( Відповіді учнів)
Учитель. Сьогодні ми розпочинаємо вивчати тему «Кисень», над нею будемо працювати протягом 13 уроків. Розпочнемо знайомство з повітрям.
- Як ви думаєте, чому?
ІІ. Етап цілепокладання.
Створення асоціативного куща.
Учитель. Учні, спробуйте спрогнозувати, якою буде тема нашого уроку? (Відповіді учнів)
Отже, тема нашого уроку «Повітря, його склад». Давайте разом визначимо завдання сьогоднішнього уроку:
- ознайомитися зі складом повітря;
- навчитися визначати якісний і кількісний склад повітря;
- дізнатися про значення повітря для розвитку живої природи і практичної діяльності людини.
ІІІ. Етап моделювання.
Інтерактивна вправа «Мої очікування»
На столі кожного учня аркуш в якому три колонки «Я знав», «Я хочу дізнатися»,
«Я дізнався». Учні працюють з першою колонкою і записують все, що вони знають про повітря. Після того вчитель пропонує учням заповнити другу колонку.
ІV. Етап організації виконання запланованої діяльності.
- Склад повітря.
Учитель. Навколо нашої планети існує газувата оболонка, яку ми називаємо атмосферою. Евристична бесіда.
- Діти. Що ви знаєте про атмосферу з курсу географії?
- Як називається приземний шар атмосфери?
- Який склад повітря?
Детальнішу інформацію на це питання ми знайдемо у підручнику.
Робота з підручником за мал.77 і 78.
Учитель. Склад повітря дещо змінюється залежно від місцевості, погодних умов і висоти над рівнем моря. Склад сухого повітря, що не містить випадкових домішок, наведено в таблиці, що розміщена на слайді. ( розглядаємо 1 та 2 колонку таблиці)
|
Гази - компоненти повітря |
Формула |
Об’ємна частка в повітрі % |
Масова частка в повітрі % |
|
Азот |
N2 |
78,09 |
75,51 |
|
Кисень |
O2 |
20,95 |
23,15 |
|
Аргон |
Ar |
0,93 |
1,28 |
|
Вуглекислий газ |
CO2 |
0,037 |
0,056 |
|
Інші гази |
|
Менше від 0,002 |
Менше від 0,003 |
|
|
|
|
|
- Поняття про об’ємну і масову частку.
Демонстрація.
Визначити об’ємну частку кисню в повітрі можна експериментально. Для цього потрібна скляна пляшка без дна із пробкою і кристалізатор з водою. У пробку вставляємо ложку для спалювання, в яку набираємо трохи червоного фосфору. Його підпалюємо, швидко поміщаємо у пляшку і щільно закриваємо її пробкою. Коли горіння фосфору припиниться, вода займе приблизно 15 частину об’єму пляшки. Цей об’єм займав у повітрі кисень, який вступив у реакцію з фосфором.
Масова частка елемента – це відношення маси елемента до загальної маси елементів, що входять до складу повітря. Одиниця виміру об’ємної і масової частки – відсотки (%).
- Досліди А.Лавуазьє.
- Діти, як ви думаєте, а кому з вчених вперше вдалося визначити склад повітря? На це питання дасть нам відповідь група учнів, що працювали над питанням:
«Досліди А. Лавуазьє з повітрям»
Висновок: Лише наприкінці XVIII століття А.Лавуазьє визначив склад повітря. До його складу входять: азот - 78%, кисень - 21%, вуглекислий газ - 0,03%, аргон - 0,93%.
Отже, повітря-складна суміш газів.
- Охорона повітря.
Самостійна робота з підручником ст.145. «Проблема чистого повітря»
Учні опрацьовують матеріал підручника та з допомогою вчителя створюють опорну схему «Охорона повітря».
- створення безвідходних технологічних процесів;
- озеленення міст і сіл ; (підкреслити важливість даного пункту)
- використання екологічно чистого палива;
- використання відновлювальних джерел енергії;
- встановлення на заводських і фабричних трубах пило газовловлювачів;
Питання охорони довкілля розглядає Конституція України, стаття 546.
V. Контрольно-оцінювальний етап.
Метод «Мозковий штурм»
- Які гази входять до складу повітря?
- Яких газів у повітрі найбільше?
- Як практично переконатися, що кисень займає 1/5 частину повітря?
- Звідки береться в повітрі приблизно однаковий вміст кисню?
Вправа «Незакінчене речення»
- Повітря це …
- Основними компонентами повітря є …
- Найбільше у повітрі ….
- Склад повітря залежить від…
- Кисень у повітря надходить …
- Повітря застосовують…
- Повітря важливо охороняти…
Вправа «Мої очікування».
Учні працюють з третьою колонкою « Я дізнався» і записують все, що вони дізналися про повітря на сьогоднішньому уроці.
Оцінювання учнів.
Слово вчителя.
Повітря і не видно, і не чути.
Але без нього нам не обійтись.
Не можна ні хвилиночки пробути.
Ось ти навколо себе подивись.
Все дихає: листочок і травичка,
Метелик, що над квіткою летить.
І дише рибка, рак, і дише річка…
Повітря треба кожному, щоб жить.
Домашнє завдання:
- Опрацювати матеріал параграфу 15.
- Завдання для двох груп. 1 група - знайти загадки про повітря. 2 група – знайти приказки та прислів’я про повітря.
- Випереджувальне завдання для учнів високого рівня: підготувати історичну довідку «Відкриття кисню».
Урок №2.
Тема уроку: Оксиген. Поширеність Оксигену і кисню в природі. Кисень, склад його молекули, фізичні властивості кисню.
Мета уроку:
дидактична - ознайомити учнів з хімічним елементом Оксигеном та його простою речовиною киснем, вивчити склад молекули кисню, його фізичні властивості, поширеність у природі, історію відкриття;
розвиваюча – розвивати вміння порівнювати і аналізувати склад і властивості молекули кисню, характеризувати Оксиген за положенням у періодичній системі, самостійно здобувати нові знання, робити висновки;
виховна – виховувати впевненість у своїх силах, прагнення до успіху.
Тип уроку: комбінований.
Форма уроку: урок-дослідження..
Основні поняття: озон, Оксиген, кисень.
Обладнання: таблиця «Класифікація речовин», опорна схема «Кисень», мультимедійна презентація.
План – схема уроку
|
Етап уроку |
Час (хв) |
Форми і методи діяльності вчителя |
Результат |
|
І.Етап орієнтації про місце уроку в розділі, темі.
|
8 |
Елементи творчого навчання, використання віршованих рядків. Репродуктивний. Експрес опитування. Метод «Гронування». Вправа «Хто швидше?» Повідомлення учнів. |
Початок уроку в невимушеній атмосфері. Налаштування на роботу під час уроку. Перевірка засвоєних на попередньому уроці знань. Розвиток логічного мислення. |
|
ІІ.Етап цілепокладання.
|
6 |
Використання загадок. Елементи проблемного навчання. |
Розвиток логіки, налаштування на сприйняття нового матеріалу. |
|
ІІІ.Етап моделювання.
|
3 |
Випереджувальне завдання. |
Ефективне засвоєння нових знань. |
|
ІV.Етап організації виконання запланованої діяльності.
|
20 |
Розповідь вчителя. Складання опорної схеми. Робота у малих групах. Заповнення таблиці. Пояснення вчителя за схемою. Організація роботи з підручником. |
Ефективне сприйняття і засвоєння нового матеріалу. Створення опорних схем. Закріплення вмінь і навичок роботи з підручником, вміння вибирати головне. |
|
V.Контрольно-оцінювальний етап.
|
8 |
Вправа «Пропущені слова», «Хибне, вірне», «Вислови власну думку». Завдання практичного спрямування. Творче завдання. |
Формулювання висновків з вивченого. Розвиток вміння висловлювати свої думки. |
Хід уроку.
І. Етап орієнтації про місце уроку в розділі, темі.
Створення позитивного настрою на уроці.
Учитель
Дзвоник всім нам дав наказ-
До роботи швидко в клас.
Всі за парти сядьте чемно –
Хай мине час недаремно.
Фронтальна робота.
- Хімічна розминка – експрес-опитування.
Що ми називаємо повітрям?
Який склад повітря?
Якого газу у повітрі найбільше?
Чи є склад повітря сталим? Чому?
- Інтерактивна вправа «Гронування».
Учні висловлюють свої думки щодо складу повітря, вчитель допомагає встановити зв’язки між поняттями.
Невидиме Утворює атмосферу
![]()
![]()
![]()
![]() N2-78% Суміш газів
N2-78% Суміш газів
Повітря
![]()
![]()
![]() Найбільше азоту
Найбільше азоту
Прозоре О2 – 21%
- Повідомлення учнів, що працювали над такими завданнями:
1 група - загадки про повітря;
2 група – знайти приказки та прислів’я про повітря;
1 група. Загадки про повітря.
Без чого неможливі процеси окислення? (Без повітря)
Що проводить звук у просторі? Немає його – немає і звуку. (Повітря)
Де міститься азот, водень і кисень, також вуглекислий газ, і все це навколо нас? ( У повітрі)
Я його впіймаю носом, а також зловлю насосом, попливу на глибину, та на дно я не піду.(Повітря у надувному човні)
2 група. Приказки та прислів’я про повітря.
Людина без повітря, як риба без води.
Чисте повітря – запорука здоров’я.
Повітря наш перший друг.
У нерозвинених країнах смертельно небезпечно пити воду, а в розвинених дихати повітрям.
Вправа «Хто швидше».
Учні виконують тест на відповідність. Учень, що виконав завдання правильно першим отримує 3 бали, другий 2 бали, третій 1 бал.
Завдання. Розташуйте гази, що входять до складу повітря у порядку зростання їх вмісту від об’єму повітря.
|
Кисень |
78% |
|
Вуглекислий газ. |
0,9% |
|
Азот |
0,03% |
|
Аргон |
78% |
ІІ. Етап цілепокладання.
Вчитель. Діти, ви любите відгадувати загадки? Тому будьте уважні, той хто відгадає загадки першим дізнається тему нашого сьогоднішнього уроку і відповідно отримає додаткові бали.
- Чим ми дихаємо?
- Чого ми ні в кімнаті, ні на вулиці не побачимо, але без нього не зможемо?
- Ти без нього не зможеш ти жити, ні їсти, ні пити, ні говорити.
І, навіть, чесно кажучи, розпалити не можеш ти вогню.
- У нього немає ні ваги, ні кольору.
- Все життя з ним живемо, а ні разу не бачили.
Якщо учні не здогадалися, про що йде мова, демонструємо їм горіння сухої спиртівки. Перекриваємо доступ повітря, полум’я гасне.
Проблемне питання
- Чому загасла спиртівка? (Відповіді учнів)
Повідомлення теми і мети уроку.
- Сьогодні ми ознайомимося з хімічним елементом Оксигеном і простою речовиною киснем. (учні записують тему уроку).
Разом з учнями визначаємо особистісно важливі завдання уроку.
ІІІ. Етап моделювання.
Один з учнів на попередньому уроці отримує випереджувальне завдання: «Знайти цікаві факти про кисень».
Хвилинка – цікавинка:
- Рідкий кисень , як і залізо притягується до магніту.
- Організм дорослого чоловіка щодоби споживає приблизно 900 г кисню, а жінки – 600 г.
Пропонуємо учням план очікуваної роботи. Кожен може запропонувати свій пункт до нього.
- Характеристика Оксигену і кисню.
- Поширення Оксигену і кисню у природі.
- Історія відкриття кисню.
- Фізичні властивості кисню.
ІV. Етап організації виконання запланованої діяльності.
- Характеристика Оксигену і кисню.
На дошці зображена незавершена опорна схема в клітинки якої потрібно вписати відповідні дані, в ході евристичної бесіди учні мають її завершити.
Питання для бесіди:
- Що таке хімічний елемент?
- Де знаходяться символи і назви хімічних елементів?
- Яким символом позначають елемент Оксиген?
- Яка відносна атомна маса Оксигену?
- Який порядковий номер Оксигену?
- На що вказує порядковий номер елемента?
- Яку просту речовину утворює Оксиген?
- Яка хімічна формула кисню?
- Як обрахувати відносну молекулярну масу кисню?
- Що вам відомо про озон?
За допомогою опорної схеми учні дають характеристику хімічного елементу Оксигену за положенням у періодичній системі.
|
Відомості про ... |
|
|
Оксиген |
Кисень |
|
Хімічний символ - О Аr (О) = 16 Валентність - ІІ Розташування в ПС: порядковий номер – 8, 2 період, VІ група Будова атома: Оксиген містить 8 протонів і 8 електронів |
Проста речовина, неметал Хімічна формула - О2 Мr (О2) = 32 Компонент повітря Невелика кількість кисню розчинена у природній воді. |
Повідомлення вчителя.
Своєю назвою елемент Оксиген завдячує А. Лавуазьє. Згідно з його теорією Оксиген був основним функціональним компонентом кислот, відтак отримав свою назву Oxygenium – «той, що народжує кислоти» ( від грец. oxys – кислий та genos – народження).
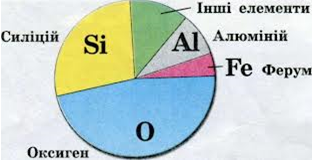
Оксиген – один з найважливіших елементів у природі. Крім простих речовин, кисню та озону, він утворює сполуки майже з усіма хімічними елементами. Оксиген є найактивнішим елементом у природі після Флуору. У складі сполук з іншими елементами він становить 49% від маси земної кори.
- Поширення Оксигену і кисню у природі.
Вчитель. Хімічний елемент Оксиген можна з повним правом назвати всюдисущим. Чому ж? Спробуємо розібратися. Якби ми вигукнули : «Оксиген!», ехо пішло б звідусіль: з – під землі, бо пісок, глина, багато гірських порід і мінералів містять Оксиген; з морів та річок, бо він входить до складу молекули води; з повітря ( чому?), бо 1/5 об’єму повітря – це проста речовина кисень, молекула якої утворена двома атомами Оксигену. Навіть у живих організмах багато Оксигену.
Я скрізь навколо тебе є,
Бо Оксиген – ім’я моє.
Я у деревах, у траві,
У твоїх я жилах, у крові.
Робота з підручником.
- Розгляньте мал. 83 «Поширеність Оксигену у природі», зробіть висновок про елемент Оксиген.
- Де знаходиться Оксиген у природі?
- Яка найпоширеніша сполука Оксигену?
- Яку просту речовину утворює Оксиген?
- Яка хімічна формула кисню?
- Яка відносна молекулярна маса кисню?
- Кисень.
Історична довідка ( супроводжується презентацією).
Перші відомості про кисень, як складову частину повітря, прийшли до нас з глибини VІІІ століття. Китайський вчений Мао-Хоа встановив, що у повітрі є газ, який підтримує дихання і горіння. Через 10 століть, незалежно один від одного кисень відкрили К. Шеєле, Дж. Прістлі, А. Лавуазьє.
Самостійна робота з підручником у малих групах.
Клас ділимо на три групи, кожна група самостійно опрацьовує матеріал підручника про відкриття кисню.
І група – відкриття Дж. Прістлі;
ІІ група - К. Шеєле;
ІІІ група – К. Дреббелем;
Після групи обмінюються отриманою інформацією.
- Фізичні властивості кисню.
Повідомлення вчителя. «Фізичні властивості кисню»
Завдання для учнів. За допомогою підручника заповніть таблицю «Фізичні властивості кисню», що з’явилася на слайді.
Фізичні властивості кисню
|
Агрегатний стан - |
|
Запах - |
|
Смак - |
|
Колір |
|
Температура перетворення кисню на рідину - |
|
Температура перетворення кисню на тверді сині кристали - |
|
Важчий чи легший за повітря – |
|
Розчинність у воді - |
V. Контрольно-оцінювальний етап.
На слайді з’являється завдання 1.
Вправа «Незавершене речення».
Складіть речення, вставивши замість крапок слова «Оксиген» або «кисень» у відповідних відмінках:
… - проста речовина …;
Молекула води утворена Гідрогеном і …;
Молекула … складається з двох атомів …;
У результаті фотосинтезу рослини поглинають вуглекислий газ, а виділяють …
Хімічний елемент Оксиген утворює дві прості речовини … і ….
На слайді з’являється завдання 2.
Вправа «Хибне. Вірне.»
Поставте знак «+», якщо твердження правильне, і знак «-», якщо хибне.
1.Кисень – типовий метал _________.
2.Відносна молекулярна маса кисню – 16 ______________.
3.Хімічна формула кисню – О3 _______________.
Вправа «Вислови власну думку»
Вчитель. Учні, на сьогоднішньому уроці ми познайомилися з хімічним елементом Оксигеном та простими речовинами які він утворює.
- Чому серед відомих на сьогодні 118 хімічних елементів першим ми детально вивчали саме Оксиген?
(учні висловлюють свої думки)
Домашнє завдання.
- Опрацювати матеріал параграфу 15. Виконати вправи 4-10 ст. 114.
- Творче завдання: Створити малюнки, що відображають: склад молекули кисню; фізичні властивості кисню; речовини, які містять атоми Оксигену.
- Випереджаюче завдання для учнів високого рівня: знайти цікаву інформацію з життя М. Ломоносова і А. Лавуазьє.
Урок № 3.
Тема уроку: Закон збереження маси речовини під час хімічних реакцій.
Мета уроку:
дидактична – ознайомити учнів зі законом збереження маси речовини як одним з основних природних законів, що підтверджує цілісність матерії; пояснити сутність закону та його наукове значення; показати роль учених-хіміків А. Лавуазьє та М.В. Ломоносова у відкритті цього закону;
розвивальна - розвивати вміння застосовувати закон збереження маси речовини при написанні рівнянь хімічних реакцій; дати поняття про хімічні рівняння як підтвердження закону збереження маси речовини; формувати вміння складати прості рівняння реакцій; працювати над формуванням хімічної мови, застосуванням хімічних понять та термінів; розвивати логічне мислення;
виховна – виховувати любов до хімічної науки, розуміння її практичної значущості при дослідженні навколишнього світу.
Тип уроку: комбінований.
Форма уроку: урок- відкриття.
Основні поняття: закон, аналіз, синтез, прогноз, гіпотеза, узагальнення.
Обладнання і реактиви: аналітична вага, наважки, колба з корком; розчини: купрум (ІІ) сульфат, натрій гідроксид, хлоридна кислота; мідна пластинка, газовий пальник, залізний цвях.
План – схема уроку
|
Етап уроку |
Час (хв) |
Форми і методи діяльності вчителя |
Результат |
|
І.Етап орієнтації про місце уроку в темі.
|
10 |
Самоспостереження ( дихальна гімнастика). Розв’язання проблемного питання. Інформаційно-рецептивні (фронтальна бесіда) Організація самостійної роботи учнів з опорними схемами та тестами з використанням комп’ютерної техніки. |
Самоспостереження фізіологічних процесів. Вміння робити висновки. Конкретизація і закріплення вже набутих знань. Розвиток уваги. |
|
ІІ.Етап цілепокладання.
|
5 |
Демонстрація досліду. Формулювання запитань до дослідів. Елементи проблемного навчання. |
Підготовка до сприйняття нового матеріалу. |
|
ІІІ.Етап моделювання.
|
5 |
Повідомлення учнів. Елемент випереджаючого навчання. |
Активізація уваги та мислення. Уміння робити висновки, опираючись на новий матеріал. |
|
ІV.Етап організації виконання запланованої діяльності.
|
18 |
Пояснення вчителя. Перегляд відеодосліду та його обговорення. Робота з підручником. Проведення дослідів та їх пояснення.
|
Одержання нових знань з різних джерел. Створення умов для ситуації успіху кожного |
|
V.Контрольно-оцінювальний етап.
|
7 |
Робота в малих групах з роздавальним матеріалом. Вправа «Ланцюжок» Завдання практичного спрямування.
|
Закріплення знань при роботі з картками. Передача інформації іншим. Ефективне засвоєння знань, застосування теоретичних відомостей на практиці. |
Хід уроку
І. Етап орієнтації про місце уроку в темі.
Створення позитивного настрою
Дихальна гімнастика («Дихання через руки»)
Вчитель. Складіть праву і ліву долоні в кулаки з отвором посередині. Піднесіть праву руку до рота, через отвір зробіть глибокий вдих, порахуйте про себе до 5. Затримайте подих, піднесіть до рота ліву руку, в отвір зробіть повільний видих, порахуйте до 5. Вправу повторіть 4-5 разів (бажано стоячи).
- Як змінився колір вашого обличчя?
- Чому ваші щоки стали рожеві?
- Чи відчували ви рух повітря?
- Який газ підтримав дихання?
- Фронтальна бесіда.
- Яка хімічна формула кисню?
- Який хімічний елемент утворює просту речовину кисень?
- Де поширений Оксиген у природі?
- Яким символом позначають елемент Оксиген?
- Яка відносна атомна маса Оксигену?
- Яка відносна молекулярна маса кисню?
- Які сполуки називають оксидами?
- Самостійна робота учнів біля дошки.
Два учні біля дошки відтворюють опорну схему:
- Оксиген як хімічний елемент.
- Кисень як проста речовина.
- Робота з класом над тестами у програмі «My test X»
Завдання. Якщо ви погоджуєтесь з твердженням, поставите відмітку біля слова «так», якщо не погоджуєтесь, зазначте «ні».
Варіант І. Вибрати ознаки, що характеризують Оксиген як хімічний елемент.
Варіант ІІ. Вибрати ознаки, що характеризують кисень як просту речовину.
1.Найпоширеніший елемент на Землі.
2. Відносна молекулярна маса дорівнює 32.
3. Валентність дорівнює ІІ.
4. Погано розчинний у воді.
5. Порядковий номер 8.
6. У рідкому стані має синє забарвлення.
7. Без запаху, смаку і кольору.
8. Заряд ядра атома +8.
9. Граніт, цукор, крохмаль та олія містять його.
10. Відносна атомна маса дорівнює 16.
11. Об’ємна частка у повітрі – 21%.
12. Входить до складу оксидів.
13. А.Л. Лавуазьє дав таку назву елементу: «той, що народжує кислоти».
14. Його відкрили Карл Шеєле та Джозеф Прістлі.
ІІ. Етап цілепокладання.
Вчитель. На попередніх уроках ми з вами говорили про те, що в природі й у світі все змінюється, ніщо не стоїть на місці. На підтвердження цього пропоную вам демонстраційний дослід.
Дослід.
У пробірку з невеликою кількістю хлоридної кислоти додаємо цинк.
Бесіда за питаннями
- Що ви спостерігаєте?
- Яке явище спостерігаємо у пробірці?
Вчитель. Що відбувається з речовинами під час хімічного явища або хімічної реакції?
Відповідь на це запитання нам допоможе дати матеріал нової теми.
Оголошення теми, обговорення завдань уроку.
Проблемні питання.
- Що відбувається з речовинами під час реакції?
- Чи залишається незмінною маса речовин під час реакції?
- Що може дати цей урок кожному з вас?
ІІІ. Етап моделювання.
Вчитель. Чи залишається незмінною маса речовин під час хімічних реакцій? Це запитання в минулому хвилювало багатьох учених.
Історичні дані відкриття закону збереження маси речовини.
Досліди Ломоносова. (Повідомлення учня)
У 1748 році російський вчений М. Ломоносов провів такий дослід. У реторту помістив метал, запаяв її та нагрівав. Після нагрівання маса реторти не змінювалася, хоч метал реагував з киснем повітря, що було в реторті. Після проведеного досліду Ломоносов писав: «Усі зміни в натурі, які трапляються такого суть стану, що скільки в одного тіла забирається, стільки додається до іншого; так, коли де убуде трохи матерії, то збільшиться в іншому місці…»
Досліди Лавуазьє. (Повідомлення учня)
Незалежно від М. Ломоносова, французький вчений А. Лавуазьє в 1789 році підтвердив, що зберігаються не тільки маси речовин, але й маси кожного з елементів, що входять до складу речовин. Маса ніколи не виникає і не знищується, а тільки переходить від однієї речовини до іншої. Це положення відоме як закон збереження маси речовин. Він був сформульований та оприлюднений 1789 року А. Лавуазьє.
Разом з учнями обговорюємо інформацію отриману з повідомлень та складаємо план роботи:
- ознайомитися з законом збереження маси речовини;
- довести його експериментально;
- з’ясувати практичне застосування закону;
ІV. Етап організації виконання запланованої роботи.
- Закон збереження маси речовини, його суть і значення. (розповідь учителя з елементами бесіди).
Вчитель.
- Що ми розуміємо під поняттям «закон»?
- Як на вашу думку повинен формулюватися закон збереження маси?
Учні дають визначення закону збереження маси самостійно.
Вчитель пропонує учням звернутися до підручника ( ст. 115) і ознайомитися з його сучасним формулюванням.
- Відеодослід.
Демонстрація досліду, який підтверджує закон збереження маси речовини
( перегляд відеофрагменту) сайт interaktiv. ranok. com. ua. Програма«Інтерактивне навчання». Дослід, що ілюструє закон збереження маси в хімічних реакціях.
Обговорення відеодосліду.
Питання для обговорення:
- Які ознаки вказували на те, що відбулася хімічна реакція?
- За допомогою якого приладу перевірили дію закону збереження маси?
- Яке значення має цей закон?
- Поняття про хімічні рівняння реакцій.
Вчитель. З’ясувавши суть і значення закону збереження маси речовини, ми відмітили важливість його для складання рівнянь хімічної реакції. Випливає питання: в чому суть хімічної реакції та як вона пов’язана з законом? Пропоную знайти відповідь у підручнику. (Робота з підручником на ст.118)
Експеримент.
У полум’я пальника вносимо мідну пластинку. Ножем знімаємо чорний наліт, що утворився. При даних умовах мідь сполучилася з киснем, що є в повітрі. Утворилася нова речовина – купрум (ІІ) оксид. Пропоную учням записати рівняння реакції та проаналізувати його.
Cu + O2 = CuO
Висновок. Суть хімічних реакцій полягає у перегрупуванні атомів. Перетворення речовин виражають хімічним рівнянням.
Завдання: З’ясувати, чи справедливий закон збереження маси речовини для хімічного рівняння, визначивши відносні молекулярні маси речовин у лівій (визначає одна група учнів) і правій (визначає друга група учнів) частинах рівняння.
Cu + О2= СuO
64 32 80
Результат обчислень: сума відносних молекулярних мас речовин, що вступили в реакцію становить - 96, відносна молекулярна маса утвореної сполуки становить – 80.
Питання для обговорення.
- Чи відповідає наше рівняння закону збереження маси?
- Проаналізуємо записане рівняння і з’ясуємо чому в даному випадку не виконується закон збереження маси речовин?
Припущення учнів.
Потрібно зрівняти число атомів елементів у правій і лівій частині рівняння.
Вчитель. При складанні рівнянь хімічних реакцій необхідно дотримуватись вимоги, щоб число атомів усіх елементів у лівій і правій частинах рівняння було однаковим. Для цього перед хімічними формулами пишуть коефіцієнти, які означають число молекул, окремих атомів або формульних одиниць.
Підбираючи коефіцієнти слід пам’ятати ряд правил. Робота з підручником ст. 119.
Вчитель. Ви опрацювали правила, тому підберіть коефіцієнти до рівняння реакції.
2Cu + О2= 2СuO
Питання вчителя.
- Чи виконується закон збереження маси речовини у цьому випадку?
- Як швидко перевірити дію закону в цьому рівнянні?
Пропозиції учнів.
2 Мr (Cu) + Mr( О2 ) = 2 Mr (СuO)
160 =160
Висновок:
- хімічні рівняння – це вираження закону збереження маси речовини;
- щоб виконувався закон збереження маси речовини, у лівій і правій частинах рівняння кількість атомів кожного елемента має бути однаковою.
V. Контрольно-оцінювальний етап.
Питання для бесіди:
- Які вчені експериментально підтвердили закон збереження маси?
- Як формулюється закон збереження маси речовини?
- Що таке коефіцієнт?
- Який запис називають рівнянням хімічної реакції?
Виконання завдань
1. Під час розкладання води під дією електричного струму утворилося 0,6 г водню й 4,8 г кисню. Яка маса води, що розклалася?
2.Визначте масу кальцій оксиду, який утворюється при взаємодії 3,43 г кисню й 8,57 г кальцію.
Оцінювання роботи учнів на кожному етапі уроку.
Вправа «Ланцюжок».
Вчитель. Озвучте свою думку про цікаві моменти уроку: «На уроці я дізнався про…»
Учні по черзі висловлюють свої думки.
Домашнє завдання.
Опрацювати матеріал підручника параграф 16.
Виконати завдання 1,2, 3 (г, д, е).
Урок №4.
Тема уроку: Схема хімічної реакції. Хімічні рівняння.
Мета уроку:
дидактична – закріпити знання про закон збереження маси речовини. Навчити учнів розрізняти схему хімічної реакції та хімічне рівняння, пояснити правила складання рівнянь хімічних реакцій;
розвивальна - розвивати вміння застосовувати закон збереження маси речовини при написанні рівнянь хімічних реакцій; формувати вміння складати рівняння реакцій та урівнювати їх за допомогою коефіцієнтів, читати рівняння; розвивати хімічну мову та пізнавальний інтерес;
виховна – виховувати творчу і допитливу особистість.
Тип уроку: засвоєння нових знань.
Форма уроку: урок- практикум.
Основні поняття: хімічне рівняння, вихідні речовини, реагенти, продукти реакції.
План – схема уроку
|
Етап уроку |
Час (хв) |
Форми і методи діяльності вчителя |
Результат |
|
І.Етап орієнтації про місце уроку в темі.
|
6 |
Психологічна розминка. Поєднання активних та інтерактивних методів. Рольова гра з вправою «Мікрофон». Організація самостійної роботи учнів. Хімічний диктант з взаємоперевіркою. |
Визначення емоційного стану учнів. Актуалізація знань, встановлення зв’язку теоретичних знань з практикою. |
|
ІІ.Етап цілепокладання.
|
5 |
Представлення девізу уроку. |
Налаштування на роботу під час уроку. |
|
ІІІ.Етап моделювання.
|
4 |
Проблемний виклад інформації. |
Розвиток логіки і уяви. |
|
ІV.Етап організації виконання запланованої діяльності.
|
20 |
Пояснення вчителя. Робота з правилами та алгоритмами. Робота з підручником. Робота з термінами. Читання рівнянь вголос.
|
Засвоєння нового матеріалу. Розвиток логічного мислення, уваги. |
|
V.Контрольно-оцінювальний етап.
|
10 |
Інтерактивні вправи: «Терміни», «Результат». Завдання практичного спрямування та відтворення здобутих знань.
|
Ефективне засвоєння знань, застосування теоретичних відомостей на практиці. Формулювання висновків. |
Хід уроку
І. Етап орієнтації про місце уроку в темі.
Психологічна розминка
Вчитель. Щоб ефективніше організувати нашу роботу на сьогоднішньому уроці, визначимо емоційний стан кожного з нас та цілого класу. Для цього підніміть картку червоного кольору, якщо у вас добрий настрій ; жовтого – задовільний; білого – складно сказати; синього – поганий. ( На парті в учнів лежать картки.)
Визначення емоційного стану
|
Колір |
Червоний |
Жовтий |
Білий |
Синій |
|
Емоційний стан |
добрий |
задовільний |
складно сказати |
поганий |
Враховуємо емоційний стан учнів під час роботи на уроці.
- Рольова гра з використанням інтерактивного методу «Мікрофон».
Один з учнів класу виступає у ролі журналіста, що бере інтерв’ю.
Питання для бесіди.
- Як формулюється закон збереження маси?
- Коли і ким відкритий цей закон?
- Як експериментально був підтверджений закон збереження маси речовин?
- В чому полягає суть хімічної реакції і як це довести дослідом?
- Для чого застосовують коефіцієнти в рівняннях реакцій?
- Хімічний диктант з взаємоперевіркою.
Завдання. Закінчити речення або вставити пропущені слова.
- Суть хімічної реакції полягає у перегрупуванні … ( атомів)
- Закон збереження маси під час хімічних реакцій відкрив …
( Ломоносов)
- Коефіцієнт вказує на … ( число молекул або атомів)
- Спосіб запису хімічних процесів та явищ за допомогою хімічних формул, коефіцієнтів і математичних знаків має назву … ( хімічне рівняння)
- Під час взаємодії цинку масою 13 г з хлором масою 14,2 г утворилося … г цинк хлориду. (27,2 г)
- Закон збереження маси речовин використовують для здійснення … ( хімічних перетворень).
- Щоби складена схема реакції не суперечила закону збереження маси речовин, необхідно … ( поставити коефіцієнти).
- Під час розкладання 100 г крейди утворилося 56 г кальцій оксиду та г вуглекислого газу. (44).
ІІ. Етап цілепокладання.
Девізом нашого сьогоднішнього уроку стануть слова Бернарда Шоу
«Єдиний шлях, який веде до знань – діяльність». Тому сьогодні ми навчимося використовувати свої знання на практиці. Ви спробуєте самостійно писати, урівнювати та пояснювати хімічні рівняння, так як без використання знань про хімічні реакції не обходиться жодне хімічне виробництво.
Оголошення теми і обговорення завдань уроку.
ІІІ. Етап моделювання.
Створення проблемної ситуації
-У чому полягає суть хімічної реакції?
- Що відбувається з атомами під час хімічної реакції?
Демонструємо учням одну кульку жовтого кольору і дві кульки білого кольору( умовно – це будуть атоми хімічних елементів). За допомогою магнітиків, що прикріплені на кульках, з’єднуємо їх разом. Просимо учнів пояснити , що відбувається під час хімічної реакції. (Відповіді учнів). Обговорення плану роботи на уроці.
ІV. Етап організації виконання запланованої роботи.
1.Суть хімічної реакції та її схема
Пояснення вчителя.
Отже, ви знаєте, що під час хімічних реакцій відбувається перегрупування атомів. Саме в перегрупуванні атомів і утворенні нових речовин полягає суть хімічної реакції.
Реагенти —› Продукти реакції
Але для конкретних речовин маємо певні хімічні формули. Хімічну реакцію можна записати за допомогою хімічних формул у вигляді схеми:
С + О2 —› СО2
Вугілля взаємодіє з киснем з утворенням вуглекислого газу Цей схематичний запис називається схемою хімічної реакції. У лівій частині наведеного рівняння записаний один атом Карбону й одна молекула кисню, що складається з двох атомів Оксигену – це реагенти. У правій частині записана одна молекула вуглекислого газу – це продукти.
2.Хімічні рівняння
Розповідь вчителя
Схема реакції є тільки її якісною характеристикою. Кількісну характеристику реакції відображає закон збереження маси речовини. Відповідно до цього закону число атомів різних елементів під час хімічної реакції не змінюється. Число атомів одного елемента до реакції і після мають дорівнювати. Це має бути відображено в схемі хімічної реакції, тоді вона стає хімічним рівнянням. Число атомів урівнюють за допомогою коефіцієнтів. Рівняння хімічної реакції – це умовний запис хімічних перетворень за допомогою формул та коефіцієнтів.
Якщо сказати, що символи хімічних елементів — це літери хімічної мови, то формули сполук — це слова, а рівняння реакцій — цілі фрази.
Так, фразу «Водень взаємодіє з киснем з утворенням води» за допомогою хімічних формул можна записати в такий спосіб:
Н2 + 02 —> Н20.
На прикладі цієї реакції можна показати закон збереження речовини. Треба відзначити, що, по-перше, число атомів кожного хімічного елемента в лівій і правій частинах рівняння є однаковим; по-друге маса речовин, що вступили в реакцію, дорівнює масі речовин, що утворилися в результаті реакції.
Для того щоб складене нами рівняння не суперечило закону збереження маси, необхідно зрівняти кількість атомів усіх елементів обох частинах. Для цього слід поставити відповідні коефіцієнти
2Н2 + 02 = 2Н20
4 атоми 2 атоми 4 атоми Гідрогену
Гідрогену Оксигену й 2 атоми Оксигену
4* 1=4 2* 16 = 32 2 * (2 * 1 + 16) = 36
Рівність числа атомів у лівій частині й числа атомів у правій частині, а також зумовлена цим рівність мас речовин є доказом правильності розміщення коефіцієнтів.
Вчитель. Наше завдання – навчитися складати рівняння хімічних реакцій. Тому на початку нам не обійтися без певних правил. (Учні записують правила у зошит.)
 Правила складання рівнянь хімічних реакцій.
Правила складання рівнянь хімічних реакцій.

V.Узагальнення та систематизація знань.
На слайд проектуються завдання трьох рівнів.
Робота з підручником.
Рівняння хімічних реакцій складаються з урахуванням закону збереження маси. Розглянемо приклади рівнянь хімічних реакцій утворення бінарних сполук із простих речовин на ст. 118. ( Приклад 1, приклад 2).
V. Контрольно-оцінювальний етап.
Завдання 1. Поставте коефіцієнти в рівняннях реакцій. Прочитайте рівняння.
І рівень.
а) Zn + P = Zn3P2 б) H2O2 =H2O +O2
в)Ca + O2 = Ca O г) Na + CI2 = NaCI
ІІ рівень
а) Zn + H CI = ZnCI2+H2 б) HBr + CuO = CuBr2 +H2O
в)AI+ O2 = AI2O3 г) CrCI2+ CI2 = CrCI3
ІІІ рівень
а) AI + H2SO4 = AI2 (SO4)3 +H2 б) NaOH+ H3PO4 = Na3PO4 + +H2O
в)K+ H2O = KOH + H2 г) Cu (NO3)2 = CuO + NO2 + H2O
Завдання2. Перевірте обчисленнями дію закону збереження маси у рівняннях.
І рівень – пункт «в»; ІІ рівень – пункт «а»; ІІІ рівень – пункт «б».
Вправа «Терміни». Клас поділяємо на дві групи. Учні однієї групи записують на дошці терміни, які з’явилися на уроці. (хімічне рівняння, вихідні речовини, реагенти, продукти реакції, коефіцієнт, індекс).
Учні другої групи пояснюють один термін на вибір. Після цього термін з дошки витирають.
Інтерактивна вправа «Результат». Учні по черзі роблять висновки про те, чого вони навчилися на уроці, якого результату досягли.
Оцінювання роботи учнів на уроці.
Домашнє завдання Опрацювати матеріал підручника. Виконати вправи 4,5.
Урок № 5.
Тема уроку: Написання хімічних рівнянь. Коефіцієнти у хімічних рівняннях.
Мета уроку:
дидактична - поглибити й розширити знання учнів про хімічні реакції; продовжити формування поняття про хімічне рівняння як умовне зображення хімічної реакції; дати уявлення про класифікацію рівнянь реакцій за кількістю вихідних речовин і продуктів реакції.
розвивальна - формувати вміння і навички складання рівнянь хімічної реакції, розміщення коефіцієнтів на основі закону збереження мас, читання хімічних рівнянь; удосконалювати навички роботи з хімічним устаткуванням і хімічними реактивами;
Форма уроку: урок-подорож.
Тип уроку: узагальнення та систематизації знань.
Обладнання: періодична система хімічних елементів, пробірки, штатив, реактиви.
План – схема уроку
|
Етап уроку |
Час (хв) |
Форми і методи діяльності вчителя |
Результат |
|
І.Етап орієнтації про місце уроку в темі.
|
5 |
Використання віршованих рядків. Створення проблемної ситуації. Повідомлення теми і мети уроку. |
Початок уроку в невимушеній атмосфері. Налаштування учнів на роботу під час уроку. Єдина логічно-змістова лінія уроку. |
|
ІІ.Етап цілепокладання.
|
5 |
Робота у групах. Інтерактивна вправа «Синтез думок».
|
Уміння працювати в групах, швидко і логічно мислити. |
|
ІІІ.Етап моделювання.
|
5 |
Фронтальна перевірка знань через бліцопитування.
|
Повторення вивченого. |
|
ІV.Етап організації виконання запланованої діяльності.
|
25 |
Використання віршованих рядків. Проведення дослідів з допомогою вчителя. Створення проблемної ситуації. Самостійна робота учнів. Інтерактивні вправи: «Займи позицію», «Коректор». Виконання тестів на комп’ютерах. Робота в парах і групах. Вправа «2,4 всі разом», «Хімічне доміно». |
Уміння критично мислити, виділяти головне, орієнтуватися в навчальному матеріалі,застосовувати теоретичні знання на практиці |
|
V.Контрольно-оцінювальний етап.
|
5 |
Вправа «Хто швидше?» Оцінювання учнів |
Підсумок роботи на уроці.
|
Хід уроку
І. Етап орієнтації про місце уроку в темі.
Створення позитивного настрою
Вчитель
Щоб урок пройшов не марно
Треба сісти рівно, гарно,
Щоб знання міцні здобути,
Всім уважними і трудолюбивими треба бути…
Діти, сьогодні у нас незвичайний урок. Адже ми вирушаємо у подорож з казковими героями з мультику про Вінні Пуха, які зібралися на день народження до мудрої сови. Шлях у них непростий і потрібно буде подолати багато перешкод.
- Ну що, діти, допоможемо нашим героям?
- Які перешкоди можуть стати на їх шляху? (Відповіді учнів)
Обговорення теми, мети і завдань уроку.
ІІ. Етап цілепокладання.
Робота у групах. Інтерактивна вправа «Синтез думок».
- Об’єднайтеся у дві творчі групи, обговоріть тему уроку.
- У кожній групі розробіть план діяльності на уроці у вигляді опорної схеми.
- Після опрацювання обміняйтеся інформацією та внесіть корективи.
- Виробіть єдиний план діяльності на уроці.
ІІІ. Етап моделювання.
Вчитель. Перш ніж вирушати в дорогу, потрібно перевірити вашу готовність до подорожі і зібрати речі у рюкзак – це ваші знання. Отож збираємося у дорогу, і переможе той учень, який збере найповніший рюкзак.
Бліцопитування
- Що таке закон….
- Що таке хімічне рівняння…
- Який закон допомагає розставляти коефіцієнти в рівняннях….
- Як формулюється цей закон…
- А хто експериментально підтвердив цей закон…
- Наведіть приклади, коли цей закон не виконується?
- Для чого використовуються коефіцієнти в рівнянні реакції…
- Що таке реагенти…
- Що таке продукт реакції…
- Чим відрізняється схема реакції і рівняння…
IV. Етап організації виконання запланованої діяльності.
Вчитель. Отже, учні, ми готові вирушити в нашу подорож. Та на шляху нас чекають різні випробовування. Та ми їх подолаємо за допомогою наших знань.
Горішок знань міцний,
Та нам не відступати.
А розколоти допоможе,
Бажання всіх, все хочу знати!!!
На нашому шляху перша перешкода – «Чорна хмара». Щоб її розігнати, необхідно скористатися правилами з нашого рюкзака у якому є багато корисних речей.
Демонстрація досліду. (Два учні демонструють прості досліди).
Дослід 1. Наша хмара непроста і дуже шипуча. Спостерігаємо цікаве явище, яке має назву «Шипучка» (Змішування соди і оцтової кислоти) Інструктаж з БЖД.
- Яке явище ви спостерігали?
- Запишіть умовний запис хімічної реакції. (А+ В= С+Д+Г)
- Яка ознака реакції? (Виділення газу)
Дослід 2. Наша перешкода не відступає. Продовжити свою подорож ми зможемо, коли зникне хмара. «Чорна хмара» утвориться, коли до розчину йоду ми додаємо крохмалю.
( У пробірці утворюється розчин темно-синього кольору).
Таблетку аскорбінової кислоти розчиняємо у склянці води і додаємо до розчину крохмалю з йодом. (Йод у присутності вітаміну С відновлюється, тому розчин знебарвлюється).
- А зараз самостійно запишіть умовний запис хімічної реакції.
- Яка ознака реакції? (Зміна кольору розчину)
Вчитель. До замку мудрої сови вже недалеко.
- Але що це?
- Та це ж «Блискавка» - друга перешкода.
Подолати ми її зможемо, коли знайдемо помилки у записах.
Вправа « Займи позицію».
І варіант.
3 СО2 3 атоми Оксигену?!
6 атомів Оксигену?!
В 3-х молекулах СО2 5 атомів Оксигену?!
3 молекули вуглекислого газу?!
ІІ варіант.
5О2 6 атомів Оксигену?!
5 молекул кисню?!
2 молекули озону?!
Вчитель. Здається нас щось знову зупиняє.
- Що це? Та це ж справжня «Злива» - третя перешкода.
Щоб її перечекати давайте попрацюємо з рівняннями. Наші друзі ішли на день народження з кульками у кожній кульці по два рівняння. Ми повинні привести їх до ладу.
Вправа «Коректор»
На дошці у різнокольорових кульках записані рівняння хімічних реакцій для трьох варіантів:
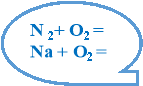 І ІІ ІІІ
І ІІ ІІІ
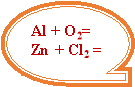
 N2 + О2→ Zn +O2→
N2 + О2→ Zn +O2→
Вчитель. Перш ніж перейти до справи давайте пригадаємо правила, що допоможуть нам урівняти рівняння. (Учні пригадують правила).
Вчитель. Пропоную вам алгоритм для виконання даного завдання. (На слайді демонструємо алгоритм, який учні записують у зошит.)
- Запишіть формулу продукту реакції (врахувати валентність елементів).
- Перетворіть схему на рівняння.
- Розставте коефіцієнти в рівнянні реакції.
Вчитель. Злива не припиняється, тому пропоную пограти в хімічне доміно.
Інтерактивна вправа « Два, чотири, всі разом». Учні працюють у парах, потім у малих групах з чотирьох, після завершення роботи обговорюємо завдання всі разом.
Вправа «Хімічне доміно»
Завдання:
- встановити відповідність між лівою і правою частинами карточок ( ліва частина – один з реагентів, права – один з продуктів);
- написати рівняння хімічних реакцій і урівняти їх;
|
Л Al |
П HNO3 |
Л N2 |
Л NO2 |
|
П NaNO2 |
Л H2 |
П Ca O |
Л Ca |
|
П Al Cl3 |
Л O2 |
П H2 O |
П HN3 |
V. Контрольно- оцінювальний етап.
Вправа «Хто швидше»
Робота з класом над тестами у програмі «My test X».
- Під час взаємодії цинку масою 13 г з хлором масою 14,2 г утворилося … г цинк хлориду. (27,2).
- Під час розкладання 120 г крейди утворилося 56 г кальцій оксиду та … г вуглекислого газу. (64).
- При взаємодії 13 г алюмінію з ….г хлору, утворилося 27 г алюміній хлориду. (14)
Вчитель. Здолавши всі перешкоди ми прийшли до будиночку мудрої сови. Наша подорож добігла кінця. Сподіваюся вам було цікаво подорожувати з казковими героями.
Діти! Слухаючи ваші відповіді я пригадала прислів’я “Без труда нема плода”. Всі потрудились на славу, тому кожен заслуговує на справедливу плату, тобто оцінку.
Оцінювання учнів.
Запитання до класу
- Чи все на уроці вам було зрозуміло?
- Чи виникали у вас труднощі при виконанні завдань?
- Що вам найбільше сподобалось на уроці?
Вчитель. У своєму будиночку мудра сова залишила нам конверт.
- Що в ньому?
Учень зачитує лист з конверта.
«Ніщо в світі не вічне. Ріка змінює свій напрям, день змінює ніч. Ви після уроку стали мудрішими. Десь з’являється щось нове, а щось відмирає. Але запам’ятайте - знання є вічними людськими цінностями!»
Вчитель. Ну, що ж. Всьому в житті свій час
Дзвін кличе на перерву нас.
Я хочу щиро побажати,
Любі хлопці та дівчата,
Щоб добрими ми всі зростали,
Батьків і ближніх поважали,
Щоб мудрість ми в житті знайшли.
І всі щасливими були.
Домашнє завдання.
Параграф 14, вправи 109 – 111.
Урок №6
Тема уроку: Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор.
Мета уроку:
дидактична -сформувати в учнів поняття про реакцію розкладу та каталізатор на прикладі реакцій добування кисню; ознайомити учнів із добуванням кисню в промисловості та в лабораторії;
розвивальна - розвивати вміння записувати рівняння хімічних реакцій добування кисню з оксигеновмісних сполук; розвивати пізнавальний інтерес, логічне мислення; формувати вміння систематизувати матеріал, вибирати головне;
виховна - виховувати самостійність та екологічне мислення; свідомий інтерес до вивчення предмета;
Базові поняття та терміни: Оксиген, кисень, гідроген пероксид, каталізатор, реакція розкладу.
Тип уроку: вивчення нового матеріалу.
Форма уроку: урок- ознайомлення.
План-схема уроку
|
Етап уроку |
Час (хв) |
Форми і методи діяльності вчителя |
Результат |
|
І.Етап орієнтації про місце уроку в темі.
|
5 |
Інтерактивний прийом «Я вітаю» Фронтальний контроль знань з використанням інтерактивних методів – «Мозковий штурм», «Хто перший?». Групова робота.
|
Створення позитивного психологічного настрою, розвиток емфатичного ставлення до інших людей. Визначення рівня освітньої компетентності учнів. |
|
ІІ.Етап цілепокладання.
|
5 |
Використання відомих висловів. Елементи проблемного навчання. |
Розширення світогляду, розвиток логіки, налаштування на сприйняття теми. |
|
ІІІ.Етап моделювання.
|
5 |
Інтерактивний метод «Лист до самого себе».
|
Вміння самостійно працювати. |
|
ІV.Етап організації виконання запланованої діяльності.
|
25 |
Створення проблемної ситуації. Використання інтерактивних методів. Групова робота. Проведення та пояснення дослідів. Формулювання запитань до дослідів. Створення опорних схем. Робота з визначеннями.
|
Одержання з тексту та демонстрацій нових знань. Ефективне засвоєння нового матеріалу. |
|
V.Контрольно-оцінювальний етап.
|
5 |
Фронтальна бесіда. Виконання тренувальних вправ. Метод «Прес». |
Уміння застосовувати теоретичні знання на практиці. Формулювання висновків з вивченого. |
Хід уроку.
І. Етап орієнтації про місце уроку в темі.
Інтерактивний прийом «Я вітаю»
« Я вітаю тих, хто…» ( має хороший настрій; добре відпочив; хоче працювати; виконав домашнє завдання; в доброму гуморі; хотів би дізнатися щось нове; хоче спілкуватися тощо).
«Мозковий штурм»
- Пригадайте де поширений Оксиген у природі?
- Яку просту речовину утворює Оксиген?
- Яка хімічна формула кисню?
- Який елемент є обов’язковою складовою частиною оксидів?
Робота в групах
Вправа «Хто перший?»
Вправа виконується у вигляді змагання між рядами. На кожен ряд подається аркуш з написом «кисень», кожен учень по черзі дописує слово. Через 3 хв вчитель перевіряє повноту, достовірність інформації від кожного ряду.
Наприклад:
Кисень:
- Газ без кольору, смаку і запаху;
- Важчий за повітря;
- Прозорий;
- Підтримує дихання і горіння;
- Утворює оксиди;
- Малорозчинний у воді;
- Мr (О2) = 32;
ІІ. Етап цілепокладання.
Учитель. «Dum spiro, spero” ( «поки дихаю – сподіваюсь»), відомий вислів римського поета І ст. Овідія. Зверніть увагу, у цьому вислові дихання є синонімом життя. Чим це пояснити? ( Учні висловлюють припущення, процес дихання є необхідним для всього живого, і для кожного з нас тому забезпечує життя)
Проблемні питання:
- Як кисень утворюється в природі?
- Чому наявність кисню у повітрі важлива для кожного з вас?
- Чи можна отримати кисень у лабораторії?
- А з яких речовин отримують кисень?
- Як зібрати кисень?
- Як переконатися, що отриманий газ кисень?
ІІІ. Етап моделювання.
Повідомлення теми і мети уроку.
Завдання уроку учні мають визначити самостійно.
Інтерактивний метод «Лист до самого себе».
Очікувані результати:
- Знати способи добування кисню в промисловості і лабораторії;
- Знати, що таке каталізатор;
- Знати як перевірити, що добутий газ кисень;
ІV. Етап організації виконання запланованої роботи.
Вчитель. Діти, як ви вважаєте, з яких речовин можна добути газ кисень?
Відповіді учнів. Кисень добувають з оксигеновмісних сполук.
Вчитель. Які вам відомі оксигеносмісні сполуки?
Відповіді учнів. Оксиди.
Вчитель. Давайте разом складемо опорну схему «Способи добування кисню», використовуючи матеріал підручника.
Робота з підручником
Завдання1. Прочитайте матеріал підручника на ст122. 1-й абзац.
Завдання 2. Виділіть інформацію для опорної схеми.
Опорна схема.
«Способи добування кисню»







1.Одержання кисню в промисловості.
Розповідь учителя.
У промисловості кисень одержують електролізом води та з повітря. а) електролітичний метод
Через воду пропускають електричний струм, під дією якого вона розпадається на водень та кисень:
2H2O ел. струм 2Н2 +О2
Для того, щоб вода проводила електричний струм до неї додають інші речовини (луги або сульфати лужних металі).
Установка для виробництва кисню методом електролізу води

б) розділення повітря.
Цей метод ґрунтується на використанні різниці температури кипіння газів, з яких складається повітря.Спочатку зріджують повітря. Для цього його сильно стискають (100-200 атм.), а після цього різко знижують тиск. Внаслідок цього повітря сильно охолоджується й переходить у рідкий стан (при температурі -192 °С). Рідке повітря переганяють у ректифікаційній колоні. Оскільки азот кипить при -196 °С, а кисень - при -183 °С, із рідкого повітря спочатку відганяється азот, а потім кисень.

Установка для одержання кисню із повітря (киснева станція).
2.Одержання кисню в лабораторії.
Розповідь учителя.
У лабораторії кисень одержують у невеликих кількостях. Для цього використовують речовини, які легко розкладаються з виділенням кисню незалежно від того, зустрічаються вони в природі чи добуті штучно. Для одержання кисню в лабораторії використовують термічно нестійкі оксиди, солі й інші речовини.
Експеримент.
Демонстрація. Добування кисню в лабораторії.
а) Розклад калій хлорату.
Покладемо в чисту суху пробірку кілька кристалів бертолетової солі та нагріваємо її у полум’ї спиртівки. Спочатку сіль починає плавитися, а потім закипає і починається розкладання з виділенням безбарвного газу за рівнянням:
![]() 2 KCIO3 = 2 KCI + 3О2
2 KCIO3 = 2 KCI + 3О2
Для перевірки наявності кисню в пробіркозбирач опускаємо тліючу скіпку. Вона спалахує яскравим полум’ям і горить.
Постановка проблеми.
- Який висновок можна зробити після проведеного експерименту?
Розв’язання проблеми.
- Кисень можна добути розкладом оксигеновмісних речовин.
- Кисень підтримує горіння.
- Кисень можна виявити за допомогою тліючої скіпки.
Робота в малій групі. «Навчаючи – вчусь»
Учні отримують попереднє завдання:
- переглянути відеодослід «Добування кисню розкладом гідроген пероксиду» на сайті interaktiv. ranok. com. ua. «Інтерактивне навчання». Тема «Кисень»;
- продемонструвати учням класу розклад гідроген пероксиду;
Учні з допомогою вчителя проводять дослід.
б) розклад гідроген пероксиду.
Видозмінимо дослід. Як вихідну речовину для добування кисню візьмемо гідроген пероксид (H2O2). При нагріванні кисень не виділяється. Покладемо до пробірки щіпку манган (ІV) оксиду і знову нагріємо. У пробіркоприймачі збирається кисень. Фільтруємо реагуючу суміш. Манган (ІV) оксид не використався.
MnO2
2Н202 →2Н20 + 02↑
Проблемне питання.
- Чому ми додавали порошок манган (ІV) оксиду, якщо він не взяв участі у реакції?
Формуємо поняття каталізатора.
Робота з підручником ст. 123.
в) Розклад калій перманганату.
Розповідь вчителя.
2KMnO4= K2 MnO 4 + MnO2 +O2 ↑
г) Розклад оксидів важких металів.
Розповідь учителя.
Оксиди важких металів розкладаються під дією температури:
2Нg0 = 2Нg + O2 ↑
3.Реакції розкладу.
Розповідь вчителя з елементами бесіди.
Вчитель. Учні, уважно розгляньте рівняння хімічних реакцій, що демонструють добування кисню.
2KCIO3 = 2 KCI + 3О2; 2KMnO4= K2 MnO 4 + MnO2 +O2 ↑;
2Н202 →2Н20 + 02↑; 2Нg0 = 2Нg + O2 ↑;
- Яку спільну ознаку мають ці реакції? (в результаті всіх раніше розглянутих реакцій виділяється кисень).
- Вони мають ще одну спільну ознаку. Яку? ( в лівій частині рівняння записана одна речовина, а в продуктах – декілька)
Пропонуємо учням самостійно дати визначення реакціям розкладу.
Висновок. Реакції, в результаті яких з однієї складної речовини утворюються декілька інших речовин (простих або складних), називаються реакціями розкладу.
Учні записують визначення у робочий зошит.
V. Контрольно- оцінювальний етап.
Бесіда.
1. Яким чином одержують кисень в лабораторії?
2. Яким чином кисень одержують в промисловості?
3. Які речовини називають каталізаторами?
4. Де в повсякденному житті ми стикаємося з дією каталізаторів?
5. Які реакції називають реакціями розкладу?
Виконання вправ
1.Нітратна кислота має формулу HNO3. Під дією світла вона розкладається. При цьому утворюються такі речовини: вода, кисень, газ бурого кольору NO2. Напишіть рівняння реакції та урівняйте його.
Метод «Прес».
Вчитель. Озвучте свою думку про цікаві моменти уроку: «На уроці я дізнався про…»
Домашнє завдання
Опрацювати параграф підручника та виконати завдання після нього.
Випереджувальне завдання: підготувати інформацію «Зберігання кисню», «Транспортування кисню».
Урок № 7.
Тема уроку: Способи збирання кисню. Доведення наявності кисню.
Мета уроку:
дидактична – навчити учнів визначати наявність кисню дослідним шляхом використовуючи лабораторний посуд для добування і збирання кисню; показати різні способи збирання кисню, що ґрунтуються на його властивостях;
розвивальна - розвивати практичні вміння і навички при роботі в хімічним посудом та реактивами; сформувати відповідні навички хімічного експерименту з дотриманням правил техніки безпеки; розвивати в учнів уміння працювати в парах та групах, висловлювати свої думки;
виховна - виховувати самостійність, уміння співпрацювати.
Обладнання та реактиви: періодична система хімічних елементів Д. І. Менделєєва; лабораторний штатив із тримачем і лапкою, спиртівка, пробірки, газовивідна трубка, кристалізатор, скіпка, штатив для пробірок, вата, гідроген пероксид, манган(ІV) оксид, вода.
Базові поняття та терміни: Оксиген, кисень, гідроген пероксид, каталізатор, реакція розкладу.
Тип уроку: комбінований.
Форма уроку: урок – практикум.
План – схема уроку
|
Етап уроку |
Час (хв) |
Форми і методи діяльності вчителя |
Результат |
|
І.Етап орієнтації про місце уроку в темі.
|
6 |
Відгадування загадок. Фронтальна бесіда з використанням інтерактивної вправи «Вірю – не вірю».
|
Перевірка засвоєних на попередньому уроці знань.. |
|
ІІ.Етап цілепокладання.
|
5 |
Елементи проблемного навчання. |
Розвиток в учнів пізнавального інтересу. |
|
ІІІ.Етап моделювання.
|
5 |
Інтерактивна вправа «Майстер-клас». Елементи випереджаючого навчання. |
Ефективне засвоєння матеріалу. |
|
ІV.Етап організації виконання запланованої діяльності.
|
24 |
Розповідь-пояснення вчителя. Повідомлення учнів. Виконання дослідів. Використання інтерактивних методів. Групова робота. Використання ІКТ.
|
Зацікавлення темою уроку. Сприйняття матеріалу в нетрадиційний формі. Виділення основного. |
|
V.Контрольно-оцінювальний етап.
|
5 |
Фронтальна бесіда. Самостійна робота учнів. Метод «Незакінчене речення…». |
Уміння застосовувати теоретичні знання на практиці. Формулювання висновків з вивченого |
Хід уроку.
І. Етап орієнтації про місце уроку в темі.
Створення позитивного настрою.
Вчитель. Сьогодні на уроці я бажаю вам бути успішними, впевненими в собі. Усміхніться, і до вас прийде радісний настрій.
«Хвилинка- цікавинка.»
Відгадайте загадки.
Творцем і руйнівником природи
Зветься ця речовина:
Газоподібна і проста,
Ще й трохи важча за повітря.
Як називається вона? ( Кисень)
Оксиди він утворює,
Цей елемент хімічний,
І на планеті нашій
Найбільш займає місця. (Оксиген)
Речовини – боягузи,
Самі в бійку не ідуть,
А лиш осторонь сміються,
Швидкість бійці придають. (Каталізатори)
Була складна речовина,
І вмить розклалася вона:
На менш складні чи на прості,
Утворивши всі нові. ( Реакція розкладу)
Інтерактивна вправа «Вірю не вірю»
Завдання. Якщо ви погоджуєтеся з твердженням, кажете «вірю» і пояснюєте чому, якщо ні, кажете «не вірю».
Чи вірите ви що:
- У лабораторії кисень одержують з оксигеновмісних речовин, які легко розкладаються при нагріванні.
- Наявність кисню в посудині можна довести жевріючою скіпкою.
- Каталізатори – це речовини, які сповільнюють швидкість хімічних реакцій.
- Кисень в атмосфері поповнюється за рахунок фотосинтезу.
- Розкладання калій перманганату – лабораторний метод одержання кисню.
- Зазвичай кисень одержують реакціями сполучення.
- У промисловості кисень одержують зі зрідженого повітря.
- Каталізатором реакції розкладу гідроген пероксиду є MgО.
- Найбільша масова частка Оксигену у воді.
- Розклад води електричним струмом має назву електроліз води.
ІІ. Етап цілепокладання.
Вчитель. Сьогодні ми продовжимо вивчати властивості кисню, узагальнимо здобуті вами знання, продовжимо формувати навички запису рівнянь хімічних реакцій та проведемо хімічний експеримент. Проте відкритими залишаються такі питання:
Створення проблемної ситуації.
- Яким способом можна зібрати кисень?
- Як зберігають та транспортують кисень?
- Чи потрібні знання про властивості кисню у повсякденному житті?
( Учні висловлюють власні думки)
Оголошення теми і мети уроку.
ІІІ. Етап моделювання.
Формулювання завдань уроку
Інтерактивна вправа «Майстер-клас»
- Учні з високим рівнем навчальних досягнень створюють творчу групу консультантів з теми уроку ( навчальну інформацію опрацювали самостійно).
- Школярі об’єднуються у творчі групи, ознайомлюються з матеріалом уроку за планом:
знати:
- метод збирання кисню витісненням води;
- метод збирання кисню витісненням повітря;
- способи зберігання кисню;
- правила техніки безпеки при проведенні експерименту;
вміти:
- працювати з хімічним посудом та реактивами;
- складати прилад для збирання кисню витісненням води;
- працювати у групі;
ІV. Етап організації виконання запланованої роботи.
- Методи збирання кисню.
Розповідь вчителя.
Кисень важчий за повітря, оскільки Мr (О2) = 32 а Мr (пов)= 29, і малорозчинний у воді, тому його можна збирати двома способами: витісненням повітря і витісненням води.
Робота з опорною схемою та мал. 94 підручника.





а) метод витіснення повітря
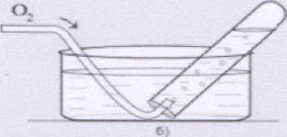
Кисень важчий від повітря, отже посудину-приймач слід тримати дном донизу. Кисень буде опускатися на дно посудини витісняючи повітря, що міститься в ній. б) метод витіснення води.
Посудину-приймач заповнюють водою по вінця. Закривають та перевертають догори дном. Опустивши отвір посудини у кристалізатор з водою, її відкривають під водою. Вода тримається у посудині. Знизу через трубку надходить кисень, який піднімається вгору, виштовхуючи воду.
Збирання кисню методом витіснення води
Групова робота.
Учнів класу об’єднуємо в 2 групи. В кожній групі вибираємо консультанта
(учня високого рівня) який буде керувати роботою учнів. Кожна група отримує завдання.
Повторюємо правила техніки безпеки при роботі з хімічним приладдям та реактивами.
Завдання для І групи:
- переглянути відеодослід «збирання кисню методом витіснення повітря» на сайті interaktiv. ranok. com. ua. «Інтерактивне навчання». Тема «Кисень»;
- добути кисень з гідроген пероксиду;
- зібрати кисень витісненням повітря;
- довести наявність кисню;
Завдання для ІІ групи:
- переглянути відеодослід «збирання кисню методом витіснення води» на сайті interaktiv. ranok. com. ua. «Інтерактивне навчання». Тема «Кисень»;
- зібрати пристрій для збирання кисню;
- добути кисень з гідроген пероксиду;
- зібрати кисень витісненням води;
- довести наявність кисню;
Після завершення роботи кожна група демонструє спосіб збирання кисню який вони засвоїли.
2.Зберігання і транспортування кисню.
Повідомлення учнів: «Зберігання кисню», «Транспортування кисню».
V. Контрольно-оцінювальний етап.
Бесіда.
1. Які методи збирання кисню вам відомі?
2. Які властивості кисню лежать в основі його збирання витісненням води?
3. Що таке посудина Дюара?
4. У яких посудинах зберігають газуватий і рідкий кисень?
Самостійна робота учнів.
Виконання вправ
1.У хімічну склянку налили розчин гідроген пероксиду масою 400г і додали каталізатор. Після завершення виділення бульбашок газу в склянці залишилася вода масою 375 г. Обчисліть масу виділеного кисню.
Вправа «Незакінчене речення»
- На сьогоднішньому уроці я закріпив знання про …
- Я навчився…
- Я побачив, що…
- Після сьогоднішнього уроку я вже не допущу помилок…
- Мені слід повторити…
- На уроці було цікавим…
Сподіваюсь ви переконались, що тільки наполеглива праця на кожному уроці поповнить ваш багаж знань з тієї чи іншої теми.
Домашнє завдання.
Опрацювати параграфу 17 підручника та виконати завдання після нього.
Урок №8.
Тема уроку: Практична робота № 4 «Добування кисню з гідроген пероксиду, збирання, доведення його наявності»
Мета уроку:
дидактична – навчити учнів застосовувати теоретичні знання на практиці; ознайомити з лабораторним способом добування кисню, виробляти вміння і навички у проведенні хімічного експерименту і аналізі явищ, що спостерігаються;
розвивальна - розвивати логічне мислення, пізнавальний інтерес, продовжити формувати навички роботи з лабораторним обладнанням і хімічними реактивами з дотриманням правил техніки безпеки; формувати вміння правильно робити висновки.
виховна - виховувати бережливе ставлення до обладнання, реактивів та власного здоров’я.
Обладнання та реактиви: лабораторний штатив із тримачем, нагрівний прилад з відкритим полум’ям, штатив із пробірками, суха пробірка з газовідвідними трубками, хімічна склянка для збирання кисню, скляна пластинка, 30% -й розчин гідроген пероксиду (пергідроль), деревна вуглинка (розміром з горошину), вапняна вода; речовина, що прискорює розкладання пероксиду; пісок
Базові поняття та терміни: гідроген пероксид, кисень, витіснення.
Тип уроку: практичне здобуття знань, практична робота.
План – схема уроку
|
Етап уроку |
Час (хв) |
Форми і методи діяльності вчителя |
Результат |
|
І.Етап орієнтації про місце уроку в темі.
|
2 |
Вступне слово вчителя. |
Створення позитивного психологічного настрою. Налаштування на роботу |
|
ІІ.Етап цілепокладання.
|
5 |
Індивідуальна робота з тестами з використанням комп’ютерів. Фронтальна бесіда у вигляді бліц-опитування.
|
Перевірка засвоєних на попередньому уроці знань та готовності до виконання практичної роботи. |
|
ІІІ.Етап моделювання.
|
4 |
Повідомлення учнів. |
Залучення учнів до діяльності через випереджувальні завдання. |
|
ІV.Етап організації виконання запланованої діяльності.
|
30 |
Виконання практичної роботи. Індивідуальна та парна робота. Складання звіту про роботу
|
Удосконалення практичних вмінь і навичок. |
|
V.Контрольно-оцінювальний етап.
|
4 |
Складання Т-схеми. Оцінювання учнів. |
Підбиття підсумків уроку. |
Хід уроку
І. Етап орієнтації про місце уроку в темі.
Доброго дня дорогі мої учні. Шлях до розвитку й, насамперед, до щастя людини лежить через його працю. Це слова Д.І. Менделєєва. Працею вчений назвав не будь-яку роботу, а роботу осмислену, необхідну людям. Я буду щаслива побачити саме таку роботу на сьогоднішньому уроці. Хочу щоби ви були впевнені в собі, активні, уважні і отримали максимум користі від сьогоднішнього уроку. Бажаю вам успішного уроку.
Вчитель. Метою нашого уроку буде закріплення теоретичних знань про методи добування і збирання кисню. Сьогодні ви самостійно спробуєте добути кисень та довести його наявність. Та перш ніж перейти до виконання практичної роботи ми маємо пригадати правила техніки безпеки.
ІІ. Етап цілепокладання.
2.Інструктаж з правил техніки безпеки.
Перевіряємо готовність учнів до практичної роботи шляхом тестування у програмі «My test X»
- Індивідуальна робота. «Тест-контроль».
- Для проведення досліду потрібно використовувати:
а) велику кількість реактиву;
б) невелику кількість реактиву;
в) скільки сам вважаєш за потрібне;
- При потраплянні реактивів на шкіру чи одяг потрібно:
а) змити речовину проточною водою;
б) повідомити вчителя;
в) продовжувати роботу;
4. Укажіть твердження, що не стосується кисню:
а) безбарвний газ
б) легший за повітря
в) не підтримує горіння
5. У лабораторних умовах кисень добувають:
а) розкладом оксигеновмісних речовин
б) зі зрідженого повітря
в) у результаті фотосинтезу
6. Кисень збирають в лабораторних умовах:
а) у пробірку, перевернуту догори дном
б) витісненням води
в) витісненням повітря
2. Фронтальна робота. Бліц-опитування.
- Назвіть хімічну формулу кисню.
- Перелічіть фізичні властивості кисню.
- Які способи збирання кисню вам відомі?
- На яких властивостях кисню вони ґрунтуються?
- Як практично перевірити наявність кисню?
ІІІ. Етап моделювання.
Інформаційна довідка.
Повідомлення учнів.
Гідроген пероксид у побуті називають перекис водню. Зазвичай його використовують у вигляді 3-5 % водного розчину для дезінфекції подряпин і дрібних ран. Потрапивши на ранку, гідроген пероксид під дією каталізаторів, наявних у крові, починає виділяти кисень, який вбиває бактерії, закупорює дрібні судини і зупиняє кровотечу. Також гідроген пероксид використовують у вигляді 30 % водного розчину під назвою пергідроль.
Пергідроль (30%-й розчин гідроген пероксиду) — їдка речовина! У разі потрапляння на шкіру може призвести до слабких опіків. Знебарвлює одяг. У разі потрапляння пергідролю на шкіру або одяг його необхідно змити проточною водою.
Інструктаж з проведення практичної роботи.
Розповідь учителя:
- порядок проведення практичної роботи;
- принципи оформлення результатів практичної роботи в зошитах;
( Робота виконується згідно інструкції в зошиті для лабораторних дослідів та практичних робіт).
ІV. Етап організації виконання запланованої діяльності.
1.Виконання роботи
1.1 Підготовка до проведення роботи:
а) складання приладу;
б) наповнення пробірки каталізатором манган ( ІV ) оксидом;
в) вмонтування в лапку штативу;
1.2. Проведення роботи.
а) піпеткою краплями додаємо гідроген пероксид;
б) пробірку закриваємо пробкою з газовідвідною трубкою, кінець трубки опускаємо у склянку;
б) збирання кисню методом витіснення повітря;
в) доведення наявності кисню;
г) горіння речовин у кисні;
- Формулювання висновків.
Складання звіту про виконану роботу.
|
Назва досліду |
Що робили? |
Що спостерігали? |
Рівняння реакції |
Висновок |
|
|
|
|
|
|
Завдання. Вставити пропущені слова.
Висновок: Кисень можна добути шляхом розкладу ________ під дією ________________, який є ____________________________________.
Довести наявність кисню можна за допомогою _________________________, вона .
V. Контрольно-оцінювальний етап.
Загальний висновок про пророблену роботу.
Складання Т схеми.
|
Що я вмів? |
Що я навчився? |
|
|
|
Оцінювання учнів.
Домашнє завдання.
Повторити вивчений матеріал параграфу 17.
Урок № 9.
Тема уроку: Хімічні властивості кисню: взаємодія з простими речовинами (вуглець, водень, магній, сірка, залізо, мідь). Реакція сполучення. Поняття про оксиди.
Мета уроку:
дидактична - ознайомити учнів з хімічними властивостями кисню на прикладі його взаємодії з простими речовинами, закріпити навички складання хімічних рівнянь, розширити знання про хімічні реакції, сформувати уявлення про реакції сполучення;
розвивальна - розвивати логічне мислення, пізнавальний інтерес;
виховна - виховувати самостійність, акуратність, старанність у навчанні, дбайливе ставлення до навколишнього середовища.
Обладнання та реактиви: набір реактивів, пробірки, спиртівка, ложка для спалювання речовин.
Базові поняття та терміни: кисень, хімічні властивості, оксиди, прості речовини, реакція сполучення.
Тип уроку: комбінований.
Форма уроку: урок-ознайомлення.
План – схема уроку
|
Етап уроку |
Час (хв) |
Форми і методи діяльності вчителя |
Результат |
|
І.Етап орієнтації про місце уроку в темі.
|
5 |
Елементи ейдетики – вправа на розвиток уяви «Слова за хвилину» Самостійна робота учнів над тестовими завданнями. Інтерактивний прийом «Мозковий штурм». |
Відтворення в пам’яті термінів, пов’язаних з вивченим матеріалом. Актуалізація знань, встановлення зв’язку теоретичних знань з практикою. |
|
ІІ.Етап цілепокладання.
|
3 |
Інтерактивна вправа «Асоціативний кущ» |
Визначення разом з учнями завдань уроку. |
|
ІІІ.Етап моделювання.
|
6 |
Використання казки-загадки. Проблемні питання. |
Підготовка до сприйняття нового матеріалу. Розвиток пізнавального інтересу. |
|
ІV.Етап організації виконання запланованої діяльності.
|
25 |
Розповідь-пояснення вчителя. Демонстрації дослідів. Проблемний виклад інформації. Робота з підручником. Робота з хімічними рівняннями. Перегляд відеодосліду та його обговорення.
|
Засвоєння нового матеріалу. Розвиток логічного мислення, уваги, вміння виділяти головне. |
|
V.Контрольно-оцінювальний етап.
|
6 |
Завдання практичного спрямування. Самостійна робота учнів. |
Закріплення знань, удосконалення практичних вмінь і навичок. |
Хід уроку.
І. Етап орієнтації про місце уроку в темі.
Аналіз практичної роботи
Вправа «Слова за хвилину»
Діти працюють у парах. Протягом хвилини один учень називає всі нові терміни і поняття відомі йому на тему «Кисень», другий ставить після кожного слова крапки чи інші позначки ( для зручності підрахунку слів). Потім міняються ролями. Після завершення підраховують кількість названих слів. У середньому з першої проби учень називає 15 слів, з кожним наступним разом їх кількість збільшується, що свідчить про розширення кругозору і уважність.
- «Мозковий штурм»
- Яку тему ви вивчаєте?
- Яку роль відіграє кисень для живих організмів?
- Який склад молекули кисню?
- Які фізичні властивості кисню?
- Як можна добути кисень?
- Яким чином можна переконатися у наявності кисню?
- Самостійна робота над тестовими завданнями за двома варіантами.
І варіант.
1.Позначте відносну атомну масу Оксигену:
А. 32. Б. 16. В. 8. Г. 18.
2. Позначте прізвище вченого, який встановив, що кисень займає приблизно п’яту частину повітря за об’ємом:
А. Дж. Прістлі. Б. А. Лавуазьє. В. Мао-Хоа. Г. Шеєле.
3. Обчисліть і позначте, у скільки разів кисень важчий за азот:
А. 1,24. Б. 1,5. В. 1,14. Г. 1,6.
4. позначте суму коефіцієнтів у реакції розкладу аргентум нітрату, схема якої AgNO3 → Ag + NO2 + O2:
А. 10. Б. 9. В. 6. Г. 7.
5. Позначте схему реакції добування кисню:
А. NaNO3 →NaNO2 + O2; B. SO2 +O2 → SO3;
Б. Na + CI2 → NaCI; Г. CaCO3 → CaO + CO2;
6.Установіть відповідність між продуктами реакції та їх коефіцієнтами й укажіть суму коефіцієнтів у реакції, схема якої NO2 →NO + O2 :
А. NO. 1. 3.
Б. O2. 2. 1.
3. 2.
4.4.
ІІ варіант.
1.Позначте відносну молекулярну масу кисню:
А. 32. Б. 8 . В. 16. Г. 18.
2.Позначте об’ємну частку кисню у повітрі:
А. 78 %. Б. 1 %. В. 21% . Г. 15 %.
3. Обчисліть і позначте, у скільки разів кисень важчий за гелій:
А. 16 . Б. 12. В. 6. Г. 8.
4. Позначте суму коефіцієнтів у реакції розкладу гідроген пероксиду, схема якої : 2Н202 →2Н20 + 02↑;
А. 5. Б. 9. В. 7. Г. 8.
5. Позначте схему реакції розкладу:
А.Zn + H2SO4 →Zn SO4 + H2; B. S +O2 → SO2;
Б. Ag2O → Ag + O2; Г. CaCO3 + HCI → CaCI2 + H2CO3;
6.Установіть відповідність між продуктами реакції та їх коефіцієнтами й укажіть суму коефіцієнтів у реакції, схема якої KCIO3 → KCI + O2 :
А. KCI . 1. 1.
Б. O2. 2. 2.
3. 4.
4.3.
ІІ. Етап цілепокладання.
Повідомлення теми та мети уроку.
Мета нашого уроку – розглянути взаємодію кисню з простими речовинами: металами і неметалами.
Обговорення завдань уроку.
Створення асоціативного куща.
Учитель. Учні, спробуйте спрогнозувати, якою буде тема нашого уроку? (Відповіді учнів)
Давайте разом визначимо завдання сьогоднішнього уроку:
- розглянути взаємодію кисню з простими речовинами ;
- розглянути взаємодію кисню з складними речовинами;
- дізнатися про склад оксидів;
- навчитися виділяти реакції сполучення серед інших реакцій;
IІІ. Етап моделювання.
Казка – загадка «Невидимка»
Жило собі якось залізо і не мало воно свого дому. Одного разу на прогулянці знайшло воно дерев’яну хатинку. Залізо спитало: «А хто в хатинці живе?», але ніхто не відповів… Тоді Залізо зайшло в хатинку й побачило, що хатинка затишна, але порожня. Посередині стояв стіл з трьома стільцями, а по кутках стояли три ліжка. І Залізо вирішило, що буде тут жити. Одного разу хатинку побачила красуня Мідь. Мідь теж запитала: «А хто в хатинці живе?» Залізо відповіло: «Це я Залізо! А ти хто?». Вона й говорить: «А я Мідь!». Залізо було дуже чемне і запросило Мідь до себе: «То заходь, разом жити буде веселіше!» І ось стали вони жити разом … Згодом прийшов до хатинки Вуглець і питає: «А хто в хатинці живе?». Мешканці весело відповіли: «Я – Залізо, я - Мідь! А ти хто?» «А я Вуглець!». Запросили друзі і вуглець жити разом, жили весело і дружно!
Аж ось одного дня постукала до них Невидимка, без кольору і запаху, попросився переночувати. Вони впустили і його. Тут між ними зав’язалася суперечка: хто головніший і сильніший у їхній компанії? Почали вони мірятися силою… не встигло розжарене суперечкою залізо підійти до невидимки, як увесь дім засяяв численними іскрами й окалина впала на підлогу хатини. Підійшов і Вуглець до невидимки, щоб помірятися силою, але вмить перетворився на дим. Красуня мідь дуже злякалася, бо була дуже обережною, але її краса зникла поряд з невидимкою – яскраві руді коси стали чорними і негарними … А переможець заспівав : «Я у світі – найсильніший, наймудріший, найгарніший. Мною дихають, без мене не горять, бо окиснюю я всіх підряд!»
Запитання до класу:
- Хто був Невидимкою?
- На які речовини перетворилися Залізо, Мідь і Вуглець?
- Як на вашу думку це сталося?
На ці питання ми будемо шукати відповідь на сьогоднішньому уроці.
Складання плану роботи на уроці.
ІV. Етап організації виконання запланованої діяльності.
1.Взаємодія кисню з простими речовинами
Розповідь вчителя.
Кисень є однією з найактивніших речовин. Кисень – проста речовина, що підтримує горіння. З уроків природознавства ви знаєте, що кисень підтримує горіння й дихання. У чистому кисні речовини горять краще. Досить тієї кількості кисню, що є в повітрі, щоб згорали дрова, кам’яне вугілля, торф. У чистому кисні речовини горять краще А зараз ми розглянемо процес взаємодії кисню з деякими простими речовинами:
1) взаємодія з неметалами.
а) взаємодія з вуглецем
Демонстрація: у ложку для спалювання речовин кладемо вугілля і вносимо його у полум’я спиртівки. Що спостерігаємо?
Вугілля розігрівається, але не загоряється. Це свідчить про
те, що кисень, який є у повітрі з вугіллям взаємодіє повільно.
А зараз внесемо ложку з вугіллям у склянку з чистим киснем. Вугілля швидко згоряє. Висновок: В результаті реакції утворюється вуглекислий газ. А переконатися в цьому можна за допомогою тліючої скіпки – вона тухне. Чому скіпка затухла? ( відповіді учнів)
С +О2 =СО2 – карбон (IV) оксид
Перевірити наявність карбон (IV) оксиду можна за допомогою вапняної води. У цю ж банку вливаємо вапняної води. Що спостерігаємо?
![]() Са(ОН)2 + СО2 = СаСО3 + Н2О
Са(ОН)2 + СО2 = СаСО3 + Н2О
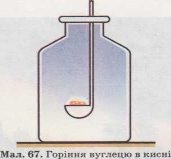
б) взаємодія з сіркою ( у витяжній шафі )
Демонстрація: У ложку для спалювання кладемо кусочок сірки і спалюємо на повітрі та у чистому кисні. У першому випадку процес проходить повільніше. У результаті реакції спостерігаємо синє полум’я.
S+ O2= SO2 – сульфур (IV) оксид

в) взаємодія з воднем
2Н2 + О2 =2 Н2О – гідроген оксид або вода
Висновок. Неметали взаємодіють з киснем. Сполуки, що при цьому утворюються називаються оксидами неметалів.
2. Взаємодія з металами.
г) взаємодія з магнієм
Демонстрація: Магнієву стрічку закріплюємо у щипцях і вносимо у полум’я.
Що спостерігаємо? ( відповіді учнів)
2Мg +O2= 2MgO – магній оксид
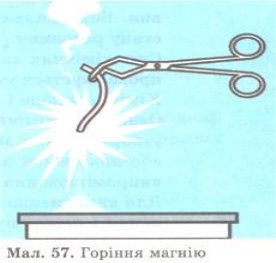
д) взаємодія з залізом
Пропоную переглянути відедослід «Горіння заліза в кисні».
Ваше завдання:
- зробити висновок про взаємодію заліза з киснем;
- скласти рівняння реакції, враховуючи валентність Феруму (II), (III).
Висновок: Залізна стрічка яскраво горить у посудині з чистим киснем розкидаючи яскраві іскри. Але на повітрі залізо не горить.
2Fe + O2=2FeO
4Fe +3O2=2Fe2O3
Отже, 3 Fe +2O2= Fe3O4

Реакцію горіння заліза можна спостерігати на будівництві під час різання та зварювання металів

е) взаємодія з міддю Демонстрація: Мідний дріт на повітрі майже не горить, але коли ми його внесемо у посудину з чистим киснем, реакція відбувається і спостерігаємо процес горіння.
2Cu+ O2=2CuO - купрум (II) оксид
Подивіться уважно на записані рівняння хімічних реакцій і скажіть, що у них є спільного? (відповіді учнів
Висновок. Метали, як і неметали, взаємодіють з киснем. При взаємодії простих речовин з киснем утворюються бінарні сполуки – оксиди.
Оксиди-це складні речовини до складу яких входить два елементи, один з яких – Оксиген з валентністю
II. А ще, всі хімічні реакції належать до одного типу – реакції сполучення.
Реакції сполучення – це реакції між двома простими речовинами, в результаті яких утворюється одна нова складна речовина.
V. Контрольно-оцінювальний етап.
1. Із наведених формул випишіть оксиди: HCl, NaOH, K2O, SO2, CaO, HI, P2O3, ZnS. Дайте назву кожному оксиду.2. Розставте коефіцієнти в схемах реакцій та вкажіть реакції сполучення:
Са + O2 = СаO; K + O2 = K2O; KClO3 = KCl + O2; P2O5 + H2O = H3PO4
3. Допишіть рівняння реакцій Zn + O2 = Fe + O2 = Na + O2 =
Оцінювання учнів.
Бесіда.
- Що таке оксид?
- Які реакції ми називаємо реакціями сполучення?
- Які хімічні властивості характерні для кисню?
Домашнє завдання Опрацювати параграф18, відповісти на запитання. Виконати вправи 3-7 ст 135. Творче завдання: Підібрати поетичні рядки, в яких іде мова про вогонь та горіння.
Урок № 10.
Тема уроку: Хімічні властивості кисню: взаємодія кисню зі складними речовинами (повне окиснення метану, гідроген сульфіду, глюкози).
Мета уроку:
дидактична – закріпити та поглибити знання учнів про хімічні властивостями кисню – взаємодією зі складними речовинами; перевірити вміння складати рівняння хімічних реакцій, аналізувати свої відповіді.
розвивальна - розвивати пам’ять, логічне мислення, вміння нестандартно мислити, використовувати теоретичні знання на практиці, вміння робити висновки.
виховна - виховувати уважність та спостережливість.
Обладнання та реактиви: набір реактивів, спиртівка, хімічний посуд, чашка Петрі, свічка, етанол, вапняна вода.
Базові поняття та терміни: кисень, оксиди, метан, глюкоза, гідроген сульфід.
Тип уроку: поглиблення знань.
План – схема уроку
|
Етап уроку |
Час (хв) |
Форми і методи діяльності вчителя |
Результат |
|
І.Етап орієнтації про місце уроку в темі.
|
5 |
Представлення девізу уроку. Обговорення відомого вислову. Інтерактивна вправа «Скринька знань». |
Розвиток пізнавального інтересу учнів. Актуалізація знань, встановлення зв’язку теоретичних знань з практикою |
|
ІІ.Етап цілепокладання.
|
3 |
Групова робота над диференційованими завданнями. Інтерактивні вправи: «Знайди мене», «Коректор», «У кожного своє місце». Представлення результату роботи. |
Закріплення вивченого матеріалу під час роботи в групі. Закріплення вміння робити висновки і порівняння. |
|
ІІІ.Етап моделювання.
|
6 |
Елементи проблемного навчання.
|
Розвиток логіки, налаштування на сприйняття теми. |
|
ІV.Етап організації виконання запланованої діяльності.
|
25 |
Розповідь вчителя. Демонстрація дослідів. Складання опорних схем. |
Засвоєння нового матеріалу |
|
V.Контрольно-оцінювальний етап.
|
6 |
Виконання завдань практичного спрямування. Зв'язок епіграфа з вивченим матеріалом.
|
Закріплення знань, підбиття підсумків уроку. |
Хід уроку.
І. Етап орієнтації про місце уроку в темі.
Девіз уроку
Скажи мені – і я забуду,
Покажи мені – і я запам’ятаю,
Дай мені зробити – і я зрозумію.
Конфуцій.
Учні висловлюють свої думки стосовно девізу уроку.
Вправа «Скринька знань»
Для актуалізації опорних знань учнів пропоную написати на аркуші одну з хімічних властивостей кисню, умови перебігу реакції тощо. Учні по черзі оголошують записані нотатки й опускають у скриньку, уникаючи повторів. Якщо в учнів виникають труднощі, можна ставити додаткові питання, наприклад:
- Які речовини називають простими?
- З якими з простих речовин реагує кисень?
- Які реакції називають реакціями сполучення?
- Який метал найактивніше реагує з киснем?
- Які особливості взаємодії заліза з киснем?
ІІ. Етап цілепокладання.
Біля входу в клас учні вибирали жетон певного кольору, пропоную учням відповідно утворити три групи. У кожної групи є своє робоче місце з певним завданням.
1.Завдання для груп.
І група.
Вправа «Знайди мене»
- Серед запропонованих формул випишіть формули оксидів та дайте їм назви.
|
HgS |
CaO |
N2O5 |
SO3 |
|
CuO |
MgO |
FeS |
PH3 |
|
H2S |
N2 |
NaOH |
H2O |
- Обчисліть масову частку Оксигену в нітроген ( ІV) оксиді.
ІІ група.
Вправа «Коректор»
- Допишіть рівняння хімічних реакцій. Вкажіть тип.
Н2 +О2 =
Zn + O2=
Ca + O2=
KClO3 =
- Обчисліть масову частку Оксигену в магній оксиді.
ІІІ група.
- Вправа «У кожного своє місце»
Заповніть схему, використовуючи знання про хімічні властивості кисню.

![]()
![]()


![]()
![]()
![]()



- Доберіть коефіцієнти.
- Li + O2 = Li2O;
б) PH3 + O2 = P2O5 + H2O;
в) P + O2 = P2O5;
Кожна група представляє свою роботу, відповідає на питання інших груп.
Підсумовування роботи груп та оцінювання учнів.
ІІІ. Етап моделювання.
Сьогодні ми продовжимо вивчення хімічних властивостей кисню. На минулому уроці ви дізналися, що кисень активно взаємодіє з простими речовинами: металами і неметалами. Продуктами цієї взаємодії є оксиди.
Проте кисень може реагувати не тільки з простими речовинами. Пропоную розглянути схему, над якою працювала третя група.
- Чи вдалося вам заповнити праву частину схеми?
- Чому? (Відповіді учнів)
Кисень належить до активних речовин тому легко вступає у взаємодію з багатьма складними речовинами.
Проблемні питання.
- Як відбувається горіння складних речовин?
- Що є продуктами взаємодії кисню й складних речовин?
На сьогоднішньому уроці ми знайдемо відповіді на ці питання і поглибимо свої знання про хімічні властивості кисню, а саме взаємодію з складними речовинами.
Повідомлення теми і мети уроку.
Учні записують схему в робочий зошит та поступово заповнюють її в ході уроку.
ІV. Етап організації виконання запланованої діяльності.
Розповідь вчителя з елементами бесіди .
На попередніх уроках ви ознайомились з горінням сірки, магнію, заліза, вугілля в кисні. Створення проблемної ситуації.
- Чи реагує кисень з складними речовинами?
Розв’язання проблеми.
Експеримент.
Запалюємо газовий пальник. Природний газ горить синюватим полум’ям. Дослідимо продукти реакції:
а) над горючим газом потримаємо холодний предмет ( скляну пластинку). Пластинка вкривається краплинами води, отже , виділяється водяна пара;
б) змочимо чисту пробірку вапняною водою й потримаємо над горючим газом. Стінки пробірки мутніють. Це доказ утворення карбон ( ІV) оксиду.
Учні самостійно роблять висновки про продукти реакції горіння метану, з допомогою вчителя записують рівняння реакції:
СН4 + 2О2= СО2 + 2Н2О
- Що ж сталося з кожним елементом, що входив до складу метану?
Відповіді учнів: внаслідок реакції кожен елемент сполучився з киснем і утворив два оксиди.
Висновок: Отже, можна зробити висновок, що при горінні складних речовин утворюються оксиди тих елементів, які входили до складної речовини.

Так само згорятимуть у кисні й інші складні речовини, наприклад сірководень – газ із запахом тухлих яєць: 2Н2S + 3O2= 2SO2 + 2H2O Цікавим є процес горіння глюкози, яка входить до складу цукру. З повсякденного досвіду ми знаємо, що глюкоза не горить. Проте, якщо на зразок нанести каталізатор, то реакція відбувається дуже швидко:
С6Н12О6+ 9О2 = 6СО2+ 6Н2О
V. Контрольно-оцінювальний етап.
Фронтальне виконання завдань 1.Складіть реакцію горіння пропану С3Н8. Назвіть оксиди, що утворилися.
2. Дописати рівняння хімічних реакцій: ZnS +O2= C2H2 +O2= C12H22O11 + O2= 3. Здійснити перетворення: Н2S→H2O→O2→Al2O3
- Визначення найактивнішого учня.
- Оцінювання учнів.
- Пригадайте епіграф уроку. Як він пов'язаний з темою та вивченим матеріалом?
Домашнє завдання Опрацювати параграф, відповісти на запитання, виконати письмові вправи 4-8 ст 143.
Урок № 11.
Тема уроку: Окиснення. Горіння. Умови виникнення і припинення горіння. Маркування небезпечних речовин.
Мета уроку:
дидактична - дати поняття про процеси окиснення та горіння, порівняти процеси горіння, повільного окиснення, дихання, розширити уявлення про оксиди як продукти горіння, пояснити умови виникнення та припинення горіння, поглибити знання про склад складних речовин на прикладі оксидів;
розвивальна - розвивати вміння складати рівняння хімічних реакцій, аналізувати умови процесів горіння та повільного окиснення; розвивати логічне мислення, пізнавальний інтерес;
виховна – виховувати самостійність, прагнення досліджувати навколишній світ. Обладнання та реактиви: періодична система хімічних елементів. Базові поняття та терміни: кисень, оксиди, окиснення, горіння, повільне окиснення, дихання, вибух.
Тип уроку: вивчення нового матеріалу.
Форма уроку: урок-дослідження.
План – схема уроку
|
Етап уроку |
Час (хв) |
Форми і методи діяльності вчителя |
Результат |
|
І.Етап орієнтації про місце уроку в темі.
|
7 |
Використання віршованих рядків, представлення девізу уроку. Фронтальна робота у вигляді бліцопитування. |
Перевірка знань учнів засвоєних на попередніх уроках. |
|
ІІ.Етап цілепокладання.
|
5 |
Інтерактивний прийом «Дивуй» Постановка проблемного питання. |
Розвиток в учнів пізнавального інтересу. |
|
ІІІ.Етап моделювання.
|
5 |
Інтерактивна вправа «Два-чотири-всі разом»
|
Розвиток навичок роботи в малих і великих групах. |
|
ІV.Етап організації виконання запланованої діяльності.
|
22 |
Розповідь-пояснення вчителя. Робота з підручником. Демонстрація дослідів. Складання опорних схем. Спостереження за дослідами. Запис спостережень у зошит у вигляді висновку. Рольова гра «Пожежник». Робота з таблицями. Евристична бесіда. |
Отримання з тексту та ілюстрацій нових знань. Засвоєння нового матеріалу на основі власних спостережень. |
|
V.Контрольно-оцінювальний етап.
|
6 |
Виконання завдань практичного спрямування. Вправа «Знайди відповідність». Зв'язок епіграфа з вивченим матеріалом.
|
Закріплення вивченого. Підбиття підсумків. |
Хід уроку
І. Етап орієнтації про місце уроку в темі.
Емоційне налаштування учнів на урок
Учитель. Наша радість і щастя складаються з маленьких успіхів, перемог або просто усмішок, які дарують нам люди. Я бажаю вам попрацювати на уроці так, щоб наприкінці, прислухавшись до стану своєї душі ви відчули її спів.
Девізом сьогоднішнього уроку я обрала слова В. Розова.
Знання можуть бути купою каміння,
що задавило особистість.
І знання можуть бути вершиною
піраміди, на якій стоїть особистість.
Наприкінці уроку зробимо висновок: чи дійсно знання можуть мати значення для кожного з нас.
Фронтальна робота.
Бліцопитування.
На слайдах учні бачать запитання на яке вони швидко мають дати відповідь. Працюють ланцюжком.
- З яких речовин можна добути кисень у лабораторії?
- Як називаються реакції, за допомогою яких можна добути кисень?
- Якими двома способами можна зібрати кисень?
- Які фізичні властивості кисню ми при цьому враховуємо?
- Як довести наявність кисню в посудині?
- Охарактеризуйте хімічні властивості кисню.
- Порівняйте інтенсивність процесів горіння речовин у кисні і на повітрі.
- Яка реакція називається реакцією сполучення?
- Що таке реакція розкладу?
- Що таке оксид?
ІІ. Етап цілепокладання.
Інтерактивний прийом «Дивуй»
На вчительському столі знаходиться чорна скринька. Вчитель по черзі виймає з скриньки предмети: зошит, ржавий цвях, тирсу, свічку, сірники, хом’яка.
Проблемне питання:
- Що спільного в усіх цих предметів?
- Яке відношення вони мають до нашого сьогоднішнього уроку?
Вчитель. На ці питання ми знайдемо відповіді сьогодні на уроці.
Оголошення теми, обговорення завдань уроку.
ІІІ. Етап моделювання.
Інтерактивна вправа «Два-чотири-всі разом»
- Обговоріть з товаришем по парті тему уроку, на аркуші запишіть інформацію, яку ви знаєте з курсу природознавства про горінні і окиснення речовин.
- Запишіть питання, які хочете розглянути на уроці.
- Об’єднайтеся в четвірки, обговоріть матеріал яким володіє ваша четрівка.
- На дошці всі разом записуємо план очікуваної роботи.
ІV. Етап організації виконання запланованої діяльності.
- Поняття про горіння, повільне окиснення, вибух.
Пояснення вчителя Давайте з вами з’ясуємо, які реакції називають окисненням. Всі хімічні реакції під час яких вихідною речовиною є кисень називають окисненням.
Розглянемо приклади таких реакцій: 2Pb + O2 = 2PbO; 2ZnS +3O2= 2ZnO +2SO2.
 Є декілька видів реакцій окиснення, а саме:
Є декілька видів реакцій окиснення, а саме:


-
Вчитель. Розглянемо реакцію горіння.
У житті ми дуже часто зустрічаємося з горінням. Наведіть приклади горіння речовин. (відповіді учнів).
- Перед вами зошит. Скажіть, з чого він виготовлений? ( з паперу).
- А чи горить папір? (так).
- Чому зошит не горить у нас в руках? (Відповіді учнів).
- Які предмети з чорної скриньки ми можемо використати для горіння? ( зошит, свічка, сірники).
Робота з підручником ст. 136.
Демонстрація горіння свічки та паперу.
Запитання до учнів:
- Які ознаки супроводжували горіння цих речовин?
- Який компонент повітря підтримує реакцію горіння?
Разом з учнями формулюємо висновок та записуємо його у зошит.
Висновок: Горіння – це реакція окиснення, що супроводжується виділенням тепла і світла.

Основні ознаки горіння:
- відбувається швидко;
- виділяється велика кількість тепла;
- супроводжується полум’ям;
- виділяється світло;
Вчитель. А тепер з’ясуємо, що таке повільне окиснення. Взаємодія речовин з киснем може відбуватися повільно, без помітного виділення тепла. В даному випадку горіння не спостерігається. Такі процеси називають повільним окисненням. Наприклад, залізо при зберіганні на повітрі повільно перетворюється на рудий порошок іржі.

Прикладами повільного окиснення речовин у природі є гниття та пріння. Так якщо сіно не достатньо висохло, то у свіжій копиці ми можемо відчути запах і тепло, що виділяються під час пріння вологої трави.
Робота з підручником ст. 138.
Вчитель. Запишіть ознаки повільного окиснення.
- відбувається повільно; - теплота виділяється поступово; - не супроводжується полум’ям;
Вчитель. Різновидом повільного окиснення є дихання.
Дихання - сукупність процесів, які забезпечують потрапляння в організм кисню і виділення з нього вуглекислого газу і використання кисню клітками і тканинами для окиснення органічних речовин із звільненням енергії, що міститься в них, необхідної для життєдіяльності.
Вчитель. Які предмети з чорної скриньки можуть піддатися повільному окисненню? (відповіді учнів).
Вчитель. З’ясуємо, що таке вибух?
За деяких умов горіння може відбуватися так швидко, що речовина вибухає. Це відбувається, якщо речовина дуже подрібнена. Вибухати можуть суміші кисню з деякими газами.

Учні переглядають відео вибуху.
Завдання: записати у зошит ознаки вибуху.
Ознаки вибуху:
- відбувається дуже швидко;
- - енергія, що виділяється, призводить до руйнівних наслідків;
- - супроводжується вибуховою хвилею;
Вчитель. Діти, у нашій скриньці знаходилися на перший погляд різні предмети. Тому зробіть висновок, що їх об’єднує. (відповіді учнів)
Висновок. Всі ці предмети об’єднує те, що вони беруть участь в процесі окиснення, вихідною речовиною для кожного має бути кисень, кінцевими продуктами є оксиди
- Умови виникнення і припинення горіння.
Евристична бесіда.
Вчитель. Розглянемо від чого залежить перебіг реакції горіння.
Створення проблемної ситуації ( демонстрація).
У відкриту посудину поміщаємо свічку. Підпалюємо її, свічка горить деякий час. Закриваємо посудину. Свічка гасне.
- Чому свічка в закритій посудині гасне?
Відповіді учнів. Проста речовина кисень підтримує горіння. Кисню, що міститься у повітрі, досить для горіння дров у багатті, природного газу у плиті, вугілля у каміні.
- Яка умова необхідна для підтримання горіння? (відповіді учнів)
Вчитель. Так, доступ повітря, до складу якого входить кисень. Та це лише одна з умов. Подумайте, що ще необхідно для реакції горіння?
- От у нас є свічка, що потрібно зробити щоб вона загорілася Висновок. Так, дійсно, щоб загорілася свічка її необхідно підігріти до певної температури, яку називають температурою займання. Для кожної речовини існує своя температура.
Завдання. Опрацюйте матеріал підручника на ст. 140 та заповніть таблицю.
Складання та заповнення таблиці
|
Речовина |
Температура займання |
|
деревина |
2700С |
|
вуглець |
3500С |
|
папір |
2300С |
|
бензин |
3000С |
Отже, умовами виникнення горіння є:
- наявність горючої речовини;
- доступ кисню;
- досягнення температури займання;
Вчитель. Першу хімічну реакцію людина провела тоді, коли навчилась добувати вогонь. З того часу і до наших днів реакції горіння відіграють важливу роль в нашому житті. Вони приносять у будинки тепло, рухають автомобілі і ракети. Горіння приносить людині не лише користь, а й шкоду, і прикладів чимало. Ось чому важливо знати не тільки, що таке реакція горіння, а й як цим процесом керувати, що потрібно знати, щоб запобігти пожежі.
- Що потрібно зробити щоб припинити горіння? (відповіді учнів).
Рольова гра «Пожежник»
Тут чути стук у двері. Заходять двоє учнів старших класів переодягнені у пожежників.
1-й учень.
Ми дізналися, що ви сьогодні на уроці вивчили які умови необхідні для виникнення горіння.
2-й учень. Та чи знаєте ви як припинити горіння? Для цього потрібно перекрити доступ кисню та знизити температуру займання.
1-й учень.
Часто для гасіння вогню використовують воду. Але є речовини, які не можна гасити водою, такі як бензин чи газ. Ці речовини легші за воду, тому спливають на поверхню і продовжують горіти.
2-й учень.
Найефективніший спосіб гасіння полум’я – це запобігання доступу повітря за допомогою піску, піни, вогнегасників чи азбестових тканин.
Учні демонструють вуглекислотний та пінний вогнегасник та пояснюють принцип їх дії.
- Маркування небезпечних речовин.
- Розповідь вчителя з демонстрацією.
В наш час існує безліч речовин, серед них є небезпечні. Тому всі речовини маркують. Виділяють різні системи маркування речовин та препаратів. Маркування хімічних речовин створено на основі класифікації, в якій враховують такі критерії як токсичність, хімічні та фізичні властивості, канцерогенний ефект. Кожна група речовин має власне позначення – знак.
Обговорення таблиці
|
Небезпечні речовини |
Знак маркування |
|
Легкозаймисті речовини |
F |
|
Окисники |
О |
|
Надзвичайно займисті речовини |
F+ |
|
Отруйні речовини |
Т |
|
Речовини, які вибухають під дією полум’я |
Е |
|
Шкідливі для здоров’я |
Xn |
|
Подразнюючі речовини |
Xi |
|
Їдкі речовини |
С |
|
Дуже отруйні речовини |
Т+ |
При маркуванні небезпечних речовин потрібно державною мовою зазначати наступну інформацію: назву торгової марки, адресу, номер телефона виробника, назву хімічної речовини, знаки небезпеки, інструкцію щодо використання.
V. Контрольно-оцінювальний етап.
Вправа «Знайдіть відповідність»
У першій колонці таблиці – назва речовини, у другій – властивості. Знайти відповідність між назвою речовини та її властивостями.
|
Бензин |
Гасить вогонь |
|
Ганчір’я |
Вибухає |
|
Мармур |
Підтримує горіння |
|
Пісок |
Плавиться |
|
Парафін |
Горить |
|
Дерево |
Жевріє |
|
Порох |
Жовтіє |
|
Кисень |
Вибухає |
Оцінювання учнів.
Обговорення девізу уроку.
Учні по черзі відповідають на питання:
- Чи дійсно знання можуть мати значення для кожного з нас?
Домашнє завдання
Опрацювати параграф 19, відповісти на запитання, підготувати повідомлення «Проблема чистого повітря».
Підготувати навчальні проекти:
№6. «Проблема забруднення повітря та шляхи її розв’язання.»
№7. «Дослідження зміни концентрації вуглекислого газу у класній кімнаті під час занять.»
Урок № 12.
Тема уроку: Колообіг Оксигену в природі. Озон. Проблема чистого повітря.
Мета уроку:
дидактична - розширити і поглибити знання учнів про Оксиген як хімічний елемент та кисень як просту речовину; розглянути колообіг Оксисену в природі; з'ясувати основні галузі, що використовують кисень;
розвивальна - сприяти розвитку в учнів екологічної культури;
виховна - виховувати дбайливе ставлення до свого здоров’я, до навколишнього середовища.
Обладнання та реактиви: періодична система хімічних елементів Д.І.Менделєєва, таблиця „Колообіг Оксигену у природі”, слайди „Застосування кисню”.
Базові поняття та терміни: Оксиген, кисень, колообіг Оксисену
Тип уроку: комбінований.
Форма уроку: інтегрований урок з хімії та географії.
План – схема уроку
|
Етап уроку |
Час (хв) |
Форми і методи діяльності вчителя |
Результат |
|
І.Етап орієнтації про місце уроку в темі.
|
7 |
Використання віршованих рядків. Фронтальна робота. Робота в групах. Використання інтерактивних вправ «Лови помилку», «Третій зайвий», «У кожного своє місце»
|
Конкретизація і закріплення вже набутих знань. Формування навичок роботи в групі. |
|
ІІ.Етап цілепокладання.
|
5 |
Використання віршованих рядків. Постановка проблемного питання |
Налаштування на сприйняття теми. |
|
ІІІ.Етап моделювання.
|
5 |
Активне стимулювання учнів до самостійного навчання. |
Формування завдань уроку виходячи з теми. |
|
ІV.Етап організації виконання запланованої діяльності.
|
22 |
Розповідь-пояснення вчителя. Самостійна робота з підручником. Робота з таблицею. Евристична бесіда. Інтерактивні вправи «Кубування», «Коло ідей». Індивідуальна робота та повідомлення учнів.
|
Засвоєння нового матеріалу. Розвиток логічного мислення і пізнавального інтересу |
|
V.Контрольно-оцінювальний етап.
|
6 |
Вправа «Закодоване слово», «Займи позицію»
|
Розвиток уміння застосовувати здобуті знання на практиці, робити висновки. |
Хід уроку
І. Етап орієнтації про місце уроку в темі.
Створення позитивного настрою.
Вчитель географії.
У світі змін відбувається багато,
От і ви підросли,
Ще вчора географію,
Для себе відкривали,
А сьогодні хімію почали вивчати,
Знання нові здобувати.
Вчитель хімії.
Давайте сьогодні на уроці,
Разом працювати, нове відкривати.
Тому прошу вас не галасувати,
А уважно за всім спостерігати.
І на уроці враз
Ви покажете знання на … «супер клас!».
- Робота в групах.
Учні кожної групи отримують завдання. Після виконання, вони заносять правильну відповідь у комп’ютер. Усі результати демонструються на екрані.
Завдання.
1 група.
Вправа «Третій зайвий»
У кожному рядку знайти зайву речовину й пояснити, чому вона є зайвою.
А) бензин, дерево, пісок.
Б) сніг, вода, ганчір’я.
В) тирса, сіно, мармур.
2 група.
Вправа «У кожного своє місце»
А) H2O, CuO, H2SO4.
Б) NO, HNO3, N2O5.
В) WO3, SO3, NaCI
3 група
Вправа «Встановіть відповідність»
|
Напівсхема реакції |
Продукт реакції |
|
А)Н2О |
|
Б)Fe3O4 |
|
В)СаО |
|
|
Г)Н2О2 |
- Фронтальна робота.
Гра «Лови помилку»
Вчителі по черзі зачитують твердження. Учні мають погодитися з ним, чи навпаки, не погодитися, але відповідь обґрунтувати.
- Горіння – це реакція окиснення, що відбувається з виділенням тепла і світла.
- Щоб почалося горіння, не обов’язкова наявність кисню.
- Досягнувши температури займання речовини, можна розпочати горіння.
- За допомогою води можна погасити всі горючі речовини.
- Повільне окиснення – це реакція окиснення, що відбувається з виділенням тепла і світла.
- Наявність кисню визначають за помутнінням вапняної води.
- Чи правий був Лавуазьє, стверджуючи, що «Життя – це горіння»?.
- Кисень зберігають у сталевих балонах червоного кольору.
- Пріння та гниття – приклади повільного окиснення речовин у природі.
- Горіння, повільне окиснення та вибух приклади реакції окиснення.
Оцінювання учнів, підведення підсумків роботи.
ІІ. Етап цілепокладання..
Вчитель хімії.
Учні, як ви бачите у нас сьогодні незвичайний урок, адже на ньому присутній вчитель географії. Ми будемо працювати разом, щоб поповнити свої знання вдвічі.
Вчитель географії. Пропоную вам послухати віршовані рядки.
Ти спрагою не мучився, голодним ти не був,
Те все, що так турбує, від чотирьох здобув.
І кожному повернеш його ти подарунок,
І знову станеш тим, чим на початку був.
Омар Хайям,
Поет ІX ст.
- Як ви розумієте фразу «від чотирьох здобув»? ( відповіді учнів).
Вчитель хімії. «Від чотирьох здобув», - мається на увазі чотири стихії – земля, повітря, вода та вогонь, з яких, як вважали в часи О. Хайяма, складається все довкола.
ІІІ. Етап моделювання.
Вчитель географії.
- Чи узгоджується цей вірш з уявленням про кругообіг речовин у природі? (Відповіді учнів)
- З кругообігом яких речовин ви познайомилися на уроках географії?
Вчитель хімії.
Сьогодні на уроці ми познайомимося з колообігом ще однієї важливої речовини.
- Як ви думаєте про яку речовину йде мова? ( Відповіді учнів)
Тема нашого уроку «Колообіг Оксигену в природі. Озон. Проблема чистого повітря».
Вчитель хімії.
Давайте разом поміркуємо над завданнями, які ми поставимо до нашого уроку (разом з учнями складаємо завдання уроку, виходячи з теми)
Завдання уроку:
- вивчити поширення Оксигену в природі;
- з'ясувати особливості колообігу Оксигену;
- показати роль кисню в життєдіяльності організмів;
- оцінити роль озону в атмосфері;
ІV. Етап організації виконання запланованої діяльності.
Сприйняття інформації.
- Поняття про колообіг хімічних елементів.

Вчитель географії.
Майже всі речовини у природі здійснюють колообіг. На уроках географії ми познайомилися з колообігом води в природі.
Пригадайте:
- Як здійснюється колообіг води?
Відповіді учнів.(Вода випаровується з океанів, морів і річок, формує хмари, а потім, випадаючи на землю у вигляді дощу, з водою річок знову потрапляє у Світовий океан. )
- Пропоную вам переглянути відео «Колообіг води у природі» і пригадати як відбувається цей процес.
Учні переглядають відео та обговорють його.
Вчитель хімії.
Так само можуть здійснювати колообіг окремі хімчні елементи і атоми хімічних елементів. Тільки атоми, завдяки хімічним процесам у живій і неживій природі, поступово переходять з молекул одних речовин у інші. Вперше вчення про колообіг атомів елементів у природі створив видатний український вчений В.І. Вернадський.
Демонструємо портрет В.І. Вернадського.
Самостійна робота з підручником ст. 146. «Короткі відомості з життя вченого».
2. Поширеність Оксигену.
Вчитель географії.
Масова частка Оксигену у оболонках Землі (атмосфера, гідросфера, літосфера) складає 52% . (Розгляд діаграми). Масова частка у повітрі - 25% (об'ємна - 21%)
В земній корі - 47% (за масою)
В гідросфері - 85,6%.
Оксиген входить до складу вулканічних вивержень, кристаликів льоду, морської солі, сажі.
3.Колообіг Оксигену в природі.
Проблемне питання.
Вміст кисню в атмосфері впродовж мільйонів років істотно не змінюється, незважаючи на велике споживання. Чим це пояснити?
Вчитель хімії. Відповідь на це запитання ми знайдемо коли з’ясуємо особливості колообігу Оксигену у природі.
Робота з підручником за схемою
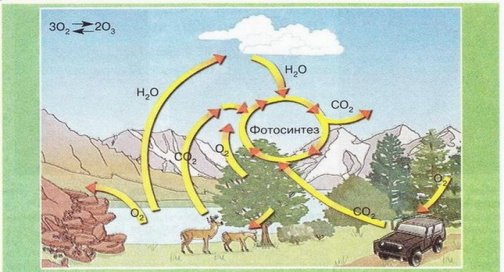
Вчитель хімії.
Головною речовиною в колообігу Оксигену є кисень, адже він є однією з найважливіших речовин на землі, що забезпечує можливість існування життя.
Евристична бесіда.
- Чому ж кисень такий необхідний для живих організмів?
- Як утворюється кисень у природі?
- На які процеси витрачається кисень?
- До складу яких складних речовин входить кисень?
Робота в парах.
Завдання.
- Виділіть основні ланки колообігу Оксигену.
Вчитель хімії.
На основі отриманої інформації давайте сформулюємо висновок. (Учні з допомогою вчителя формулюють висновок)
- Витрачання, або зв’язування, кисню ( процеси дихання, згорання палива і пального, окиснення різних речовин у природі, в технологічних процесах);
- Взаємоперетворення оксигеновмісних сполук;
- Утворення кисню (процес фотосинтезу на поверхні Землі і водоростей у Світовому океані, розклад води у верхніх шарах атмосфери);
Цікавинки від вчителя географії.
Метод «Кубування».
Вчитель передає учням куб на гранях якого записані твердження. Учні зачитують їх та доповнюють власними знаннями. ( На уроці можна використати ресурси Інтернет).
Чи знаєте ви що…
- Без їжі людина може обходитися 5 тижнів, без води 5 днів, без кисню – 3 хв.
- Людина в спокійному стані витрачає для свого життя близько 20 л кисню за годину.
- Середній автомобіль за 100 км пробігу витрачає близько 21 м 3 кисню. Цією кількістю кисню могла б дихати людина протягом півтора місяця.
- Значна кількість кисню витрачається під час виверження вулканів, внаслідок чого виділяється вода і вуглекислий газ.
- Весь кисень повітря через живу речовину проходить приблизно за 2000 років.
4.Озон.
Вчитель географії.
Учні, а зараз ми пригадаємо яку будову має атмосфера. В атмосфері розрізняють окремі шари: тропосферу, стратосферу, верхні шари атмосфери.
Тропосфера – нижній шар атмосфери. Його товщина становить 14 км, тут зосереджена вся водяна пара з якої формуються опади. Стратосфера розміщується над тропосферою до висоти 55 км. Повітря там дуже розріджене і немає водяної пари.
На висоті 20-30 км концентрується озон, утворюючи озоновий шар.
- Що вам відомо про озоновий шар? ( Він затримує ультрафіолетове випромінювання Сонця, шкідливе для всього живого на Землі).
Більш детально про будову молекули озону вам розкаже вчитель хімії.
Вчитель хімії.
- Погляньте на дві формули:
О2 О3
- Що спільного і відмінного у цих формулах? (Відповіді учнів).
Під час грози всі ви відчували характерний запах свіжості. Так пахне озон, що утворюється в атмосфері з кисню при дії електричного розряду.
Оксиген утворює 2 алотропні форми – кисень О2 та озон О3. На відміну від кисню, озон має запах, є отруйним, його температури плавлення та кипіння вищі. Він виявляє більшу хімічну активність ніж кисень, хоча хімічно нестійкий.
Робота над таблицею.
Завдання для І варіанту.
- Заповніть у таблиці першу колонку і запишіть властивості характерні для кисню.
Завдання для ІІ варіанту.
- Заповніть у таблиці другу колонку і запишіть властивості характерні для озону.
|
КИСЕНЬ (О2) |
ОЗОН (О3) |
|
|
|
Представник від кожного варіанту звітує про роботу. Учні що сидять за одною партою обмінюються інформацією.
5.Проблема чистого повітря.
- Виступи учнів з доповідями на теми:
«Речовини, що забруднюють атмосферу Землі»;
«Як вирішити «проблеми» повітря?»;
Учні зачитують повідомлення, що готували заздалегідь.
- Представлення учнівського проекту №6. «Проблема забруднення повітря та шляхи її розв’язання.»
Інтерактивна вправа «Коло ідей».
Кожен учень класу має запропонувати заходи, які дозволять підтримувати необхідний відсотковий вміст кисню у складі повітря. Наприклад:
- Використовувати екологічно чисте паливо (водень, біодизель);
- Використовувати «зелені» технології на підприємствах;
- Використовувати відновлювальні джерела енергії;
V. Контрольно-оцінювальний етап.
Вправа «Закодоване слово».
Прочитайте твердження, із літер, які відповідають правильним відповідям, складіть слово, яке відображає вашу діяльність на уроці.
Відповідь: «Ви – розумнички!»
- Всі елементи і речовини у природі здійснюють колообіг . ( В).
- Вперше вчення про колообіг розробив Лавуазьє. (Ц)
- Під час дихання тварин і рослин виділяється вуглекислий газ і вода. (И)
- Під час окиснення органічних речовин виділяється велика кількість енергії. (Р).
- Для спалювання бензину, гасу та мазуту використовують велику кількість кисню. (О).
- До складу повітря входить два основних гази – кисень і азот. (Ш).
- Атмосфера – повітряна оболонка землі. (З).
- Вміст кисню у атмосфері поповнюється внаслідок фотосинтезу.(У).
- Формула озону – О2. ( С).
- Оксиген утворює 2 алотропні форми – кисень О2 та озон О3. ( М).
- Озон має запах і є отруйним.(Н).
- Фотосинтез відбувається в темряві. (К).
- Масова частка кисню у повітрі - 25% (об'ємна - 21%). (И).
- Молекула озону нестійка, тому швидко розкладається.( Ч).
- Озоновий шар знаходиться на висоті 15 км. (А).
- Найбільше повітря забруднює техногенна діяльність людини. (К).
- Для вирішення проблеми забруднення повітря потрібно використовувати відновлювальні джерела енергії. (И).
Вправа «Займи позицію»
Вчитель хімії. А тепер давайте висловимо думку про те, чи знадобляться вам знання які ви отримали на уроці.
- Як ви вважаєте, чи досягли ми мети уроку?
- Чи корисні вам будуть ці знання у майбутньому?
- Що нового ви дізналися на уроці?
- Чи все вам було зрозуміло?
- Що виявилося складним для розуміння?
- Чи сподобалося вам працювати одночасно з учителем географії і хімії?
Домашнє завдання. Опрацювати матеріал параграфу 20 і 21
Урок – проект № 13
Тема уроку : Застосування кисню та його біологічна роль.
Мета уроку - проекту :
дидактична – розширити знання учнів про застосування кисню, що ґрунтується на його властивостях, показати біологічну роль кисню та його важливість для збереження життя на Землі.
розвивальна – розвивати в учнів пам'ять, логічне мислення, вміння порівнювати, робити висновки, встановлювати міжпредметні зв’язки; формувати вміння систематизувати вивчений матеріал, вибирати головне, оформлювати та заповнювати таблиці, прищеплювати навички роботи з додатковими джерелами інформації; формувати навички дослідницької діяльності на основі групової праці учнів.
виховна – виховувати екологічну культуру, свідомий інтерес до вивчення предмета;
Характеристика проекту:
- за кінцевим результатом – практичний;
- за змістом – монопредметний;
- за кількістю учасників – колективний;
- за тривалістю – короткотривалий;
- за ступенем самостійності – частково – пошуковий;
Учасники проекту: учні 7 класу, вчитель – предметник.
Термін реалізації проекту – 45 хвилин.
Прогнозований результат:
- Формування та розвиток ключових компетентностей учнів, необхідних для соціалізації, творчої самореалізації особистості, розуміння природничо-наукової картини світу, вироблення екологічного стилю мислення і поведінки, виховання громадянина демократичного суспільства;
- Підвищення рівня засвоєння навчального матеріалу з теми «Кисень»;
- Розвиток уміння самостійно здобувати знання та працювати в групі;
- Посилення мотивації до навчально-пізнавальної діяльності;
Обладнання та матеріали: періодична система хімічних елементів, презентації, схеми.
Тип уроку: урок-проект.
План – схема уроку-проекту
|
Етап уроку |
Час (хв) |
Форми і методи діяльності вчителя |
Результат |
|
І.Етап орієнтації про місце уроку в темі.
|
5 |
Використання віршованих рядків. Зачитування загадок. |
Налаштування на сприйняття нового. |
|
ІІ.Етап цілепокладання.
|
5 |
Вправа «Дерево очікувань».
|
Розвиток пізнавального інтересу |
|
ІІІ.Етап моделювання.
|
5 |
Обговорення девізу уроку. Складання плану роботи. |
Стимулювання учнів до самостійного опрацювання навчального матеріалу. |
|
ІV.Етап організації виконання запланованої діяльності.
|
25 |
Постановка проблемного питання. Самостійна дослідницька робота учнів. Індивідуальна та групова робота. Проведення домашнього експерименту. Складання сенканів. |
Уміння критично мислити, виділяти головне, орієнтуватися в навчальному матеріалі. |
|
V.Контрольно-оцінювальний етап.
|
5 |
Вправа «Так. Ні». Розв’язування задач. Обмін враженнями від уроку. |
Розвиток умінні застосовувати здобуті знання на практиці. Самооцінювання учнів. |
Хід уроку
І. Етап орієнтації про місце уроку в темі.
Учениця.
Продзвенів уже дзвінок,
Починається урок.
Він весняний і цікавий,
Тож гостей зібрав чимало.
Повернімося обличчям до гостей
І лагідно промовим: “Добрий день”.
Вчитель: Зайшовши до вас у клас я звернула увагу на ваші очі – дзеркала душ. Вони у вас світяться, ніби питають у мене: “А що далі?”. То ж у мене виникло бажання підійти до кожного з вас і потиснути руку, обійняти і сказати: “Ти такий гарний” або “ У тебе буде все гаразд”. Ви мені у цьому допоможете. Візьміть руку сусіда зліва і потисніть, скажіть сусіду зліва щось приємне.
Вчитель. Діти, сьогодні ми продовжимо знайомство з найбільш розповсюдженим хімічним елементом, який утворює усім відому просту речовину, без якої неможливо уявити існування всього живого на планеті Земля. А назвати цю речовину ви зможете відгадавши загадку:
Я – газ без кольору, без смаку.
Я непомітний в вишині,
Та жити, друзі, неможливо
Без мене людям на Землі,
Я вам будинки обігрію,
В лікарні вилікую вас.
А, реагуючи із воднем,
Воду утворюю для вас.
Якщо колись (не дай-то Боже)
Я зникну раптом на Землі,
Життя зупиниться назавжди,
Я – найцінніший на Землі.
ІІ. Етап цілепокладання.
Вчитель.
-Що це за хімічний елемент і яку просту речовину він утворює?
(Речовина кисень та елемент, що його утворює – Оксиген)
Оголошення теми та мети уроку.
Вчитель: Тема нашого уроку «Застосування кисню та його біологічна роль.»
Виходячи з теми уроку подумайте про що б ви хотіли дізнатися, що вас найбільше цікавить.
Вправа «Дерево очікувань»
Учні на стікерах записують свої побажання та очікування від уроку і прикріплюють їх на «Дерево очікувань». Вчитель заздалегідь готує дерево ( з картону, пінопласту, дроту тощо), а також стікери у формі жовтого і зеленого листя. Якщо учні щось хвилює чи викликає занепокоєння він записує це на жовтому листку, якщо він планує дізнатися щось нове – на зеленому. "Дерево очікувань» допоможе вчителю скоригувати роботу з класом та індивідуально з кожним учнем.
ІІІ. Етап моделювання.
Вчитель. Девізом нашого уроку будуть слова Г. Форда.
Збиратися разом – це початок.
Триматися разом – процес.
Працювати разом – це успіх.
Вчитель. Давайте разом поміркуємо над завданнями уроку:
- з’ясувати значення кисню для збереження життя на Землі;
- дізнатися більше про галузі застосування кисню;
- зрозуміти звідки береться кисень у природі;
- чому кисень так необхідний для живих організмів;
IV. Етап організації виконання запланованої діяльності.
Вчитель: Перш, ніж вирушити в мандрівку країною Хімії, ми з вами повинні пригадати які фізичні властивості виявляє кисень. (Учні характеризують фізичні властивості кисню). А зараз для вас таке завдання:
Вправа «Хто швидше»
- Скласти сенкан на слово «кисень».
( Наприклад)
Кисень
Газоподібний, прозорий
Окислює, зв’язує, утворює,
Підтримує горіння і дихання.
Речовина.
Вчитель. Молодці, ви показали міцні знання, тому готові працювати далі. Я хочу представити вам керівника- координатора, ученицю 7 класу, ПІБ.
Координатор. Я керівник- координатор центру підготовки до уроку-проекту.
Ми просимо вчителя хімії Світлану Петрівну бути головним керівником наших дій. Ми готові продемонструвати наші знання, вміння і навички.
Сьогодні наш клас об’єднався у декілька команд. Це - біологи, медики, дослідники, соціологи, журналісти.
Створення проблемної ситуації.
Вчитель. Вміст кисню в атмосфері впродовж мільйонів років істотно не змінюється, незважаючи на велике споживання кисню живими організмами. Чим це можна пояснити?
(Відповіді учнів.)
Відповідь на це питання знайшли учні з групи дослідників.
Дослідники.
- Повідомлення учня.
Найцікавіша в світі речовина.
Тільки зелена рослина може створювати живе з неживого. Дивно починається це створення з роботи полоненого в рослині сонячного проміння.
У 1877 році К.А. Тимірязєв відвідав старого хворого Ч. Дарвіна у його садибі в Дауні, де той безвиїзно проводив останні роки свого життя. Розмова тривала понад дві години. Дарвін показав гостеві свої досліди, розповів про свої задуми і плани й назавжди захопив ними російського вченого. Потім він уважно вислухав гостя, розпитав про його дослідження і на закінчення сказав: «Хлорофіл – це, мабуть, найцікавіша з органічних речовин». За визначенням К. Тимірязєва, зерно хлорофілу – вихідна точка всього того, що ми розуміємо під словом «життя». Промінь Сонця, що впав на високоенергетичне хлорофілове зерно не згасне назавжди, не пропаде, не зникне безслідно. Він перетвориться в високоенергетичні сполуки та життєдайний кисень.
Головні постачальники кисню на Землі – це рослини. Вони утворюють та виділяють кисень в атмосферу в процесі фотосинтезу. Тому при сучасних обсягах витрат кисню весь його запас в атмосфері дуже швидко вичерпався б, якби не відбувалося його відновлення і поповнення.
- Творчий експеримент від групи дослідників.
Учень бере гілочку будь-якої кімнатної рослини і поміщує її в банку. Зразу робить вдих у цю ж банку. Після вдиху інший учень повинен занурити в цю посудину тріску, що горить.
Результат – тріска миттєво згасне.
Висновок. У банці є вуглекислий газ, який видихає людина, а він не здатний підтримувати горіння.
Учень знову робить видих у банку і швидко закриває її тугою кришкою, так щоб повітря ззовні не могло в неї потрапити. Банку ставить на яскраво освітлене підвіконня класу до кінця уроку. ( Вчитель пропонує учням завчасно зробити висновки про результати експерименту.)
Висновок. Тріска, яка буде занурюватися в банку через деякий час, не буде гаснути. Це станеться тому, що в склянці буде накопичуватися кисень, що виділився в результаті фотосинтезу в листках.
Координатор. Надаємо слово команді біологів.
(презентація команди біологів з теми «Біологічна роль кисню»)
Біологічна роль кисню.
а)підтримує дихання.
б)відбуваються реакції окиснення поживних речовин.
в)вивільняється енергія для діяльності організму.
г)вивільняється теплота для підтримки температури тіла теплокровних тварин.
Вчитель. Кожний день нашого життя є неповторним, світлим і прекрасним. Ми повинні відповідати за свої вчинки, цінувати життя, шанувати батьків, вчитися і досягати нових висот. І найважливішою умовою життя є наявність кисню. Надаємо слово команді медиків, які підготували повідомлення про фізіологічну дію кисню.
Повідомлення команди медиків «Фізіологічна дія кисню.»
Чистим киснем людина дихати не може: він отруйний для організму В атмосферному повітрі кисню 21%. Якщо концентрація кисню в атмосфері Землі підвищиться до 30%, то всі процеси в живих організмах прискоряться, й організми почнуть швидко старіти. В разі дихання повітрям з підвищеною концентрацією кисню може виникнути стан ейфорії й так зване кисневе отруєння. З іншого боку, якщо рівень кисню в атмосфері впаде нижче 16%, людина почне задихатися.
Вчитель. Настав час дізнатися де застосовують кисень, адже його використання ґрунтується на здатності підтримувати процеси дихання і горіння. Надаємо слово групі «Журналістів». ( презентація на тему «Застосування кисню»)
Застосування кисню:
1.У пілотуючих космічних апаратах (робота у відкритому космосі).
2.У споряджені водолазів.
3.В авіації під час польотів на великих висотах та під час сходження на високі гірські вершини.
4.В екіпіровці пожежників.
5.У медицині для підтримання життя хворих із утрудненим диханням.
6.Енергетика, металургія, хімічна промисловість.
Координатор: Природа дає можливість існування кожній людині. Але саме від людей, від їхнього ставлення одне до одного, до навколишнього світу і залежить яким буде цей світ. Надаємо слово команді соціологів.(презентація роботи команди соціологів. Соціологічне дослідження серед учнів 7-11 класів за питанням “ Чи існує зв'язок між вашими знаннями про кисень та існуючими екологічними проблемами? Чи задумувалися ви над розв’язанням цих проблем?»).
Учитель:. Бачу, що ваші думки і думки учнів нашої школи різні, і водночас однакові. Всі ви піклуєтесь про природу. Тому з впевненістю можна сказати, що ви маєте свою життєву позицію і це мене радує.
V. Контрольно-оцінювальний етап.
Вчитель: Я хочу вам запропонувати декілька цікавих завдань. І перше з них –
гра «Так. Ні.»
- Молекула кисню утворена двома атомами Оксигену.
- Кисень – газ без кольору, запаху, смаку, легший за повітря.
- Кисень вперше добув А.Лавуазьє.
- До складу води входить 89% кисню.
- Відносна атомна маса кисню – 8.
- Розчинений у воді кисень потрібний для життєдіяльності водних тварин.
- Кисень добре розчиняється у воді.
- Кисень використовують на хімічних заводах.
- Рідкий кисень використовують для виготовлення вибухових сумішей.
- Озон за фізичними властивостями не відрізняється від кисню
- Кисень в природі виступає як будівельник і як руйнівник (учні відповідають «так» чи «ні» в зошиті. Взаємоперевірка – за дешифратором.)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Друге завдання пов’язано з літературою.
Мабуть, ви чули про видатних письменників Ільфа та Петрова, які написали всім відомі твори «Дванадцять стільців» та «Золоте теля». В творі «Золоте теля» вони писали:
«В маленькому номері, відведеному диригенту симфонічного оркестру, спав Остап Бендер. Він лежав на плюшевому простирадлі, одягнутий, притискаючи до грудей валізу з мільйоном. За ніч великий комбінатор вдихнув в себе кисень, що містився в кімнаті, і хімічні елементи, що залишилися в ній, можна було назвати повітрям лише через ввічливість».
Використовуючи стратегію «Займи позицію» дайте відповідь на запитання «Чи може одна людина за ніч суттєво змінити вміст повітря в кімнаті?»
(Ні. Буде використано приблизно 72 л кисню. Це менше 0,5% об’єму повітря кімнати).
Оцінювання роботи на уроці.
Вчитель. Учні, ви всі потрудились на славу. Заслуговують на подяку всі творчі групи які виявили зацікавленість темою та гарно підготувалися до уроку
Вчитель з учнем-координатором проводять оцінювання роботи кожної з груп.
Вчитель. На початку уроку ви прикріпили свої стікери на «Дерево очікувань», тому зараз ви можете їх зняти та проаналізувати чи справдилися ваші очікування від уроку.
Учитель: А тепер давайте висловимо думку про те, чи знадобиться вам та робота, яку ви провели при підготовці до уроку, ті навички, які ви отримали під час до уроку - проекту.
- Як ви вважаєте, чи досягли ми мети уроку?
- Чи корисні вам будуть ці знання у майбутньому?
- Що нового ви дізналися на уроці?
- Чи все вам було зрозуміло?
- Що виявилося складним для розуміння?
Домашнє завдання. опрацювати матеріал параграфу 15 - 21.
Урок №14.
Тема уроку: Узагальнення і систематизація знань, умінь і навичок з теми «Кисень».
Мета уроку:
дидактична – узагальнити і систематизувати знання учнів з теми «Кисень», закріпити відкоригувати знання про хімічний елемент Оксиген і просту речовину кисень, способи добування кисню, його фізичні і хімічні властивості;
розвивальна - продовжити розвивати вміння складати формули за валентністю, застосовувати набуті знання під час складання хімічних рівнянь; сприяти розвитку навичок виконання хімічного експерименту відповідно до вимог правил техніки безпеки; працювати над формуванням хімічної мови, застосуванням хімічних понять та термінів; розвивати вміння аналізувати свої знання та вміння, адекватно оцінювати свої знання і здобутки.
виховна – виховувати любов до хімічної науки, розуміння її життєвої необхідності та практичної значущості;
Обладнання: періодична система хімічних елементів Д.І. Менделєєва.
Базові поняття та терміни: кисень, Оксиген, озон, реакція сполучення, каталізатор, закон збереження маси.
Тип уроку: урок узагальнення та корекції знань.
План – схема уроку
|
Етап уроку |
Час (хв) |
Форми і методи діяльності вчителя |
Результат |
|
І.Етап орієнтації про місце уроку в темі.
|
3 |
Вступне слово вчителя. |
Створення позитивного психологічного настрою, налаштування на роботу. |
|
ІІ.Етап цілепокладання.
|
7 |
Складання ключового слова з пазлу. Обговорення відомого вислову. |
Уміння швидко і логічно мислити. |
|
ІІІ.Етап моделювання.
|
5 |
Обмін думками щодо форми проведення уроку. |
Самостійний вибір способів опрацювання навчального матеріалу. |
|
ІV.Етап організації виконання запланованої діяльності.
|
25 |
Гра «Сортувальник». Вправи: «Незавершені реакції», «Так. Ні», «Хто швидше?». Робота в малих групах. Виконання тесту. Демонстрація експерименту. Виконання завдання за комп’ютером. Елементи проблемного навчання. Перегляд відеодосліду |
Уміння критично мислити, виділяти головне, орієнтуватися в навчальному матеріалі. Проводити взаємо оцінювання |
|
V.Контрольно-оцінювальний етап.
|
5 |
Оцінювання знань з теми, визначення «найкомпетентніших» учнів. |
Визначення учнями рівня власних навчальних досягнень |
Хід уроку
І. Етап орієнтації про місце уроку в темі.
Слово вчителя.
Мандруючи хімічними лабіринтами, ми протягом останніх уроків дізналися дуже багато таємниць. І ви, напевно, переконалися: щоб пізнати науку хімію, треба багато працювати. Всім відомо, один у полі не воїн, тож погляньте праворуч і усміхніться своєму однокласникові. А потім візьміть за руку свого товариша, що зліва. У такому гарному настрої спробуйте працювати швидко і творчо, щоб отримати найвищі бали. Наприкінці уроку ми визначимо учнів, які вибороли звання «Найрозумніший» та «Найкомпетентніший».
Вчитель. Діти, я знаю, ви полюбляєте складати пазли. Тому зараз ви маєте швидко скласти пазл і знайти приховане слово. ( Учні складають пазли і отримують слово Кисень)
Вчитель.
- Яке відношення має зашифроване слово до нашого уроку?
(Відповіді учнів:
- Це тема над якою ми працюємо протягом останніх уроків)
Вчитель. Отже, тема нашого уроку – «Узагальнення знань з теми «Кисень»»
Сьогодні наша мета – узагальнити і закріпити набуті знання та перевірити як ви засвоїли цей матеріал.
ІІ. Етап цілепокладання.
Вчитель. Хочу познайомити вас з крилатим висловом видатного вченого Берцеліуса: «Кисень – це речовина, навколо якої обертається земна хімія».
Обговорення вислову.
Вчитель.
- Як ви вважаєте, чому ми так багато часу приділяємо вивченню кисню?
- Що може дати цей урок кожному з вас?
Відповіді учнів.
ІІІ. Етап моделювання.
Вчитель. Урок проходитиме в режимі взаємооцінювання. Тому у кожного з вас на парті є аркуш оцінювання, у якому ви повинні робити відмітки про досягнення товариша по парті протягом уроку. Тобто за кожне виконане завдання ви виставляєте бали, сума яких і визначить остаточний бал за урок.
За кожне правильно виконане завдання ви отримаєте стікер жовтого і блакитного кольору. Який ви маєте закріпити на ватмані.
На сьогоднішньому уроці вам пропонуються завдання: «Так. Ні», «Незавершені реакції», «Сортувальник», «Хто швидше?».
ІV.Етап організації виконання запланованої діяльності.
Вчитель. Усі ви добре розумієте значення Оксигену і кисню для всього живого, тому ми маємо досконало засвоїти його властивості і способи одержання.
- Яка різниця між поняттям «Оксиген» та кисень?
Зараз перевіримо, як ви вмієте розрізняти ці поняття.
На парті прикріплені стікери на яких ви прочитаєте твердження. Кожна правильна відповідь – 1 бал.
Вправа «Так. Ні»
- Для дихання потрібен Оксиген. (Ні)
- До складу молекули води входить Оксиген.(Так)
- Для горіння необхідний кисень. (Так)
- Оксиген – це проста речовина. (Ні)
- Оксиген входить до складу багатьох складних речовин. (так )
- Відносна атомна маса кисню дорівнює 16. (Ні)
- Оксиген проявляє валентність ІІ. (Так)
- Кисень за звичайних умов газ. (так)
- До складу повітря входить Оксиген. (Ні).
- Вміст кисню становить 21% від об’єму повітря. (Так)
Гра «Сортувальник».
Клас поділяємо на І та ІІ варіанти. Учні отримують формули хімічних сполук серед яких мають вибрати лише оксиди і записати їх у кольорові колби. Кожна правильна відповідь – 1бал. Максимум 5 балів. Час виконання 1 хв.
Учитель перед грою ставить запитання класу:
- Що таке оксиди?
- Як записуємо формули оксидів?
І варіант. СаО, РН3, Н2S, ВаО, Li2О, Н2SО4, MgO, Fe2О3 .
ІІ варіант. СН4, АІ2О3, НСІ, СuO, Н3РО4, Р2О5, В2О3, SiO2.
На слайді з’являються правильні відповіді, учні проводять взаємооцінювання.
Вправа «Незавершені реакції»
Учням роздаються аркуші з хімічними схемами, в які необхідно вписати пропущені формули так, щоб утворилося рівняння хімічної реакції, і розставити коефіцієнти. Завдання виконують групи по 4 учні.
Завдання для 1 групи.
- … + О2 = СО2
- Ва + О2 =…
- АІ + О2 = …
4.СН4 + … = СО2 + Н2О
Завдання для 2 групи.
1 … + О2 = К2О
- Са + О2 =…
- Mg + О2 = …
- Fe + … = Fe2О3
Завдання для 3 групи.
Вкажіть рівняння реакції сполучення.
А) Ag + O2= Ag2O
Б) Zn + HCl= ZnCl2 + H2
В) Na2O + H2O= NaOH
Г) К NО3= К NО2 + О2
Правильна відповідь – 2 бали, максимальна відповідь – 8 балів.
Учитель. Згадаємо як одержують кисень у лабораторії та промисловості, як виявити його наявність, а також як утворюється кисень у природі.
Відеозапитання.
Учні, що сидять за партою, переглядають відео яке демонструє один із способів добування кисню, доведення його наявності, тощо. Вони мають пояснити, що демонструє дане відео та виконати відповідні завдання.
Питання до відео.
- Що таке каталізатор, для чого його використовують?
- Як можна зібрати добутий кисень?
- Які речовини використовують у лабораторії для добування кисню?
- Яка речовина є гарним каталізатором?
- Як довести наявність кисню?
Учні проводять оцінювання 1 бал – пояснити відео, 2 бали – відповідь на питання.
Вправа «Хто швидше»
Бесіда за питаннями.
Під час вивчення теми «Кисень» ми познайомилися з одним дуже важливим законом хімії.
- Який закон ми вивчили?
- Як формулюється даний закон?
- Які вчені відкрили цей закон?
- Де ми його використовуємо?
Зараз ви маєте можливість перевірити, як ви навчилися застосовувати закон збереження маси речовини на практиці.
Робота з тестами.
Учні отримують завдання різного рівня складності, виконують та перевіряють його правильність за допомогою програми «My test».
- Позначте масу ртуті, що прореагує з сіркою масою 3,2 г, якщо маса продукту реакції становить 43,4 г.
А. 40,6 г. Б.42,4 г. В.40,2 г. Г.40,8 г.
- Позначте маси вихідних речовин, якщо утвориться кальцій оксид СаО масою 5,6 г.
А. 3,8 г Са і 1,8 г О2.
Б. 3,6 г Са і 2 г О2.
В. 4,2 г Са і 1,4 г О2.
Г. 4 г Са і 1,6 г О2.
- Позначте масу фосфору, що прореагує з киснем масою 16 г, якщо маса продукту реакції становить 28,4г.
А. 12,4г.
Б.12,8 г.
В.14,2 г.
Г.14,4 г.
4. Вкажіть прізвища вчених, які відкрили закон збереження маси:
А. Й. Берцеліус;
Б. А. Лавуазьє;
В. Дж. Прістлі;
Г. М. Ломоносов;
Учитель. А зараз хочу представити вам хіміків- дослідників, які в лабораторних умовах вивчали одержання кисню і досліджували ефективність різних каталізаторів для розкладу гідроген пероксиду. Тому надаємо їм слово.
Робота в малій групі. «Досліджуючи – вчусь»
Хіміки – дослідники.
1 учень.
Відомо, що для одержання кисню у лабораторії використовують розклад оксигеновмісних речовин: калій перманганату і гідроген пероксиду. Найефективнішим каталізатором для розкладу гідроген пероксиду є порошкоподібний манган (ІV) оксид. У стаканчик за допомогою піпетки ми відібрали 10 мл розчину гідроген пероксиду. Далі додали каталізатор, реакція відбувалася миттєво з бурхливим виділенням газу.
2 учень.
Також частину експерименту ми виконали вдома і дослідили ефективність таких каталізаторів, як сира картопля, трава і сире м'ясо. Для експерименту використали гідроген пероксид куплений у аптеці. З’ясували, що найкращим каталізатором є сира картопля, яка одразу покривається бульбашками газу.
1 учень.
Для підтвердження наших досліджень зараз ми продемонструємо дію найефективніших каталізаторів для розкладу гідроген пероксиду у лабораторії і в домашніх умовах. Тобто як каталізатор будемо чорний порошок MnO2 і сиру картоплю.
Вчитель. Перш ніж перейти до виконання експерименту, потрібно пригадати правила техніки безпеки під час роботи з хімічними реактивами. (малюнками на слайді проілюстровані правила ТБ.)
V. Контрольно-оцінювальний етап.
Робота з тестами в програмі «Інтерактивне навчання»
Вчитель. Учні на протязі уроку ви оцінювали один одного на спеціальних аркушах.
Але кожен з вас може перевірити свої знання в програмі «Інтерактивне навчання» де зареєстрований наш клас. Тому зараз відкриваємо сайт interaktiv. ranok. com. ua. Заходимо в програму «Інтерактивне навчання». Тема «Кисень», розділ тести з теми, час на виконання - 3 хвилини.
Вчитель. Підраховуємо бали у аркуші оцінювання і ділимо на 2, так ви отрмаєте свій бал за урок.
Оцінювання учнів.
Вчитель. Діти як ви бачили протягом уроку ми прикріплювали смайлики і в кінці в нас утворився прапор України. Кожна насінинка ваших знань проросла і дала свій плід. Для розвитку нашої країни.
- Як ви думаєте, чому саме прапор став символом нашого уроку?
Цього року ми будемо відзначати 28 річницю незалежності України, до цієї події у столиці України хочуть створити найбільший прапор з живих квітів, що буде занесений до книги рекордів. Ви можете долучитися до цієї справи і замовити на сайті «Сільський вісник» набір насіння, виростити квіти синього і жовтого кольору і створити прапор на своїй клумбі. Потім всі квіти утворять стяг у м. Мог-Под і зрештою у Києві. Бажаю успіхів.
Визначення учнів, що вибороли звання «Найрозумніший» та «Найкомпетентніший».
Домашнє завдання. Повторити 15-18. Вправи ст. 135.
Список використаної літератури.
- Журнал «Хімія» вид. Основа №18 2007рік.
- Журнал «Хімія» вид. Основа №17 2007рік.
- Журнал «Хімія» вид. Основа №10 2007рік.
- Журнал «Хімія» вид. Основа №19 2010рік.
- Журнал «Хімія» вид.Основа №4 2010рік.
- Кукса С.П.600 задач з хімії.-«Мандрівець» Тернопіль, 2000.
- Савчин М.М. Уроки хімії у 9 класі.- Львів ВНТЛ-Класика, 2002.
- О.В.Григорович, А.В.Віценщик, О.М.Гостиннікова Хімія розробки уроків 9 клас.-Видавництво «Ранок»,2009.
- О.В.Григорович, А.В.Віценщик, О.М.Гостиннікова Хімія розробки уроків 8 клас.-Видавництво «Ранок»,2009.
- Г.Дубковецька, А.Алєксєєнко, В.Ніколайчук «Готуємось до ЗНО».- Камянець-Подільський «Каліграф», 2008.
- Л.О.Слєта, А.В.Чорний, Ю.В.Холін «1001 задача з хімії».-Харків «Ранок», 2004.
- І.Ю.Старовойтова, О.В.Люсай «Усі уроки хімії 7 клас».-Харків «Основа»,2007.
- Г.Дубковецька, В.Ніколайчук, в.Ніколайчук «Збірник задач з хімії».-Тернопіль, 2002.
- Г.А.Лашевська «Хімія 7».- Київ «Ґенеза»,2007.
- Г.М.Дубковецька, М.А.Баран, Л.О.Базюк «Посібник для поточного і підсумкового контролю та самоконтролю з хімії 7,8,9 класи».-Тернопіль 2009.
- www.chem.msu.su
- www.chemistry.narod.ru
- www.nanonewsnet.ru


про публікацію авторської розробки
Додати розробку
