" Узагальнення знань про вуглеводи.Розв’язування задач на визначення кількості, маси або об’єму речовини за відомою кількістю, масою або об’ємом реагентів,що містить домішки"
Тема уроку. Узагальнення знань про вуглеводи.Розв’язування задач на визначення кількості, маси або об’єму речовини за відомою кількістю, масою або об’ємом реагентів,що містить домішки.
Мета уроку:
узагальнити знання учнів про вуглеводи, їх хімічні властивості, застосування; показати взаємозв’язок між вуглеводами;
розвивати навички виконання вправ і розв’язання задач на визначення кількості, маси або об’єму речовини за відомою кількостю, масою або об’ємом реагентів,що містить домішки;
виховувати в учнів вміння працювати у групах, з додатковою літературою, взаємодопомогу в роботі;
Тип уроку: формування знань, умінь і навичок.
Форми роботи: фронтальна, індивідуальна, групова.
Обладнання: картки-завдання, ментальні картки
Хід уроку
I. Організація класу
II. Перевірка домашнього завдання. Актуалізація опорних знань.
1.Що таке вуглеводи?
2.Написати загальну формулу вуглеводів.
3.Що спільного в будові вуглеводів?
4.Що відмінне в будові вуглеводів?
5.Як довести зв’язок між вуглеводами?
III. Мотивація навчальної діяльності
На сьогоднішньому уроці ми ще раз пригадаємо все, що ви знаєте про вуглеводи, їх будову, властивості, поширення в природі та застосування
IV Узагальнення й систематизація знань про вуглеводи
Щоб освіжити в пам’яті знання про вуглеводи, я пропоную учням створити ментальні картки. Для організації роботи на уроці учні об’єднуються в групи по 4 учні (чотири кольори) і отримують завдання створити ментальні картки по темам: Глюкоза. Сахароза. Крохмаль. Целюкоза. Учні отримують папір і виконують протягом 10хвилин роботу. Потім представник групи прикріплює її на дошці і протягом 5 хвилин узагальнює знання з даної теми. І так звітує про роботу кожна група. (Приклад ментальної картки в кінці розробки уроку).
V. Розв’язання задач на визначення кількості, маси або об’єму речовини за відомою кількостю, масою або об’ємом реагентів,що містить домішки;
Вивчаючи речовини ми відмітили, що практично чистих речовин в природі не існує. Більшість речовин містять домішки. При розв’язуванні задач на визначення кількості, маси або об’єму речовини за відомою кількістю, масою або об’ємом реагентів,що містить домішки потрібно обчислити кількість домішок, відняти їх від маси реагентів і вже потім розв’язуєм задачі за чистою речовиною.
Алгоритм розв’язку задач.
1.Записуєм скорочену умову задачі.
2.Складаєм рівняння, врівнюєм, розставляючи коєфіцієнти.
3.Обчислюєм масу домішок і віднімаєм її від маси речовини.
4.Кількість чистої речовини записуєм в рівняння.
5.За рівнянням реакції обчислюєм кількість потрібної речовини.
6.Розраховуєм масу чи об’єм потрібної речовини.
Задача1
Скільки глюкози можна отримати шляхом гідролізу 10кг. крохмалю,що містить 10%домішок?
![]() Дано: 55,6моль Н2SO4 х моль
Дано: 55,6моль Н2SO4 х моль
![]() m(С6Н10О5)п=10кг. (С6Н10О5)n+nН2О n С6Н12О
m(С6Н10О5)п=10кг. (С6Н10О5)n+nН2О n С6Н12О
![]() w (дом)=10% 1моль 1моль
w (дом)=10% 1моль 1моль
m(дом)=m*w
m(С6Н12О6)=? m(дом)=10кг*0,1%=1кг.
m(С6Н10О5)n=10кг-1кг=9 кг.
Знаходимо кількість чистої речовини
n=m/M
n (С6Н10О5)п=9000г / 162г/моль=55,6моль
так, як n (С6Н10О5)п = n (С6Н12О6) як1:1 , то
n (С6Н12О6) =55,6 моль
m=М*n
m(С6Н12О6)=180 г/моль*55,6моль=10008г
М(С6Н12О6)=180 г/моль
Відповідь: m(С6Н12О6) =10008г
Задача2
Який об’єм водню потрібний для відновлення 0,5 моль глюкози, що містить 5%домішок до шестиатомного спирту-сорбіту? 0,48моль х моль
С6Н12О6+Н2= С6Н14О6
1моль 1моль
![]() Дано: М(С6Н12О6)=180 г/моль
Дано: М(С6Н12О6)=180 г/моль
n(С6Н12О6)п=0,5моль m=М*n
![]() w (дом)=5% m(С6Н12О6)=180 г/моль*0,5моль=90г.
w (дом)=5% m(С6Н12О6)=180 г/моль*0,5моль=90г.
v(Н2)=? m(дом)=m*w
m(дом)=90г*0,05=4,5г
m(С6Н12О6)=90г-4,5г=85,5г
Знаходимо кількість чистої речовини .
n=m/M
n (С6Н12О6)=85.5г / 180г/моль=0,48моль
0,48:1=х:1
х=0,48 n=0,48моль
V=Vm*n V(H2)=22,4л/моль*0,48моль=10,8л.
Відповідь: V(H2)= 10,8л.
IV. Підбиття підсумків уроку
Підбиття підсумків роботи груп, оцінювання роботи учнів на уроці.
V. Домашнє завдання
Прочитати параграф 20 вправа 147-149 стр.124 повт. параграф 23-25
Альдегідна група (-СОН) Гідроксильна група (ОН-) розчиняється у воді
![]()
![]()
![]()
![]() У медицині Солодка на смак
У медицині Солодка на смак
![]()
![]() У фармакології Будова (біфункціональна сполука)
У фармакології Будова (біфункціональна сполука)
![]()
![]()
![]()
![]()
![]()
![]()
![]() застосування Фізичні властивості кристалічна
застосування Фізичні властивості кристалічна

 безбарвна кондитерстві
безбарвна кондитерстві 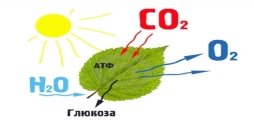 молекулярна кристалічна решітка
молекулярна кристалічна решітка
у текстильній промисловості
![]()

![]()
![]() Поширення у природі хімічні властивості як альдегіди
Поширення у природі хімічні властивості як альдегіди
![]() С6Н12О6+2Сu(ОН)2=С6Н12О7+Сu2О+2Н2О
С6Н12О6+2Сu(ОН)2=С6Н12О7+Сu2О+2Н2О
рослини тваринна кров 0,1%
![]()
![]() специфічні як багатоатомні спирти
специфічні як багатоатомні спирти
С6Н12О6+Сu(ОН)2=глюконат купруму (ІІ)+2Н2О
спиртове бродіння молочнокисле бродіння


про публікацію авторської розробки
Додати розробку
