Властивості амоніаку
Тема уроку. Амоніак: властивості, використання. Солі амонію. Якісна реакція на іон амонію
Мета уроку:
- ознайомити зі складом, особливостями будови молекули й фізичними властивостями амоніаку, розчинністю амоніаку у воді й дією індикаторів на розчин, особливостями взаємодії амоніаку з водою й кислотами;
-розповісти про застосування амоніаку; розширити уявлення про солі та їх загальні властивості на прикладі солей амонію;
- ознайомити учнів зі специфічними властивостями солей амонію; дати уявлення про способи одержання солей амонію;
- розвивати вміння складати іонно-молекулярні рівняння відповідних реакцій на прикладі хімічних властивостей амоніаку;
-удосконалювати вміння проводити хімічний експеримент, спостерігати за перебігом реакцій і робити узагальнюючі висновки.
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: навчальна лекція, лабораторний і демонстраційний експерименти, робота з опорною схемою.
Лабораторний дослід 2. Визначення іонів амонію в розчині.
ХІД УРОКУ
- Привітання та організація класу.
- Актуалізація опорних знань, перевірка домашнього завдання
ІІІ. Мотивація до уроку Тема сьогодні нашого уроку Амоніак: властивості, використання. Солі амонію. Якісна реакція на іон амоніюIII. Вивчення нового матеріалу (розповідь учителя)
Амоніак — будова молекули й фізичні властивості.
«ХІМІЧНА АБЕТКА»
Амоніак – одна з найважливіших сполук Нітрогену, яка має важливе практичне значення . Життя на Землі пов’язане із здатністю деяких бактерій перетворювати азот повітря на амоніак. Запах амоніаку знайомий кожному , варто лише відкрити склянку із нашатирним спиртом .
H H
1) NH3 2) H :N: H 3) H-N-H
Молекулярна Електронна Структурна
формула формула формула
4)Наявність трьох ковалентних зв’язків зумовлює валентність Нітрогену в молекулі аміаку- ІІІ, проте за певних умов валентність Нітрогену може збільшуватися ІV .
5)ступінь окиснення -3 ,
6)Мr(NH3) = 17
7)М(NH3) = 17г/моль
8) безбарвний газ із різким запахом, Цей запах має і його 10% водний розчин - нашатирний спирт. легший за повітря в 1,7 разів.
9)добре розчинний у воді (до 700 л амоніаку в 1 л води).
10)Температура плавлення дорівнює —77,7 °С,
11)температура кипіння 33,4 °С.
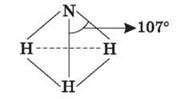
12) молекула NH3 має структуру трикутної піраміди з атомом Нітрогену у вершині.
13) Хімічні зв’язки між атомами Нітрогену і Гідрогену в молекулі аміаку – ковалентні полярні. 107°. Молекула аміаку являє собою диполь.
МАЛЮНОК НА ДОШЦІ.
1. Взаємодія з водою. Аміак добре розчиняється у воді утворюючи аміачну воду (за нормальних умов у 100 г води розчиняється 87,5 г, або 115л, NH3). Висока розчинність аміаку пояснюється тим, що він реагує з водою. Якщо суху колбу, заповнену аміаком і закриту пробкою із вставленою трубкою з відтягнутим кінцем, занурити у воду, до якої додано кілька крапель розчину фенолфталеїну, то з безбарвної рідини починає бити малиновий «фонтан». Забарвлення аміачної води свідчить про те, що водний розчин аміаку має лужну реакцію.
Як це можна пояснити?
У воді концентрації йонів Гідрогену Н+ і гідроксид-іонів ОН- — однакові:
H2O ⇔ H+ + OH- ,
тому середовище нейтральне, і фенолфталеїн безбарвний. З розчиненням аміаку NH3 у воді концентрація гідроксид-іонів ОН- збільшується, отже, утворюється лужне середовище, і фенолфталеїн стає малиновим.
Виникнення лужного середовища пояснюється тим, що в розчині молекули аміаку приєднують йони гідрогену, утворюючи йони амонію NH+4.
NH3 + H+ → NH4
При цьому вивільнюються з води гідроксид-іони ОН- , що й надає розчину лужної реакції.
Кожний йон амонію NH+4 має чотири ковалентні зв'язки. Три з них юються за рахунок трьох неспарених електронів, які є на р-орбіталях зовнішнього електронного шару атома Нітрогену. Четвертий зв'язок утворюється за донорно-акцепторним механізмом між атомом Нітрогену аміаку (донор) та йоном гідрогену (акцептор):
Н Н +
l І
Н — N: + Н+ → Н — N — Н
І І
Н Н
Усі чотири зв'язки нітроген-гідроген N — Н в йоні амонію рівноцінні, незважаючи на різні механізми їхнього утворення.
Взаємодія аміаку з водою відбувається за рівнянням:
NH3 + Н20 ⇔ NH3 • Н20⇔ NH+4 + ОН-
Але в розчині лише невелика частина молекул NH3 перетворюється на йони амонію NH+4. Тому аміачна вода пахне аміаком.
Аміачну воду позначають формулою NH3 • Н20 і називають гідроксидом амонію, або нашатирним спиртом. Він належить до слабких і нестійких основ:
NH3 • Н20 ⇔ NH+4 + ОН-
NH3 • Н20⇔ NH3↑ + Н20
2. Взаємодія з кислотами. Якщо змочити одну скляну паличку концентрованим розчином аміаку, а іншу — концентрованою хлоридною кислотою і піднести їх одну до одної, то з'являється білий дим — дрібні кристалики хлориду амонію (нашатирю):
NH3 + НСl = NH4Cl
Отже, аміак, взаємодіючи з кислотами, утворює солі амонію:
Напишіть рівняння реакцій між аміаком і: а) нітратною, б) сульфатною кислотами. Які солі амонію при цьому утворюються?
Що спільного і відмінного між речовинами, назви яких «нашатир» і «нашатирний спирт»?
Добування. У лабораторії аміак добувають із суміші твея дих речовин — нашатирю NH4Cl і гашеного вапна Са(ОH)2 за рівнянням:
2NH4Cl + Са(ОН)2 = CaCl2+2NH3↑ + 2Н20 .
Чому для добування аміаку беруть сухі речовини, а не їхні розчини? Чому збирають аміак у пробірку, перевернену догори дном?
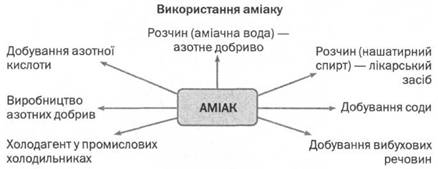
Застосування. Аміак — важливий продукт хімічної промисловості. Його використовують як добриво і для виробництва азотних добрив, а також нітратної кислоти, вибухових речовин, соди. Як холодоагент аміак застосовують у холодильниках.
У вигляді аміачної води він використовується у медицині під назвою «нашатирний спирт». Вдихання малих кількостей аміаку І стимулює роботу серця і нервової системи, тому нашатирний спирт дають нюхати при знепритомленні та отруєннях, наприклад чадним газом CO. Як слабкий луг аміачну воду широко застосовують у хімічних лабораторіях, а також у побуті: під час прання білизни, для виведення плям, чищення килимів і ювелірних виробів.
Солі амонію — це кристалічні речовини з йонним типом зв'язку. До складу солей амонію входять один або кілька катіонів амонію і аніон кислотного залишку.
Напишіть формули трьох солей амонію і зазначте назву кожної з них.
Солі амонію — тверді кристалічні речовини, що за зовнішнім виглядом нагадують солі лужних металів. У воді добре розчиняються.
Хімічні властивості
Солі амонію виявляють типові для всіх солей властивості і деякі специфічні.
1. Дисоціація на йони. Як сильні електроліти солі амонію у водному розчині добре дисоціюють на йони:
(NH4)2S04 ⇔2NH+4 + SO2-4
2. Взаємодія з іншими солями. Якщо в пробірку з розчином хлориду амонію долити розчин нітрату аргентуму, то випадає сирнистий (схожий на зсіле молоко) білий осад:
NH4Cl + AgN03 = NH4N03+ AgCl↓
Ви переконалися, що солі амонію вступають у реакцію йонного обміну з іншими солями. Напишіть наведене рівняння у повній і скороченій йонних формах. Пригадайте, яких умов треба додержувати, щоб реакція обміну між двома солями відбулася до кінця, тобто практично була б необоротною. Чи витримані такі умови у даному разі?
3. Взаємодія з лугами. В результаті взаємодії солей амонію з лугами утворюється аміак, через що дану реакцій використовують як якісну на солі амонію:
NH4Cl + NaOH = NaCl + NH3↑ + H20
Виділення аміаку NH3 —характерна ознака для розпізнавання солей амонію.
Лабораторний дослід 5. Якісна реакція на іон амонію
Здійсніть якісну реакцію й визначте наявність у розчині іона амонію, запишіть іонно-молекулярне рівняння взаємодії амоній хлориду з лугами:
NH4Cl + KOH ![]() KCl + NH4ОH
KCl + NH4ОH ![]() KCl + NH3 + H2О
KCl + NH3 + H2О
NH4+ + Cl- + K+ + OH- ![]() K+ + Cl- + NH3 + H2О
K+ + Cl- + NH3 + H2О
NH4+ + OH- ![]() NH3 + H2О
NH3 + H2О
Застосування аміаку
Амоніак - важливий продукт хімічної промисловості. Сучасна промисловість використовує десятки мільйонів тонн амоніаку на рік. Основна кількість якого переробляється в нітратну кислоту. Частково амоніак використовують для добування вибухових речовин, сечовини як мінерального добрива, обробки силосу він є сировиною для синтезу пластмас та штучних волокон, наприклад капрону. 10% водний розчин аміаку - нашатирний спирт використовують в медицині. Коли людина втратила свідомість, до її носу підносять ватку, змочену нашатирним спиртом. Різкий запах аміаку може привести людину до тями. Але давати нюхати такий розчин потрібно в міру. В великій кількості аміак уражує дихальні шляхи і слизові оболонки очей, викликає задуху, запаморочення, біль у шлунку.
Аміак широко використовують у різних галузях.
VI. Підбиття підсумків уроку.
Учні уявіть себе ведучими новин на відому телеканалі, в рубриці «КОРОТКО ПРО ГОЛОВНЕ» Гру ми розпочнемо моїми словами : А зараз рубрика Амоніак має певні властивості, а саме:
- Валентність Нітрогену у молекулі аміаку дорівнює ІІІ.
- 10відсотковий водний розчин аміаку- нашатирний спирт.
- Реакція аміаку з хлоридною кислотою відбувається з утворенням білого диму.
- Амоніак добре розчинний у воді.
- Аміак – безбарвний газ із різким запахом.
- Молекулярна формула амоніаку - NH3
VII. Домашнє завдання
Опрацювати матеріал параграфа_____, відповісти на запитання до нього, виконати вправи_____


про публікацію авторської розробки
Додати розробку
