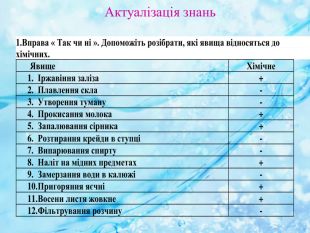
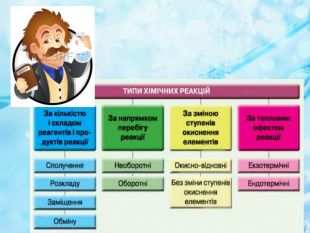
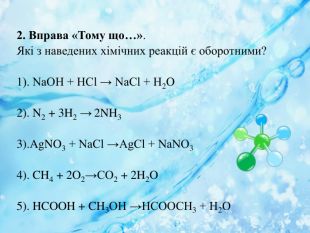
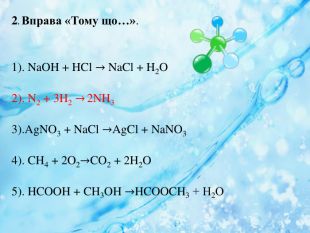
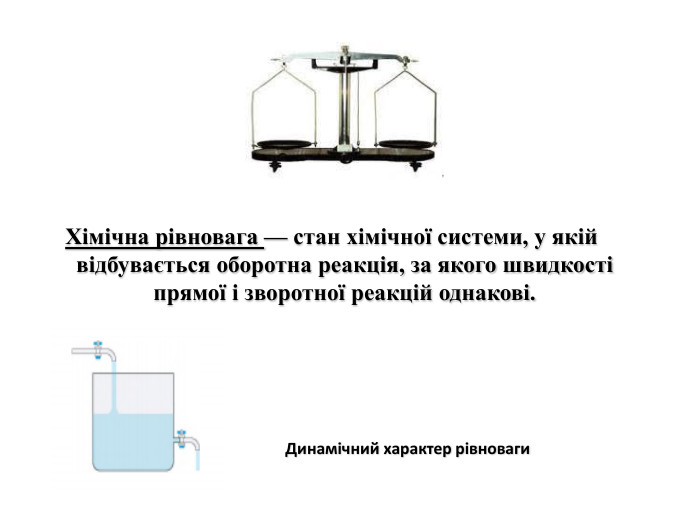
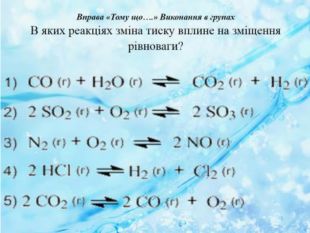Вплив різних чинників на зміщення хімічної рівноваги. Принцип Ле Шателье



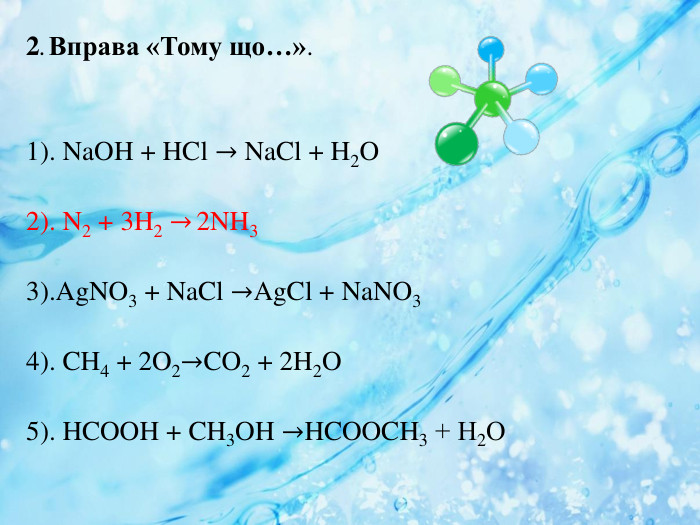




















Анрі Луї Ле Шательє (1850 — 1936) Видатний французький хімік і фізик. У 1872 р. закінчив Політехнічну школу (Париж) й отримав диплом інженера. У 1876 р. обійняв посаду професора загальної хімії в Гірній школі, де займався дослідницькою діяльністю, у результаті якої теоретично обґрунтував важливі для металургії і теплотехніки розрахунки, пов’язані з горінням і виділенням теплоти. Визначив чинники, від яких залежать рівноважні процеси хімічних реакцій, відомі в науці як принцип Ле Шательє. Результати його досліджень будівельних матеріалів (бетону, цементу, гіпсу, кераміки, скла) мають дотепер практичне значення. Окрім проведення досліджень Ле Шательє читав лекції студентам, керував дипломними роботами і докторськими дисертаціями, брав участь у державних комісіях. Дослідження Ле Шательє високо оцінені у Франції та за її межами.
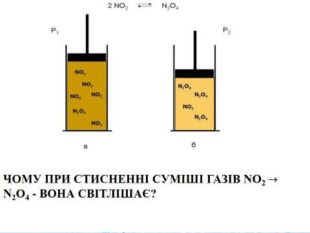
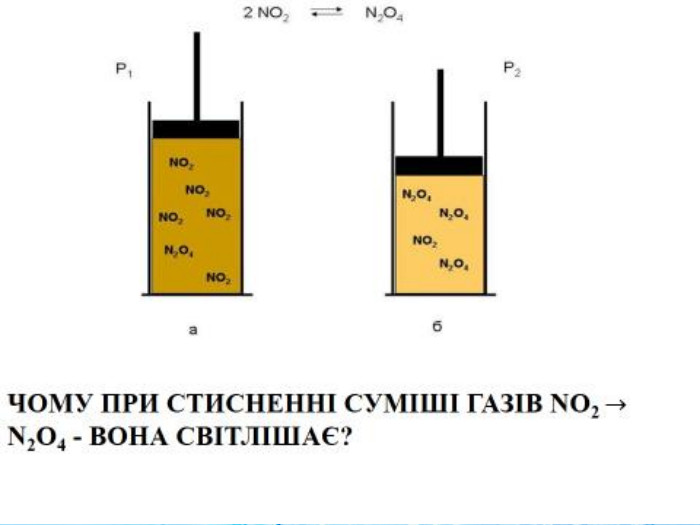
Вплив зміни температури середовища на стан хімічної рівноваги Нагрівання рівноважної суміші (2N02 = N204) зміщує рівновагу в бік розкладання димеру (N02), про що свідчить посилення червоно-коричневого забарвлення (а), а під час охолодження рівновага зміщується в бік утворення димеру, і суміш знебарвлюється N204 (б)
Вплив зміни концентрації речовин на стан хімічної рівноваги Зміщення стану рівноваги в разі зміни концентрації речовин: а — початкова рівноважна суміш N2, Н2, та NH3; б — додавання N2; в — новий стан рівноваги, за якого вміст азоту в суміші більший (унаслідок його додавання), амоніаку — більший (унаслідок утворення), а водню — менший
Вплив зміни тиску на стан хімічної рівноваги Зміщення стану рівноваги в разі зміни тиску: а — початкова рівноважна суміш N2, Н2, та NH3; б — зменшення об'єму суміші, що спричиняє підвищення тиску; в — новий стан рівноваги, за якого вміст амоніаку більший, а водню та азоту — менший Зміщення стану рівноваги реакції розкладання вапняку в разі зміни тиску: а — початковий рівноважний стан; б — зі зменшенням об'єму підвищується тиск і зменшується кількість вуглекислого газу, рівновага зміщується в бік реагентів
Вплив наявності каталізаторів на стан хімічної рівноваги У разі додавання каталізатора до суміші, що перебуває в стані хімічної рівноваги, прискорюються як пряма, так і зворотна реакції, до того ж швидкості обох реакцій підвищуються однаково. Рівновага при цьому зберігається. Отже, каталізатор не зміщує рівновагу, а тільки прискорює її встановлення.
Більшість промислово важливих хімічних реакцій є оборотними. Це означає, що не всі реагенти перетворюються на продукти реакції. Тому після взаємодії з рівноважної суміші необхідно видалити цільовий продукт реакції, а реагенти, що залишилися, повернути в реактор для подальшого перетворення. Трапляються випадки, коли за жорстких умов (і навіть за наявності каталізаторів) ступінь перетворення реагентів на продукти дуже малий (10% і менше). У такому разі технолог підприємства має вирішити технологічну проблему: - обрати такі умови реакції, щоб максимально змістити рівновагу в бік продуктів реакції; - для зменшення собівартості продукції обрати умови якомога менш жорсткі: нижчу температуру й тиск, зменшити витрати дорогих реагентів і каталізаторів. Використання знань про зміщення хімічної рівноваги для розв'язання технологічних проблем


про публікацію авторської розробки
Додати розробку