УРОК "Гідроген. Місце в періодичній системі. Будова атома. Ізотопи. Поширеність Гідрогену в природі. Водень. Склад молекули і будова речовини. Добування і фізичні властивостІ"
Урок №1-2. Гідроген. Місце в періодичній системі. Будова атома. Ізотопи. Поширеність Гідрогену в природі. Водень. Склад молекули і будова речовини. Добування і фізичні властивості (Демонстрації. Добування водню та перевірка його на чистоту).
МЕТА: познайомити учнів з характеристикою Гідрогену як хімічного елемента, показати взаємозв’язок між положенням елемента в періодичній системі та будовою атома, будовою простої речовини і способами її добування в лабораторних умовах та промисловості. Розвивати вміння прогнозувати за будовою речовини її фізичні властивості та критично мислити на підставі отриманих знань.
ТИП УРОКУ: засвоєння нових знань.
НАОЧНІСТЬ:таблиця «План характеристики хімічного елемента», періодична система хімічних елементів Д.І. Менделєєва, презентація «Гідроген. Водень».
МАТЕРІАЛИ ТА ОБЛАДНАННЯ: лабораторний штатив, пробірки, колба з водою, розчин хлоридної кислоти, цинк, літій, розчин фенолфталеїну, апарат Кіппа, сірники, воронка.
ДИДАКТИЧНІ МАТЕРІАЛИ:опорна схема «Гідроген. Водень», тестові дидактичні матеріали, роздруківки для виконання домашнього завдання.
ДОМАШНЄ ЗАВДАННЯ: тестові завдання, задачі №1-6, вивчити опорну схему, підготувати доповідь про наукову діяльність А.Лавуазьє за інтернет - ресурсами.
СТРУКТУРА НАВЧАЛЬНОГО ЗАНЯТТЯ: І. ВСТУПНА ЧАСТИНА.
ЕПІГРАФ:
« Атом такий же невичерпний як і наш Всесвіт»
Всесвіт… Це слово невідоме нашим пращурам аж до кінця XVII сторіччя, поки Ісаак Ньютон – один із геніїв нової епохи, не змінив уявлення людства про навколишній світ. Його модель вічного і нескінченого Всесвіту, яка прийшла на зміну геліоцентричній моделі М.Коперника та геоцентричній Птоломея на століття заполонила розум найосвіченіших представників людської популяції. Всесвіт, у нашому розумінні, – це щось всеохоплююче, неймовірне за величиною, що манить нас своєю загадковістю та незвіданністю.
Всесвіт – це система, що включає абсолютно всі тіла величезного простору в вічному часовому параметрі. Всесвіт – це вічність , Всесвіт – це безрозмірність, Всесвіт – це неймовірний масштаб. На уроках астрономії ви продовжите знайомство з іншими теоріями побудови оточуючого нас світу: сукупності галактик(Кептейна, Зелінгера), галактик, що розбігаються (Хаббла) чи Мультивсесвіту (Лінде)… Але нас сьогодні цікавить інше питання: «Невже найменша хімічно неподільна частинка речовини, з якою ми познайомились у восьмому класі, може хоч в чому порівнятись з такою мегасистемою як Всесвіт? Чи дійсно вона така ж безмірна і невичерпна ?» Мабуть, що так.
На уроках фізики та хімії ми познайомились з терміном «атом», що в перекладі з грецької звучить як «неподільний» та його різними моделями будови: «пудинг» або «булочка з родзинками», «планетарна», «протонно – нейтронна» і ще майже десятком різних просторових моделей, кожна з яких має право на існування. Природодослідникам вдалось нас переконати,що атом є надскладною системою з величезною кількістю суперелементарних частинок. Сьогодні ж, ми спробуємо більш детально познайомитись з найпростішою атомною системою, що є не тільки первістком Всесвіту, бо яку б його частину ми не взяли, яку б зоряну систему ми не досліджували, вона завжди в ній присутня. Цей хімічний елемент в «вариві» космічної кухні в ході термоядерних процесів утворює своїх «братів» по колекції,що простирається перед нашими очима і запропонована ще одним генієм нашої сучасної епохи - Д.І.Менделєєвим. Так, ця система є дійсно колекцією найрізноманітніших елементів, які вже дослідило людство, а започатковує її елемент, без якого не можна уявити жодної геологічної оболонки нашої планети, без нього неможливе було б і існування такого фантастичного явища, як «ЖИТТЯ». Гідроген – це «той, що народжує воду», а вода, як відомо, - колиска всього живого в нашій Сонячній системі. Отже, «первісток» всього живого та неживого, - сьогоднішній урок присвячується тобі, найпростішому та найлегшому із відомих атомів, але одній із найзагадковіших та найскладніших систем.
ІІ. ОСНОВНА ЧАСТИНА (ЗАПОВНЕННЯ ОПОРНОЇ СХЕМИ)
Заповнення опорної схеми відбувається за надрукованим планом, який завчасно вивішується на класній дошці. Подача навчального матеріалу відбувається в ході проблемної бесіди з безпосередньою участю учнів класу.
1 БЛОК. Характеристика хімічного елемента.
1. Символ, вимова, назва хімічного елемента, відкриття. «Такий знайомий елемент».
До опорної схеми записуються відомі учням з уроків 8 класу відомості про хімічну символіку Гідрогену, походження назви елемента та історичний аспект його відкриття (розповідь - знайомство з першовідкривачами простої речовини Гідрогену: засновником «ятрохімії» та «хімічним бунтівником» - Т. Парацельсом, «хімічним олігархом» - Г. Кавендішем, «хімічним генієм», «руйнівником стереотипів» - А. Лавуазьє).
2. Положення в ПС, ізотопи, відносна атомна маса.
«Згадаємо народні казки».
Розповідь про «живу» і «мертву» воду, утворення протієвої ( легкої ) та дейтерієвої (важкої) води, її вплив на життєдіяльність організмів (дослідження випускника ліцею
І.Ю.Стуброва «БАГАТОФАКТОРНІСТЬ ВПЛИВУ НА ФІЗІОЛОГІЧНУ АКТИВНІСТЬ ВОДИ»).
3.Будова атома.
«Допомога учнів класу».
Фронтальна робота по заповненню електронної конфігурації атома Гідрогену. Визначення валентності, типу елемента, окисно – відновних властивостей.
4. Ступінь окиснення.
«Ланцюжок».
Проставляння ступенів окиснення з подальшим аналізом учнями класу.
ІІІ. СИСТЕМАТИЗАЦІЯ ТА ЗАКРІПЛЕННЯ НАВЧАЛЬНОГО МАТЕРІАЛУ. Виконання тестових завдань.(1 БЛОК)
ТЕСТИ.
1.Укажіть вимову хімічного символу елемента, який в перекладі з грецької називається - «той, що народжує воду»: а) Гідроген; б) водень; в) аш;г) Гелій.
2.Укажіть назву хімічного елемента, який в перекладі з грецької називається - «той, що народжує воду»: а) Гідроген; б) водень; в) аш;г) Гелій.
3.Укажіть прізвище вченого, який вперше спостерігав виділення водню :
а) Авогадро; б) Кавендіш; в) Шеєле; г) Прістлі; д) Парацельс.
4.Укажіть прізвище вченого, який дослідив фізичні властивості водню та назвав його «горючим газом»:
а) Шеєле; б)Прістлі; в)Авогадро; г)Кавендіш; д) Бутлеров.
5.Укажіть прізвище вченого, який визначив Гідроген як хімічний елемент та дав йому назву:
а)Парацельс; б)Прістлі; в) Шеєле; г)Кавендіш; д)Лавуаьє. 6.Укажіть назву найбільш поширеного в природіізотопу Гідрогену:
а) Дейтерій; б)Гелій; в) Тритій; г) Гідроксоній; д) Протій.
7. Визначте кількість нейтронів у ядрі атома дейтерію: а) 2; б) 3; в)1; г) 0.
8. Укажіть назву найменш поширеного в природіізотопу Гідрогену:
а) Дейтерій; б) Протій; в)Гідроксоній; г)Тритій; д) Гелій.
9.Гідроген відносять до групи: а) р-елементів; б)d-елементів; в)s-елементів; г)f-елементів.
10. У гідридах Гідроген проявляє властивості: а)ні окисника, ні відновника; б) відновника; в) окисника і відновника; г)окисника.
11. У молекулі метану Гідроген проявляє властивості: а) окисника; б) окисника і відновника; в)відновника; г) ні окисника, ні відновника.
12. Укажіть гідрид-йон: а)НэО+; б)Н+; в) Н- ; г) ОН-; д) Н2-.
13. Гідроген,отримуючи електрони, проявляє властивості:
а)ні окисника, ні відновника; б)окисника; в) окисника і відновника; г)відновника.
14. Укажіть катіон Гідрогену:а)НэО+;б)ОН-; в)Н2-; г)Н+ ; д)Н-.
15. Проставте ступені окиснення в формулах запропонованих сполук:
СН4, AlH3, H3PO4, Cr(OH)3.
ІІ. ОСНОВНА ЧАСТИНА (ЗАПОВНЕННЯ ОПОРНОЇ СХЕМИ)
5. Поширення в природі.
«Інформація молодших колег».
Тези із реферативних робіт учнів 8-х класів
( робота К. Смольниченко «Поширення хімічних елементів У Всесвіті»).
2. БЛОК. Характеристика простої речовини.
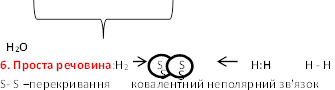
6. Будова молекули водню.
Перегляд слайдів презентації одного із учнів класу, що демонструють утворення певного виду ковалентного зв’язку з утворенням молекули простої речовини водню.
7. Характеристика фізичних властивостей водню.« Чому? »
За запропонованими характеристиками водню одного із слайдів спробувати зробити пояснення певних фізичних параметрів.
1. Чому газ? 2. Чому малорозчинний у воді? 3.Чому легший за повітря? 4. Чому важко зріджується? 5. Чому має такі низькі температури кипіння та кристалізації?
ІІІ. СИСТЕМАТИЗАЦІЯ ТА ЗАКРІПЛЕННЯ НАВЧАЛЬНОГО МАТЕРІАЛУ.
ТЕСТИ (2 БЛОК)
1.Укажіть тип зв'язку в молекулі водню: а) полярний ковалентний; б) неполярний ковалентний; в) йонний; г) донорно-акцепторний; д) водневий. Поясніть.
2. При утворенні хімічного зв’язку між атомами Гідрогену в молекулі водню відбувається таке перекривання електронних хмарин:а)р - р; б)d - d; в) s –р;г) s - s.Поясніть.
3.Вибірковий диктант. Водень – це:
1.Газ синього кольору за стандартних умов. 5.Газ,який має температуру кипіння - -1830 С 2.Майже нерозчинний у воді газ. 6.Речовина, яка твердне за температури -259,10С
3.Речовина без кольору та запаху. 7. Газ, який є дуже токсичним.
4.Газ, який важко зріджується. 8. Газ, легший за повітря в 14,5 разів.
ЗАДАЧІ:
1. Визначте кількість атомів Гідрогену в порції речовини водню 3 моль.
2. Визначте кількість молекул в 44,8 л водню.
3. Яка маса 3, 01 • 1023 молекул водню?
РОЗВ’ЯЗУВАННЯ ЗАДАЧ.
1. Дано: Розв’язання:
ν = 3 моль 1.Формули:1.N(молекул) = ν NА; 2.N(атомів) = N(молекул) n
 2.Підставляємо в формули відомі числові значення: N(атомів)-? N(молекул) = 3 моль 6.02 1023 моль -1 = 18, 06 1023 N(атомів) = 18, 06 1023 2 = 36,12 1023.
2.Підставляємо в формули відомі числові значення: N(атомів)-? N(молекул) = 3 моль 6.02 1023 моль -1 = 18, 06 1023 N(атомів) = 18, 06 1023 2 = 36,12 1023.
Відповідь: N(атомів) = 36,12 1023.
2. ![]() Дано: Розв’язання:
Дано: Розв’язання:
V(Н2) = 44, 8 л 1.Формули:1.N(молекул) = ν NА; 2.![]() (молекул) =
(молекул) =![]() NА
NА
2.Підставляємо в формулу відомі числові значення:
N(молекул)-? N(молекул)![]() моль -1= 12,04 1023
моль -1= 12,04 1023
Відповідь: N( молекул) =12,04 1023
3. ![]() Дано: Розв’язання:
Дано: Розв’язання:
N = 3.01 1023 1.Формули: 1.N(молекул) = ν NА; 2.![]()
2.Підставляємо в формули відомі числові значення: m(H2)-?m= 2 г/моль ![]() = 0.5 г.
= 0.5 г.
Відповідь: m(H2) =0.5 г.
Опорна схема ГІДРОГЕН ЯК ХІМІЧНИЙ ЕЛЕМЕНТ
1.Символ,назва, вимова, відкриття.
Н «Аш» Т.Парацельс, Г.Кавендіш(1766), А.Лавуазьє(1783) Гідроген – «hydrogene» - «той, що народжує воду».
2. Положення в ПС, ізотопи, відносна атомна маса.
1 період, І група (А – головна), Ar(H)= 1,0074
Ізотопи:11 Н, 21Н, 31Н протій дейтерій тритій е- = р+=1 е- = р+=1 е- = р+=1 n0 =0 n0 =1 n0 =2
3. Будова атома.
11Н S «сфера» - валентність - І
![]() 1 електронна конфігурація протій 1 S1 – електронна формула, S- елемент
1 електронна конфігурація протій 1 S1 – електронна формула, S- елемент
Н0–1е- Н+ ( катіон, відновник) Н0 +1е Н- ( аніон, окисник) χ = 2,1-неметалічний елемент
4. Ступінь окиснення.
Н20 , H+1Ci-1, N-3H3+1 , H2+1O2-1 , H2+1S+6O4-2 , Na+1H-1, Ca+2H2-1 Найбільш типові / -1 , 0, +1 / гідриди, проста з неметалічними речовина елементами
5. Поширення в природі: Всесвіт – χ =0,75 або 75%
Сонце – 50% ( Гідроген ) 50% (Гелій)
Земля – 4 місце за кількістю атомів
![]() Літосфера, Гідросфера, Атмосфера
Літосфера, Гідросфера, Атмосфера
ВОДЕНЬ ЯК ПРОСТА РЕЧОВИНА
7.Фізичні властивості : 1.газ, 2. без кольору, 3. без запаху, 4.малорозчинний у воді, 5. температура кипіння -2560С, 6. температура плавлення -2590С.
7. Легший за повітря в 14,5 разів, 8. Нетоксичний.
8. Добування: а) в лабораторії ( апарат Кіппа)
![]() Zn+2HCI ( H2SO4) = ZnCI2(ZnSO4) + H2
Zn+2HCI ( H2SO4) = ZnCI2(ZnSO4) + H2
б) промислові способи: 1. Залізо - паровий ( А.Лавуазьє):
3Fe + 4H2O = Fe3O4 + 4H2 ![]() 2.електроліз води:2H2O = 2H2+ O2
2.електроліз води:2H2O = 2H2+ O2
3. конверсія водяними парами:
СН4 + Н2О = СО + 3Н2 С + Н2О = СО + Н2 ( утворення синтез - газу або водяного газу).
3. БЛОК. Добування водню.
Знайомство учнів із способами добування водню в промислових масштабах та в лабораторії. (Використовуються слайди презентації щодо добування та збирання водню в лабораторії завдяки апарату Кіппа).
Запис рівнянь хімічних реакцій, запропонованих Г. Кавендішем та А. Лавуазьє та хімічних процесів, пов’язаних з конверсією водяними парами метану і кам’яного вугілля. Звернути увагу на можливість отримання водню взаємодією лужних металів з водою, але до лабораторних способів його не відносять в силу значних витрат та небезпечності. (Демонстрації: Добування водню та перевірка його на чистоту).
ІІІ. СИСТЕМАТИЗАЦІЯ ТА ЗАКРІПЛЕННЯ НАВЧАЛЬНОГО МАТЕРІАЛУ.
ТЕСТИ (3 БЛОК)
1. Xiмічна реакція цинку iз хлоридною кислотою є реакцією ...
а) сполучення; б) розкладу; в) заміщення; г) обміну; д) нейтралізації.
2. Вкажіть правильне твердження. Добування водню в лабораторії здійснюютъ за допомогою:
а) колби Вюрца; б) евдіометра; в) бюретки;г) апарату Kiппa; д) ділильної лійки.
3. Вкажіть правильне твердження. Для добування водню в лабораторії можна використати...
а) купрум(ІІ) оксид i хлоридну кислоту; б) калій перманганат i хлоридну кислоту;
в) сірководень i цинк оксид; г) цинк i сульфатну кислоту; д) калій хлорат i цинк.
4.Укажіть способи, за допомогою яких в лабораторії збирають водень:
а) методом витіснення води; б) методом витіснення повітря в пробірку, розташовану вниз дном; в)методом витіснення повітря в пробірку, розташовану вверх дном; г) в ділильну воронку. 1. а,б; 2.а, г;3. б,г; 4. а, в.
ЗАДАЧІ:
5.Визначте невідомий лужний метал,якщо при взаємодії 4,6 г його з надлишком води виділилось 2,24 л водню.
6.При взаємодії 8,125 г технічного цинку з масовою часткою домішок 20 % з сульфатною кислотою виділився газ. Визначте його об’єм.
7. Визначте масову частку домішок у зразку технічного магнію масою 6 г, якщо при взаємодії його з хлоридною кислотою виділилось 4,48 л водню.
РОЗВ’ЯЗУВАННЯ ЗАДАЧ.
5. Дано: Розв’язання:
 m( Ме)= 4,6г 4.6 г 2.24 л
m( Ме)= 4,6г 4.6 г 2.24 л
V(Н2) = 2,24 л 2Ме + 2Н2О = 2МеОН + Н2
Ме - ? 2 х г 22.4л
1. Припускаємо,що М = х г/моль, тоді маса 2 моль металу дорівнює
2х г.
2. Розв’язуємо пропорцію: ![]() х =23 г
х =23 г
3.М( Ме) = 23 г/моль Ме – натрій.
Відповідь: Ме – натрій.
6. Дано: Розв’язання:
 m(Znтех.)= 8,125 г 1.w (доміш.)
m(Znтех.)= 8,125 г 1.w (доміш.)![]() (доміш) =w (доміш.)m (техніч.) w(доміш.) = 20% m(доміш) = 0,2 8,125 г = 1,625 г.m(Zn) = 8,125 г – 1,625 г = 6,5 г.
(доміш) =w (доміш.)m (техніч.) w(доміш.) = 20% m(доміш) = 0,2 8,125 г = 1,625 г.m(Zn) = 8,125 г – 1,625 г = 6,5 г.
V(газу)- ? 6,5 г х л
Zn + Н2SO4 = ZnSO4 + Н2
65 г 22.4 л
2. Розв’язуємо пропорцію: ![]() х =2,24 л
х =2,24 л
Відповідь: V(Н2) = 2,24 л.
7.Дано: Розв’язання:
 m( Mgтех.)= 6 г х г 4,48л
m( Mgтех.)= 6 г х г 4,48л
V(Н2) = 4, 48 л Mg + 2НСl = MgCl2+ Н2
w(доміш.)- ? 24г 22.4 л
2. Розв’язуємо пропорцію: ![]() х = 4,8г.
х = 4,8г.
3. m(доміш) =m (техніч.) - m (Mg чист.) = 6 – 4,8 = 1,2 г.
4.w (доміш.) ![]() = 0.2 або 20%
= 0.2 або 20%
Відповідь: w (доміш.) = 0.2 або 20%
ІV. ДОМАШНЄ ЗАВДАННЯ.
1. Згадайте найбільш відомі моделі будови атома та прокоментуйте фактори, за яких від деяких із цих моделей з часом відмовились.
2. Прочитайте історичні відомості з біографій першовідкривачів водню та Гідрогену (Т. Парацельса, Г. Кавендіша), запропонованих в інтернет – ресурсах та підготуйте доповідь про біографічні факти наукової діяльності А. Лавуазьє.
3.Вивчітьопорну схему, яка характеризує Гідроген як хімічний елемент.
4.Виконайте тестові завдання:
1. Укажіть правильне твердження. Водень виступає окисником лише в реакціях з...
а) активними металами; б) сіркою; в) хлором;г) платиноїдами; д) киснем.
2..Вкажітьвсі правильні твердження. Водень виступаєвідновником в реакціях з...
а) активними металами; б)киснем; в) сіркою;г) фтором.
1.а, б; 2.б, в, г.; 3.а, г, б; 4. а, г, в.
3. Виберіть правильне твердження. Гідриди —це сполуки Гідрогену, які є...
а) йонними сполуками Гідрогену з неметалами;
б) ковалентними сполуками Гідрогену з металами;
в) ковалентними полярними сполуками;
г) солеподібними йонними сполуками Гідрогену з типовими металами;
д) сполуками Гідрогену з Карбоном.
4. Запишіть молекулярну, графічну та електронну формули водню. Прокоментуйте утворення певного виду зв’язку між атомами Гідрогену. Який це зв'язок і чому?
5.Укажіть реакцію, за якою добувають водень у лабораторії:
а) С + Н2О = СО + Н2; б) Zn + 2HC1 = ZnCl2 + H2;в) 2NH3 = N2 + 3Н2;
г) 3Fe + 4Н2О = Fe3О4 + 4H2; д) КН + Н2О = КОН + Н2;.
6.Вкажіть, до якого типу належить хімічна реакція алюмініюiз хлоридною кислотою:
а) сполучення; б) розкладу; в) заміщення; г) нейтралізації; д) обміну. Запишіть рівняння реакції.
7. Виберіть правильне твердження. Для добування водню за допомогою anapamaKinna як реагенти найчастіше використовують ...
а) магній та концентровану сульфатну кислоту;б) алюміній та розбавлену нітратну кислоту;в) мідь i хлоридну кислоту;г) цинк i розчин хлороводню у воді;д) алюміній та розчин калійгідроксиду.
8. Сашко разом із своїм однокласником Олексієм вирішили зібрати добутий в лабораторії водень методом витіснення повітря із пробірки. Але Сашко скористався пробіркою, яка була перевернута вверх дном (мал. А.), а Олексій – вниз дном(мал. Б). Кому із цих учнів вдасться зібрати добутий газ? Аргументуйте своє припущення .
А)![]() Б)
Б) ![]()
9. Виберіть правильне твердження. Водень за нормальних умов —це ...
а) газ без кольору і запаху, у 14 разів легший за повітря;
б) газ, добре розчинний у воді, без кольору і запаху;
в) малорозчинний у воді газ із різким запахом;
г) газ без кольору і запаху, у 10 разів легший за повітря;
д) газ без кольору і запаху, малорозчинний у воді.
10. Вкажіть групу, яка містить формули продуктів конверсії (перетворення) метану з водяною парою:
а) СО2 і Н2; б) COі Н2; в) COі НС1;
г) СО2 і H2S; д) С2Н6 і Н2О.
ЗАДАЧІ:
1.Користуючись відносною атомною масою, яка наведена в періодичній системі для Гідрогену та значеннями відносних мас протію і дейтерію, визначте атомні частки цих ізотопів (наявністю в природі тритію знехтувати).
2. Визначте i вкажітъ масу Н2, кількість речовини якого становить 1,45 моль:
а) 2,8 г; б) 1,45 г; в) 29 г; г) 2,9 г; д) 2,5 г.
3. Де більше молекул: в 4.48 л чи в 0,4 гводню?
4. Визначте невідомий метал, хімічний символ якого знаходиться в ІІ групі періодичної системи, якщо при взаємодії 2,4 г його з хлоридною кислотою виділилось 2,24 л водню.
5. Визначте об’єм водню, який виділиться при взаємодії 4 г технічного магнію з масовою часткою домішок 10% з надлишком розчину сульфатної кислоти.
6. Обчислітьi вкажіть, який об'єм водню за нормальних умов витратиться на реакцію з 1,505 • 1023молекулами кисню:
а) 5,6 л; б) 11,2 л; в) 33,6 л; г) 560 мл; д) 1120 мл.
ТЕСТИ (БЛОК 1).
1.Укажіть вимову хімічного символу елемента, який в перекладі з грецької називається - «той, що народжує воду»: а) Гідроген; б) водень; в) аш;г) Гелій.
2.Укажіть назву хімічного елемента, який в перекладі з грецької називається - «той, що народжує воду»: а) Гідроген; б) водень; в) аш; г) Гелій.
3.Укажіть прізвище вченого, який вперше спостерігав виділення водню :
а) Авогадро; б) Кавендіш; в) Шеєле; г) Прістлі; д) Парацельс.
4.Укажіть прізвище вченого, який дослідив фізичні властивості водню та назвав його «горючим газом»:
а) Шеєле; б)Прістлі; в)Авогадро; г)Кавендіш; д) Бутлеров.
5.Укажіть прізвище вченого, який визначив Гідроген як хімічний елемент та дав йому назву:
а)Парацельс; б)Прістлі; в) Шеєле; г)Кавендіш; д) Авогадро. 6.Укажіть назву найбільш поширеного в природіізотопу Гідрогену:
а) Дейтерій; б)Гелій; в) Тритій; г) Гідроксоній; д) Протій.
7.Визначте кількість нейтронів у ядрі атома дейтерію: а) 2; б) 3; в)1; г) 0.
8.Укажіть назву найменш поширеного в природіізотопу Гідрогену:
а) Дейтерій; б) Протій; в)Гідроксоній; г)Тритій; д) Гелій.
9.Гідроген відносять до групи: а) р-елементів; б)d-елементів; в)s-елементів; г)f-елементів.
10. У гідридах Гідроген проявляє властивості: а)ні окисника, ні відновника; б) відновника; в) окисника і відновника; г)окисника.
11.У молекулі метану Гідроген проявляє властивості: а) окисника; б) окисника і відновника; в)відновника; г) ні окисника, ні відновника.
12.Укажіть гідрид-йон: а)Н3О+; б)Н+; в) Н- ; г) ОН-; д) Н2-.
13.Гідроген,отримуючи електрони, проявляє властивості:
а)ні окисника, ні відновника; б)окисника; в) окисника і відновника; г)відновника.
14.Укажіть катіон Гідрогену:а)Н3О+; б)ОН-; в)Н2-; г)Н+ ; д)Н-.
15. Проставте ступені окиснення в формулах запропонованих сполук:
СН4, AlH3, H3PO4, Cr(OH)3.
ТЕСТИ (2 БЛОК).
1.Укажіть тип зв'язку в молекулі водню: а) полярний ковалентний; б) неполярний ковалентний; в) йонний; г) донорно-акцепторний; д) водневий. Поясніть.
2. При утворенні хімічного зв’язку між атомами Гідрогену в молекулі водню відбувається таке перекривання електронних хмарин:а)р - р; б)d - d; в) s –р;г) s - s. Поясніть.
3.Вибірковий диктант. Водень – це:
1.Газ синього кольору за стандартних умов. 5.Газ,який має температуру кипіння - -1830 С 2.Майже нерозчинний у воді газ. 6.Речовина, яка твердне за температури -259,10С
3.Речовина без кольору та запаху. 7. Газ, який є дуже токсичним.
4.Газ, який важко зріджується. 8. Газ, легший за повітря в 14,5 разів.
ЗАДАЧІ:
1. Визначте кількість атомів Гідрогену в порції речовини водню 3 моль.
2. Визначте кількість молекул в 44,8 л водню.
3. Яка маса 3, 01 • 1023 молекул водню?
ТЕСТИ (3 БЛОК)
1.Xiмічна реакція цинку iз хлоридною кислотою є реакцією ...
а) сполучення; б) розкладу; в) заміщення; г) обміну; д) нейтралізації.
2. Вкажіть правильне твердження. Добування водню в лабораторії здійснюютъ за допомогою:
а) колби Вюрца; б) евдіометра; в) бюретки;г) апарату Kiппa; д) ділильної лійки.
3. Вкажіть правильне твердження. Для добування водню в лабораторії можна використати...
а) купрум(ІІ) оксид i хлоридну кислоту; б) калій перманганат i хлоридну кислоту;
в) сірководень i цинк оксид;г) цинк i сульфатну кислоту; д) калій хлорат i цинк.
4.Укажіть способи, за допомогою яких в лабораторії збирають водень:
а) методом витіснення води; б) методом витіснення повітря в пробірку, розташовану вниз дном; в)методом витіснення повітря в пробірку, розташовану вверх дном; г) в ділильну воронку. 1. а,б; 2.а, г; 3. б,г; 4. а, в.
ЗАДАЧІ:
5.Визначте невідомий лужний метал, якщо при взаємодії 4,6 г його з надлишком води виділилось 2,24 л водню.
6.При взаємодії 8,125 г технічного цинку з масовою часткою домішок 20 % з сульфатною кислотою виділився газ. Визначте його об’єм.
7. Визначте масову частку домішок у зразку технічного магнію масою 6 г, якщо при взаємодії його з хлоридною кислотою виділилось 4,48 л водню.


про публікацію авторської розробки
Додати розробку
