Взаємодія води з оксидами. Поняття про гідрати оксидів. Індикатори
Про матеріал
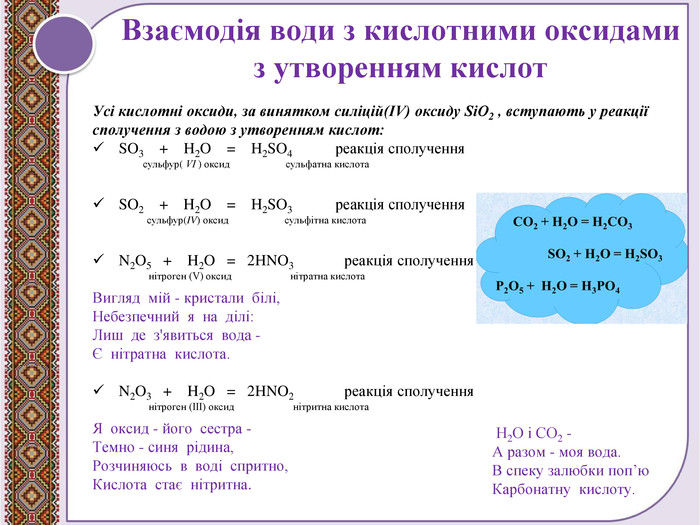
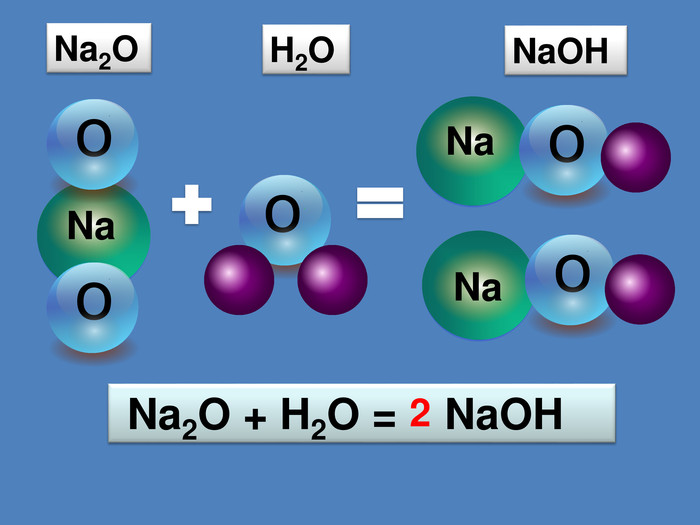
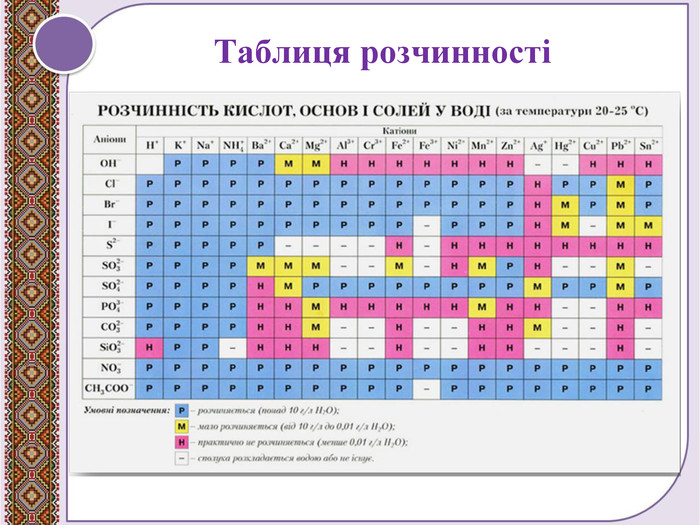
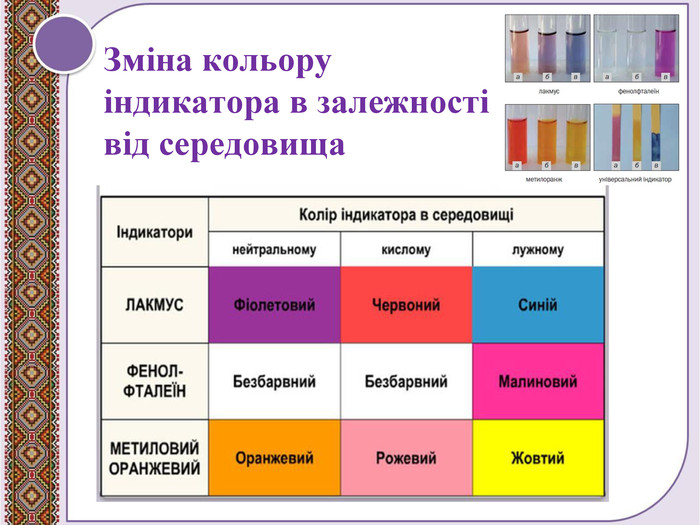
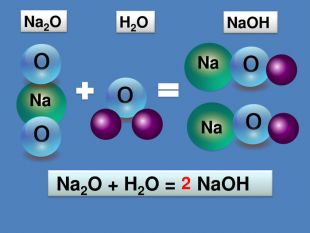
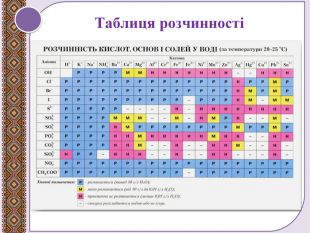
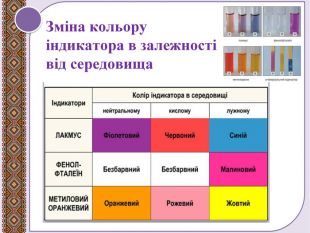
Поглиблення вивчення теми "Взаємодія води з оксидами". Складання рівнянь реакцій. Поняття про індикатори, дія кислот та основ на індикатори. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
-
дякую
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку