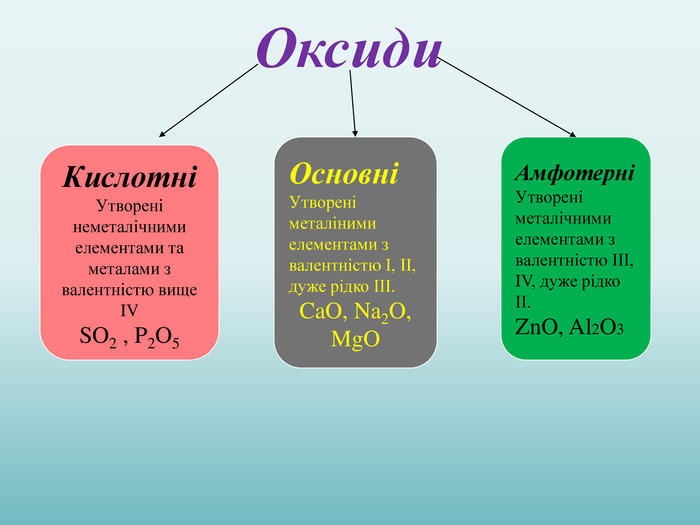
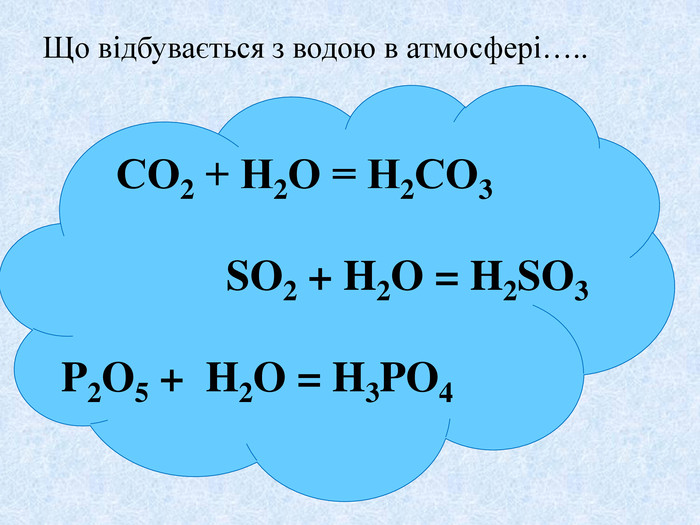
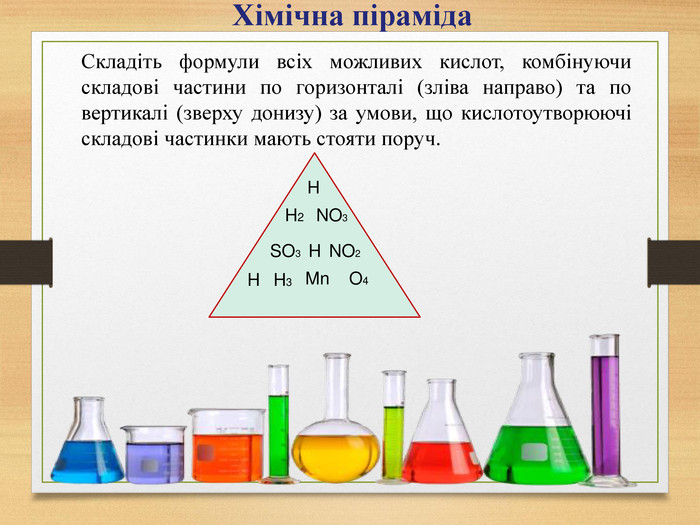
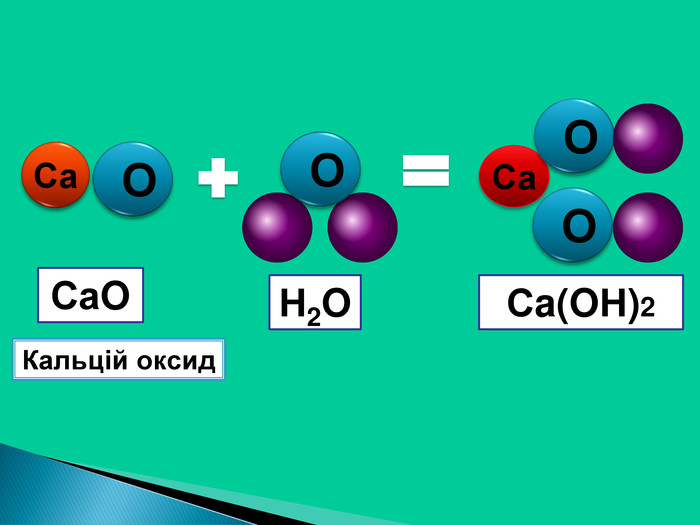
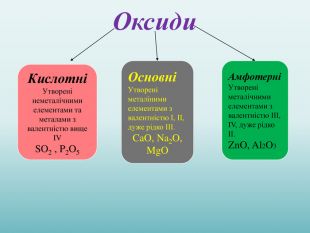
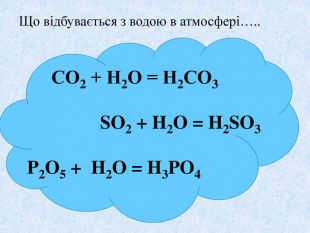
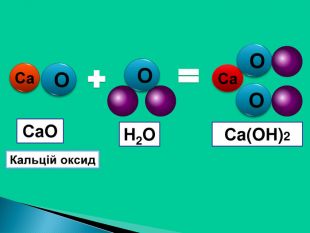
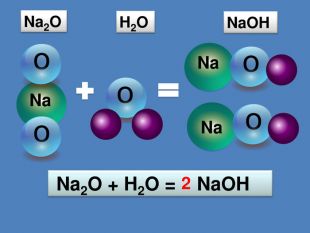
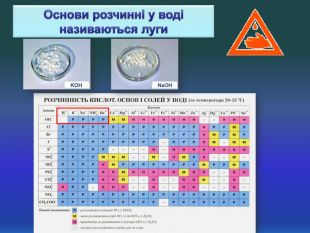
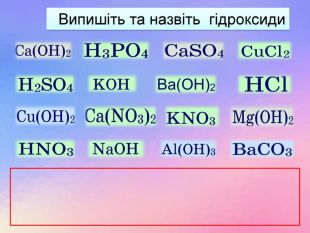
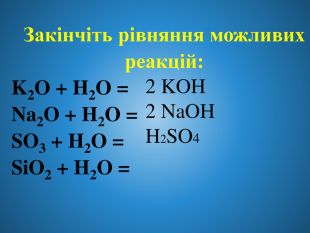
Взаємодія води з оксидами. Поняття про кислоти та основи. Поняття про індикатори.
Про матеріал
Взаємодія води з оксидами. Поняття про кислоти та основи. Поняття про індикатори. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку