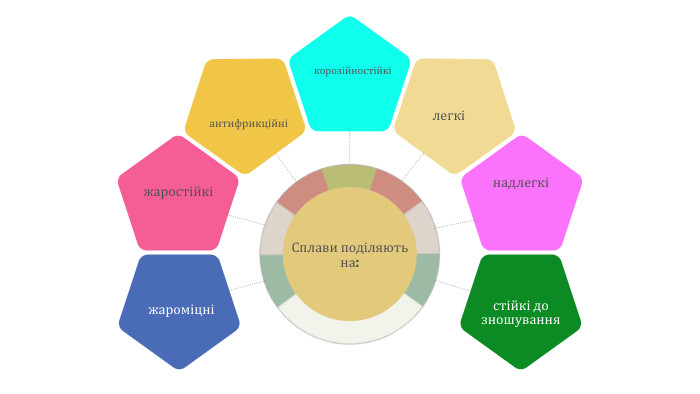
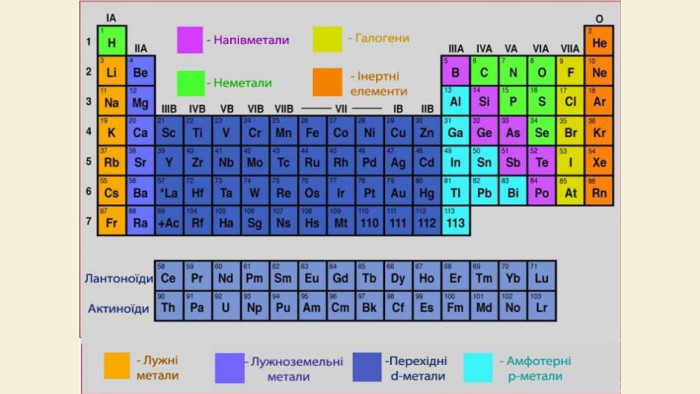
Загальна характеристика металів
Про матеріал
Цілі уроку:
Навчальна: поглибити знання учнів про металічні елементи, їх положення в періодичній системі, про загальні фізичні властивості металів, особливості будови атомів, будови речовин, розширити знання учнів про види хімічного зв’язку введенням поняття про металічний зв’язок; показати його вплив на фізичні властивості речовин, утворених металічними елементами;
Розвивальна: розвивати вміння аналізувати, порівнювати, узагальнювати та робити висновки на основі набутих знань; формувати навички пошукової роботи;
Виховна: сприяти формуванню наукового світогляду, комунікативної та інформаційної компетентності. Перегляд файлу
Зміст слайдів

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку