Заняття "Лужні і лужноземельні метали"
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
Кам'янець-Подільський колледж будівництва, архітектури та дизайну
Лужні і лужноземельні метали
 Конспект показового заняття
Конспект показового заняття

Викладач
ВЛАДИКА О.І.
2018 рік
Тема: Лужні і лужноземельні елементи.
Вид заняття: комбіноване.
Мета:
знати – положення у періодичній системі і будову атомів лужних і лужноземельних елементів; фізичні і хімічні властивості, біологічну роль лужних, лужноземельних металів, магнію та їх сполук, встановити спільні і відмінні ознаки; поняття «твердість води», види та способи усунення твердості води; встановити зв'язок навчального матеріалу з побутом;
вміти – складати рівняння хімічних реакцій, схему будови електронної оболонки атомів; порівнювати, узагальнювати, робити висновки;
виховувати – продовжувати формувати науковий світогляд, сприяти екологічному вихованню.
Обладнання: комп'ютер, проектор, екран, періодична система хімічних елементів, таблиця розчинності кислот, основ, солей, дидактичні картки з тестовими завданнями.
Література:
1.Атестація вчителя. Урок хімії / Упоряд. К.М. Задорожний.-Вид. група «Основа», 2006.
-192 с.
2.Буринська Н.М., Величко Л.П. Хімія, 10 кл. Підручник для загальноосвітніх шкіл.-Київ.2000.
3.Богданова Л.Є. Інтерактивні технології навчання на уроках хімії.-Х.:Вид. група «Основа», 2004.-144с.
4.Довідник учителя хімії в запитаннях та відповідях. / Упоряд. С.В. Василенко.- Х.: Веста: Видавництво «Ранок», 2006.-528с.
5.Інтернет-ресурси.
6.Ярошенко О. Г.Хімія : Підручн. для 10 кл. загальноосвіт. навч. закл. (рівень
стандарту, академічний рівень). — К. : Грамота, 2010. — 224 с. : іл.
Хід заняття
І. Організаційний етап.
ІІ. Перевірка домашнього завдання.
- Декілька учнів отримують картки з тестовими завданнями (дивитись додатки).
- Усні відповіді на запитання:
- Охарактеризуйте положення елементів металів у періодичній системі та особливості будови їх атомів.
- Які властивості проявляють метали при взаємодії з неметалами? Відповідь підтвердіть рівняннями реакцій.
- Які особливості взаємодії металів з кислотами і солями?
- Презентація учнівських проектів:
- Фізичні властивості металів.
- Корозія металів та захист від корозії.
ІІІ. Актуалізація і мотивація пізнавальної діяльності.
- Згадайте, які метали називають лужними? Чому?
- Чому більшість металів зустрічаються у природі у зв'язаному стані?
- Які елементи метали мають важливе значення для живих організмів?
- Чому на деяких нагрівальних приладах утворюється накип?
У зв'язку з тим, що більшість металів мають важливе значення для живих організмів, їх сполуки входять до складу води, вони чинять вплив на їх господарську діяльність людини, ми сьогодні вивчаємо таку тему.
IV. Оголошення теми, мети та плану заняття. (Висвітлено на екрані). 
План заняття.
- Характеристика лужних елементів та їх сполук.
- Характеристика лужноземельних елементів та їх сполук. Магній.
- Біологічна роль лужних, лужноземельних елементів та магнію.
- Поняття про твердість води.
- Методи усунення твердості води.

V. Вивчення нового матеріалу.
При вивченні 1, 2, 3 питання студенти заповнюють таблицю 1(дивитись додатки).
1. Атоми лужних металів мають на зовнішньому електронному рівні по одному електрону. Електрон перебуває у віддаленні від ядра, і атоми легко віддають його. У результаті утворюються однозарядні позитивні йони.

Здатність легко віддавати зовнішні електрони характеризує лужні елементи як найбільш типових представників металічних елементів: металічні властивості в лужних металів виражені дуже сильно.
Лужні метали - сріблясто-білі речовини, крім цезію, у якого золотаве забарвлення. На свіжому повітрі s-метали у розрізі мають блискучу поверхню, але при контакті з киснем повітря дуже швидко тускніє, тому їх зберігають під шаром гасу. Фізичні властивості лужних металів змінюються досить закономірно залежно від положення у періодичній системі елементів, будови атома і структури кристалічної решітки.
Температури плавлення і кипіння для металів ІА-підгрупи низькі, вони зменшуються по групі згори униз, а густини, навпаки, збільшуються.
Лужні метали дуже м’які, пластичні, легко ріжуться ножем, тому їх неможливо використовувати як конструкційні матеріали, але літій і натрій застосовуються у сплавах з іншими металами.
Хімічні властивості лужних металів

У хімічних реакціях атоми лужних металів виявляють сильні відновні властивості, вони легко втрачають валентні електрони, перетворюючись на позитивно заряджені йони - катіони: Mе0 - ē ->Mе+.
Лужні метали належать до найбільш хімічно активних елементів. Їх активність зростає в групі зверху вниз.
З киснем тільки літій окиснюється до оксиду, решта лужних металів дає пероксиди (в яких ступінь окисненя Оксигену дорівнює -1) чи супероксиди (в старій номенклатурі - надпероксиди)
4Li + O2 -> 2Li2O;
2 Na + O2 -> Na2O2;
K + O2 -> KO2 (або K2O4).
З воднем лужні метали утворюють гідриди:
2Li + H2 -> 2LiH;
з азотом - нітриди; при кімнатній температурі у реакцію вступає літій, решта лужних металів - при нагріванні
6Mе + N2 -> 2Mе3N;
з галогенами – галіти:
2Mе + Hal2 -> 2MеHal, де Hal - F, Cl, Br, I;
з сіркою та її аналогами (Se, Te) у розплавленому стані чи при нагріванні – халькогеніди
2Na + S -> Na2S; 2K + S -> K2S;
Взаємодія з водою: (ДЕМОНСТРАЦІЯ) 
При взаємодії з водою утворюються луги і водень:
2K + 2H2O -> 2KOH + H2. 2Na + 2H2O -> 2NaOH + H2.
Взаємодія з кислотами супроводжується виділенням водню та утворенням солі і проходить за загальною схемою:
2Na + 2HCl ->2NaCl + H2.
Оксиди та гідроксиди мають чітко виражений основний характер, що проявляється у взаємодії з кислотними оксидами і кислотами. 
Завдання №1. Напишіть рівняння реакцій натрій оксиду з вуглекислим газом і нітратною кислотою; калій гідроксиду з сульфур (IV) оксидом і сульфатною кислотою.
2.Будова атомів лужноземельних елементів.

В усіх представників цієї родини однакова будова зовнішнього енергетичного рівня, на ньому розміщені 2 електрони. Здатність віддавати 2 зовнішні валентні електрони зростає в підгрупі зі збільшенням атомного радіуса й атомного номера елемента. Максимальний ступінь окиснення становить +2.
Фізичні властивості лужноземельних металів:
У вільному стані всі метали ІІА-підгрупи - сріблясто-білі речовини за винятком берилію, який має світло-сірий колір.
За винятком берилію та радію, всі вони є достатньо ковкими, пластичними і м’якими, хоч і твердіші за лужні метали. Берилій відрізняється значною твердістю та крихкістю, барій при різкому сильному ударі розколюється на окремі шматки.
Температури плавлення та кипіння цих металів вищі, ніж у лужних. Тип зв’язку - металічний - зумовлює високу тепло - і електропровідність.
При переході від Mg до Ca радіус атома змінюється дуже різко, а маса - мало, що й призводить до стрибка густини.
Берилій та магній покриті оксидною плівкою і не змінюються на повітрі. Завдяки хімічній активності та для запобігання взаємодії з повітрям лужноземельні метали зберігать у запаяних ампулах під шаром гасу.
Хімічні властивості лужноземельних елементів.
Взаємодія з простими речовинами 
З киснем повітря
2Mg + O2 = 2 MgO 2Ca + O2 = 2 CaO
З сіркою при нагріванні
Ba + S = BaS Mg + S = MgS Ca + S = CaS
З галогенами
Ca + Cl2 = CaCl2 Mg + Br2 = MgBr2 Ba + I2 = BaI2
З азотом при нагріванні
3Ba + N2 = Ba3N2 2Ca + N2 = Ca3N2 Mg + N2 = Mg3N2
З фосфором при t0
3Ca + 2 P = Ca3P2 3Mg + 2 P = Mg3P2
З воднем при нагріванні
Ca + H2 = CaH2 Mg + H2 = MgH2
Магній повільно розчиняється у воді киплячій, решта металів енергійно-взаємодіють з водою
Ba + 2H2O = Ba(OH)2 + H2↑
Mg + H2O = MgO + H2↑
Ca + 2H2O = Ca(OH)2 + H2↑ (ДЕМОНСТРАЦІЯ) 
Усі метали розчиняються в сильних кислотах
Ca + 2HCl = CaCl2 + H2↑
Mg+ H2SO4 = MgSO4+ H2↑
Оксиди та гідроксиди лужноземельних елементів мають чітко виражені основні властивості: реагують з кислотами та кислотними оксидами з утворенням солей. 
Завдання 2.
Напишіть рівняння реакцій кальцій оксиду з сульфур (IV) оксидом і хлоридною кислотою; кальцій гідроксиду з вуглекислим газом і ортофосфатною кислотою.
Завдання 3.
Напишіть рівняння реакцій магній оксиду з сульфатною кислотою; магній гідроксиду з нітратною кислотою.
3.Біологічна роль. Натрій і Калій – життєво необхідні елементи, які беруть участь в обміні речовин. За вмістом в організмі людини Натрій (0,08%) і Калій (0,23%) належать до мікроелементів, а решта лужних металів – до мікроелементів. Натрій і Калій є антагоністами (при збільшенні кількості Натрію в організмі підсилюється виведення Калію нирками, тобто настає гіпокаліємія).


До родини лужноземельних елементів належать елементи ІІ групи головної підгрупи : Кальцій, стронцій, барій, радій.

У назві родини присутня складова лужно тому, що розчини їх гідратів оксидів теж милкі на дотик. Друга складова назви — земельні — пов'язана з тим, що оксиди цих елементів уперше були виділені з мінералів земної кори.
Магній, як легкий та корозійностійкий метал, використовується в конструкційних сплавах у авіації та автомобілебудуванні. Біологічна роль магнію полягає в необхідності його для правильного функціонування м’язів і нервової системи. І середньому в дорослої людини його міститься всього 25г, більша частина якого сконцентрована в кістках. До організму Магній потрапляє із земним листям овочів, оскільки воно містить хлорофіл – комплексну сполуку, центральним атомом якої є Магній. Кальцій – у виробництві скла, вапняних мінеральних добрив; для каустифікації соди; для виготовлення вапняних будівельних розчинів.

Біологічна роль Кальцію полягає в тому, що в організмі дорослої людини міститься близько 1 кг Кальцію. Приблизно 99% цієї кількості входить до складу кальцій фосфату, що знаходиться в кісткових та зубних тканинах. Без Кальцію неможливо згортання крові, скорочення м’язів і функціонування нервової системи. Засвоєнню цього елемента в організмі сприяє наявність вітаміну D, нестача якого у дитячому віці може викликати рахіт. Кальцій, як Натрій та Калій, також відіграє важливу роль у гомеостазі.
4. Твердість води — якщо вода містить значні кількості солей кальцію і магнію, то таку воду називають твердою, а коли цих солей зовсім немає, або вони містяться в незначних кількостях, то — м’якою. 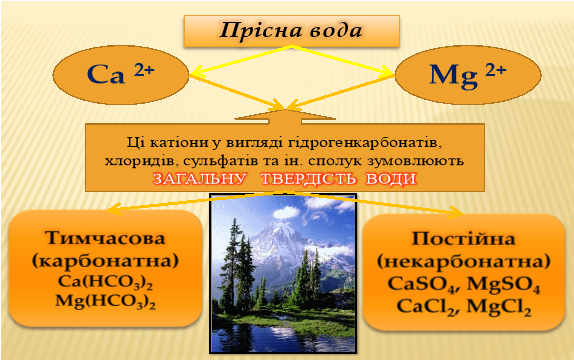
Відрізняють тимчасову, або карбонатну, твердість води і сталу. Тимчасова твердість обумовлюється наявністю кислих карбонатів (гідрокарбонатів) кальцію і магнію: Ca(HCO3)2 і Mg(HCO3)2, а постійна — наявністю сульфатів і хлоридів кальцію і магнію: CaSO4, MgSO4, CaCl2 і MgCl2. Загальна твердість води являє собою суму тимчасової і сталої твердості.
Тверда вода непридатна майже для всіх галузей виробництва. Так, наприклад, тверду воду не можна вживати для прання білизни, миття шерсті і фарбування тканин, бо в ній мило втрачає свою мийну здатність. Це пояснюється тим, що розчинний у воді стеарат натрію, який становить головну складову частину мила, переходить у нерозчинний стеарат кальцію (або магнію), утворюючи так зване кальцієве (або магнієве) мило:
2С 17Н 35СООNa + CaSO4 = Са(С 17Н 35СОО)2 ↓ + Na 2SO4
При цьому мильна піна утворюється тільки після повного осадження іонів кальцію і магнію, на що непродуктивно витрачається багато мила. Крім того, утворюваний осад кальцієвого і магнієвого мила міцно осідає на волокнах тканин і забруднює їх, а при фарбуванні утворює плями.
Тверда вода непридатна і для цілого ряду інших виробництв: паперового, шкіряного, крохмального, спиртового.
Для приготовлення їжі тверду воду теж не вживають, бо в ній погано розварюються м’ясо і овочі. Для пиття вона теж непридатна.
5. Способи усунення твердості води. 
Для зниження твердості води застосовують різні способи. Для того, щоб усунути карбонатну (тимчасову) твердість, використовують такі методи:
1) Ca(НСО3)2 + Са(ОН)2 = 2СаСО3 ↓ + 2Н2О
2) Mg(НСО3)2 + Са(ОН)2 = MgCO3 ↓ +CaCO3 ↓ +2Н 2О
1) Ca(НСО3)2 +2NaOH = СаСO3 ↓ + Na 2СО3 + 2Н 2О
2) Mg(НСО3)2 + 4 NaOH = Mg(OH)2↓+ 2 Na 2СО3 + 2Н 2О
1) Ca(НСО3)2 + Na2СО3 = СаСO3 ↓ + 2 NaHCO3
2) Mg(НСО3)2 + Na 2СО3 = Mg СO3 ↓ + 2 NaHCO3
Карбонатну твердість можна усунути також шляхом нагрівання води до кипіння. При цьому кислі карбонати розкладаються з утворенням нормальних карбонатів кальцію і магнію, які виділяються в осад:
• Са(НСО3)2 = СаСО3 ↓ + Н 2О + СО2 ↑
• Mg(НСО3)2 = MgСО3 ↓ + Н 2О + СО2 ↑
Методи усунення постійної твердості води:
1) СаС12 + Na 2СО3 = СаСO3 ↓ +2NaCl
2) MgSO4 + Na 2СО3 = MgCO3 ↓ + Na 2SO4
Утворені осади карбонатів кальцію і магнію відфільтровують.
1) 3Са SO4 + 2Na3PO4 = Ca3(PO4)2 ↓ + 3Na 2SO4
2) 3 MgSO4 + 2Na3PO4 = Mg3(PO4)2 ↓ + 3Na 2SO4
Завдання 4. Складіть йонні рівняння до молекулярних:
1)3 MgSO4 + 2Na3PO4 = Mg3(PO4)2 ↓ + 3Na 2SO4
2) 3Са(НСО3)2 + 2Na3PO4 = Ca3(PO4)2 ↓ + 6NaНСО3
VІ. Закріплення вивченого матеріалу.
Завдання 1. Неодноразово, при заповненні опалювальної системи водою, досвідчений майстер радить використовувати дощову воду, а не водопровідну. Обгрунтуйте доцільність таких дій.
Завдання 2. Складіть рівняння реакцій за схемою
Са → СаО → СаСІ2
↘ ↓ ↗
Са(ОН)2
Задача 1. Яку масу кальцій гідроксиду необхідно взяти для усунення твердості води, яка зумовлена вмістом у воді 1,5г кальцій гідроген карбонату та 0,5г кальцій гідроген карбонату?
VІІ. Підведення підсумків. Виставлення оцінок.
VІІІ. Завдання додому.
Вивчити конспект.
Параграф 19, 20, ст.155-171.
ДОДАТКИ
Тестові завдання
ВЛАСТИВОСТІ МЕТАЛІВ ТА ЇХ СПОЛУК
(1-9 питання з однією правильною відповідю.)
1.Виберіть рядок, в якому перелічені металічні елементи:
а) Cu, Ag, Fe, H, Sn; б) Na, Mg, Be, S, K;
в) N, H, F, Cl, P; г) Cu, Sn, Pb, Ca, Be.
2.Виберіть підгрупу хімічних елементів, до якої не входять елементи-метали.
а) ІІІ А; б) V Б; в) VII А; г) VII Б.
3.Виберіть найпоширеніший у земній корі метал.
а) Fe; б) Ti; в) Al; г) Ca.
4.Назвіть тип хімічного зв’язку у металах.
а) ковалентний полярний; б) металічний;
в) ковалентний неполярний; г) йонний.
5.Яка властивість не характерна для металів?
а) пластичність; б) крихкість; в) блиск; г) теплопровідність.
6.Виберіть рядок, в якому перелічені методи одержання металів у промисловості :
а) пірометалургія, алюмінотермія, електроліз, гідрометалургія;
б) піроліз, крекінг, пірометалургія, електроліз;
в) ректифікація, відстоювання, рафінування гальванопластика;
г) розкладання, випалювання, крекінг, гідроліз.
7.Виберіть характеристику загальних хімічних властивостей металів.
а)здатність взаємодіяти з основними оксидами;
б) здатність розчинятися в лугах;
в) здатність розчинятися в кислотах;
г) здатність реагувати з азотом.
8.Назвіть метал, який не буде взаємодіяти з хлоридною кислотою?
а) Cu; б) Fe; в) Al; г) Zn.
9. Виберіть правильне твердження:
а) корозія металу прискорюється, якщо він контактує із більш активним металом;
б)корозія – явище руйнування металу унаслідок їх хімічної взаємодії з речовинами довкілля;
в)швидкість корозії не залежить від складу середовища;
г)захистити метали від корозії практично неможливо.
10.Установіть послідовність розташування назв металічних елементів за поширеність їх у природі
а) Алюміній в) Кальцій
б) Калій г) Ферум
11. Виберіть пари речовин, між якими відбудеться хімічна реакція
а) натрій і вода
б) купрум (ІІ) оксид і вода
в) магній оксид і хлорид на кислота
г) алюміній гідроксид і калій гідроксид.
12.Установіть відповідність між назвами хімічних елементів і їх місцем у періодичній системі:
1. Літій а) 3 період, ІІІ група, головна підгрупа
2. Магній б)4 період, VІІІ група, побічна підгрупа
3. Ферум в) 2 період, І група, головна підгрупа
4. Алюміній г) 3 період, ІІ група, головна підгрупа
д) 3 період, ІІ група, побічна підгрупа.
|
ЛУЖНІ ЕЛЕМЕНТИ |
ЛУЖНОЗЕМЕЛЬНІ ЕЛЕМЕНТИ |
||||||
|
№ |
Ознака |
Характеристика |
№ |
Ознака |
Характеристика |
||
|
1 |
Представники |
|
1 |
Представники |
|
||
|
2 |
Положення у ПС |
|
2 |
Положення у ПС |
|
||
|
3 |
Валентність і ступінь окиснення |
|
3 |
Валентність і ступінь окиснення |
|
||
|
4 |
Фізичні властивості
|
|
4 |
Фізичні властивості |
|
||
|
5 |
Хімічні властивості 1. Взаємодія з неметалами |
5 |
Хімічні властивості 1. Взаємодія з неметалами |
||||
|
З галогенами |
|
З галогенами |
|
||||
|
З киснем |
|
З киснем |
|
||||
|
З іншими неметалами |
|
З іншими неметалами |
|
||||
|
2. Взаємодія зі складними речовинами |
2. Взаємодія зі складними речовинами |
||||||
|
З водою |
|
З водою |
|
||||
|
З кислотами |
|
З кислотами |
|
||||
|
З іншими речовинами |
|
З іншими речовинами |
|
||||
|
6 |
Характеристика оксидів і гідроксидів |
|
6 |
Характеристика оксидів і гідроксидів |
|
||
|
|
7 |
Магній
|
|
||||
|
8 |
Біологічна роль
|
Na
|
K
|
8 |
Біологічна роль
|
Ca |
Mg |


про публікацію авторської розробки
Додати розробку
